鈉離子電池簡介 ?
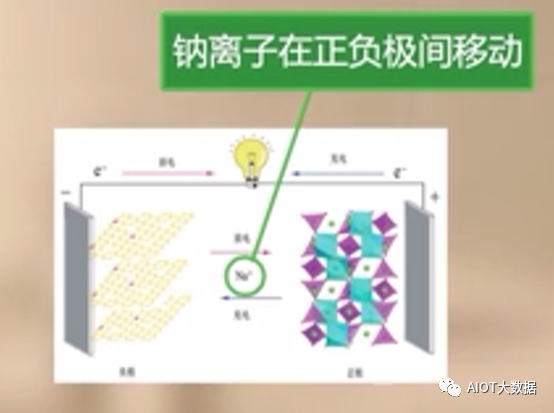
鈉離子電池與鋰離子電池的工作原理類似,鈉離子電池也是一種脫嵌式電池(個人理解:離子從正負極中脫出與嵌入實現電池充放電功能)。主要依靠鈉離子在正極和負極之間的移動來工作,充電時鈉離子從正極脫出嵌入負極,放電時鈉離子從負極脫出嵌入正極。?
?
圖片來源:學堂在線《鋰離子電池材料與技術》??
根據寧德時代發布的數據:? ?
(1)鈉離子電池的電芯(電池去除外殼和保護電路)單體能量密度可達160Wh/kg;?
(2)在常溫下充電15分鐘,鈉離子電池的電量可超過其總電量的80%;?
(3)鈉離子電池在-20℃低溫環境中也擁有超過90%的放電保持率(根據網絡理解:在一定的放電條件下放電至終點電壓所放出的實際電量與額定容量之比,根據網絡資料,鋰離子電池放電保持率最高為70%);?
(4)鈉離子電池的系統集成效率(不能直觀理解系統集成效率超過80%所描述的內容)可以超過80%,其熱穩定超過國家強標(根據網絡資料理解:強制性標準)的安全要求。? ?
鈉離子電池的優點:?
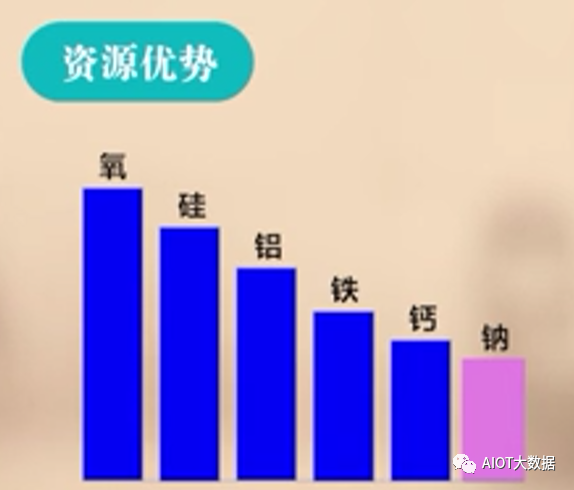
(1)鈉元素的儲量豐富。
鈉元素在地殼中的豐富度位于第六位。并且鈉元素分布于全球各地,不受地域限制。因此,相比鋰離子電池,鈉離子電池具有資源優勢。?
圖片來源:學堂在線《鋰離子電池材料與技術》??
(2)鈉離子電池制造成本相對較低。
鈉離子電池中貴金屬(個人理解:價格較貴的金屬,而不是特指金、銀等貴金屬)含量低,鈉離子電池中不含鈷元素和鋰元素。相比于正級集流體(包裹電極片的金屬箔)為鋁箔、負極集流體為銅箔的鋰離子電池,鈉離子電池因其負極集流體也可以采用鋁箔,而更具有成本優勢。有數據表明鈉離子電池比鋰離子電池的材料成本低30~40%。?

圖片來源:學堂在線《鋰離子電池材料與技術》??
(3)鈉離子電池安全性更高。
鈉離子電池在針刺、擠壓、過充、過放等電池安全測試項目中均不起火、不爆炸。同時鈉離子電池可以徹底放電,使其可以在“0V”的狀態下被運輸,降低電池運輸的安全風險。?
(4)鈉離子電池高低溫性能優越。根據寧德時代的數據,在-20℃的低溫環境下,鈉離子電池仍然有90%以上的放電保持率。(根據網絡資料理解,鈉離子電池的高溫性能優越體現在:鈉離子電池的內阻高于鋰離子電池,在短路的情況下瞬時發熱量更少,溫升較慢,熱失控溫度高于鋰離子電池。)??
(5)鈉離子電池快充能力強。在常溫下充電15分鐘,鈉離子電池電量可超過其總電量的80%。??
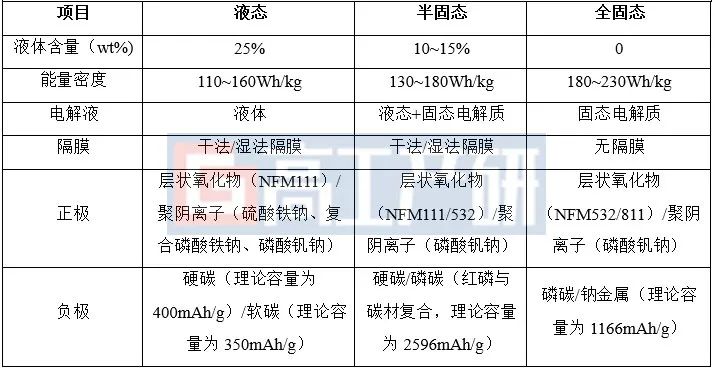
鈉離子電池是一種依靠鈉離子在正負極間移動來完成充電放電工作的電池。相對鋰離子電池,具有低溫充放電安全性較高、回收更環保等優勢。
鈉離子地殼豐度遠高于鋰離子電池,且產地分布較均勻,鈉離子電池材料成本較鋰離子電池有望降低30%-40%。
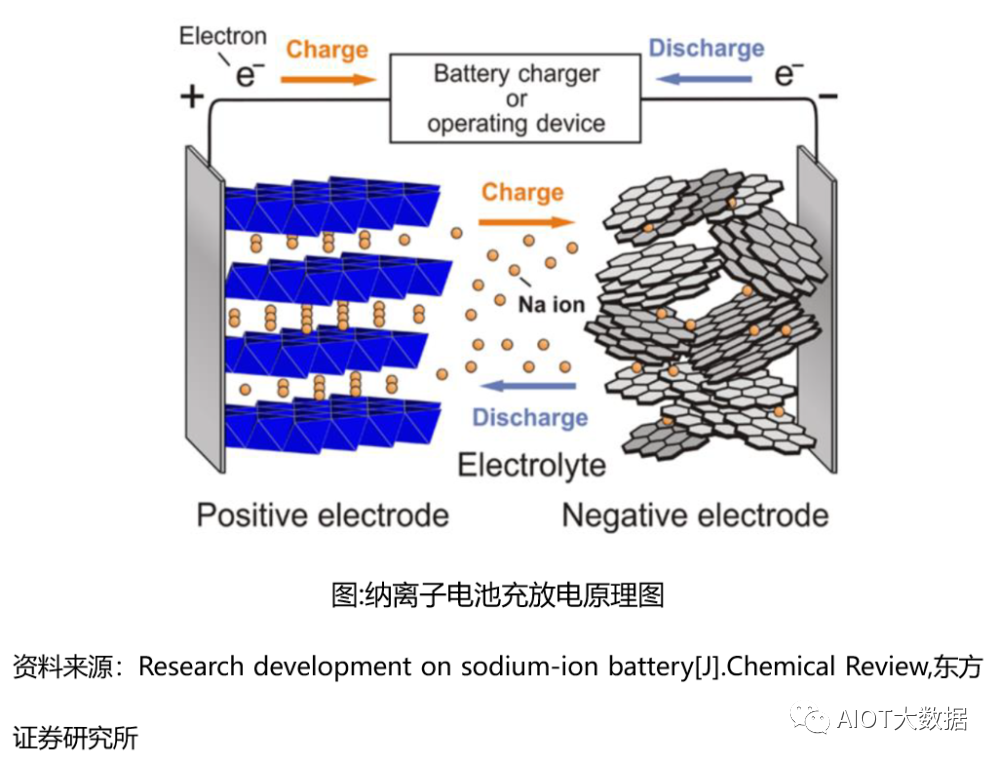
鈉離子電池是一種依靠鈉離子在正負極間移動來完成充電放電工作的電池。主要使用鈉離子(Na+)作為電荷載體體,在電池放電時,負極材料失去電子,鈉離子脫嵌進入到電解液,正極材料中的可變價過渡金屬得到電子發生還原反應,使得電解液中的鈉離子向正極運動并且聯入到正極晶格中,化學能轉化為電能:充電時,外加電壓使反應逆向進行:正極失去電子發生氧化反應,鈉離子從正極晶格中脫嵌進入電解液,負極得到電子發生還原反應,使得電解液中鈉離子向負極移動并插入負極材料中,將電能轉化為化學能儲存起來。
相比于鋰離子電池,鈉離子電池具有一些獨特的優勢,可在零下40攝氏度左右運行,低溫下充放電安全性較高,鈉充電時不易發生內短路,并且回收更環保,在中低續航新能源汽車和儲能等領域具有廣闊應用前景。
在過去十年中,儲能領域已經逐漸進入后鋰電時代,其標志便是鈉離子電池的復興。早在2010年前后,鋰離子電池正深刻改變社會生活之際,科研界就已經注意到鋰資源的匱乏以及全球分布嚴重不均的問題。因此,鈉離子電池技術又逐漸回到了科研界的視野,并且憑借著在研究鋰離子電池技術上積累的經驗得到了快速的發展。僅僅五年以后,即2015年,第一代鈉離子電池就已經邁入了商業化的進程。(如圖1)
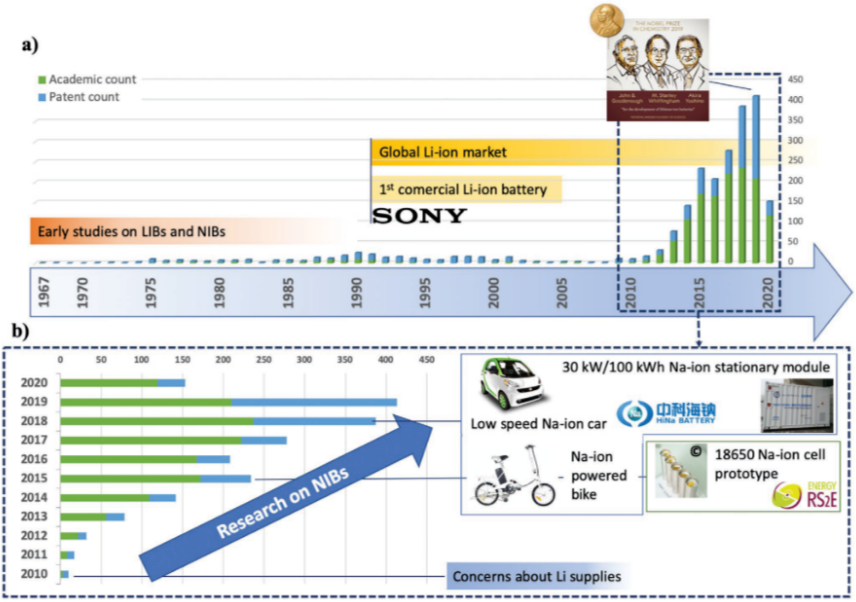
圖1:與鈉離子電池技術相關的學術論文發表數量及專利數量(數據統計截止至2020年5月) 針對鈉離子電池的研究可以追溯到20世紀70年代,近10年來鈉離子電池的相關研究更是迎來了井噴式增長。2011年,全球首家專注鈉離子電池工程化的英國FARADION公司率先成立,之后在全世界范圍內鈉離子電池公司雨后春筍般如約而至。 目前國內外有近二十家企業對鈉離子電池進行產業化相關布局,主要包括英國FARADION公司、美國Natron Energy公司、美國Aquion Energy公司、法國NAIADES計劃團體、日本岸田化學、松下、三菱以及我國的中科海鈉、鈉創新能源、星空鈉電等公司。其中歐洲因其鋰、鈷等重要鋰電上游資源缺乏,相對重視鈉離子電池的發展。 鈉離子電池的工作原理及結構與鋰離子電池十分相似。因此,發展鈉離子電池技術的關鍵同樣在于找到合適的正、負極材料以及電解液。
01?關鍵技術發展情況
1、負極側 目前科研界開發出了金屬氧化物(例如Na(Fe,Ti)O4、TiO2、Na2Ti3O7等)、有機材料、基于轉化及合金化反應的材料(例如Sb基、P基等)、碳基材料等四大類。圖2給出了一些代表性負極材料的能量密度-比容量圖。
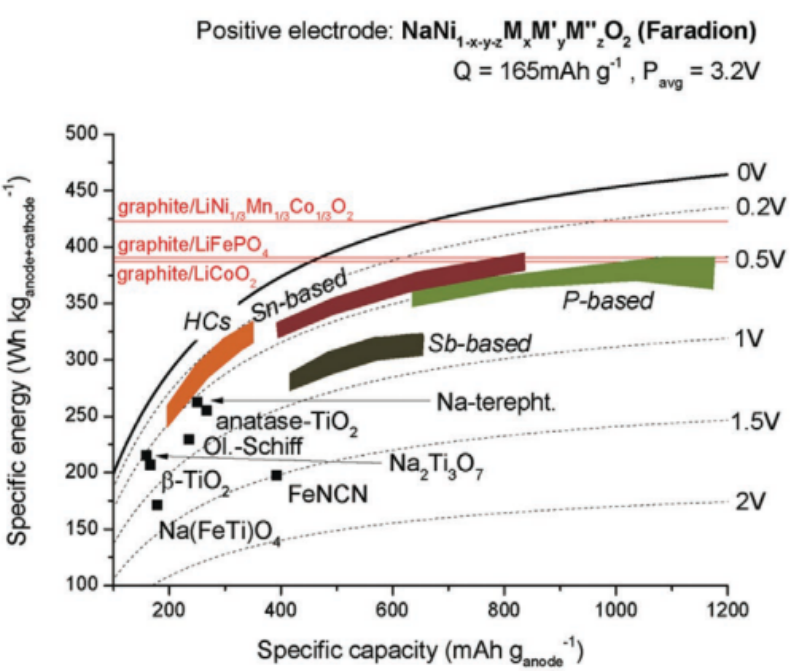
圖2:NIB中使用的各種負極材料的能量密度與比容量范圍,包括硬碳(橙色)、錫基(紅色)和銻基(深綠色)合金以及磷基化合物(淺綠色) 金屬氧化物具有穩固的無機骨架結構往往展現出超長的循環壽命,但因其具有相對較高的分子質量,所以比容量一般都偏低,難以滿足商業化的需要。 有機負極材料最大的特點就是成本低且結構多樣,但是仍然存在很多問題,包括:較低的首圈庫倫效率、循環過程中的極化問題、低電子電導、有機分子在電解質中的溶解問題等等。總的來說,有機鈉離子電池的發展具有很大潛力,但目前對這類材料的研究仍然處在起步階段。 基于轉化及合金化反應的負極材料存在的最大問題即是脫嵌鈉過程中巨大的體積變化導致活性物質的粉化,致使容量迅速衰減。 碳基負極材料主要是指無定形碳(包括硬碳和軟碳)目前主要的工作集中于抑制循環過程中的容量衰減以及提升首圈庫倫效率。軟碳以及還原石墨烯氧化物的比容量可以做到很高,但是相應的工作電壓也高。因此對這些材料的研究重點除了提升首圈庫倫效率,還需要進一步降低工作電壓。從圖3中可以看出,硬碳(HC)通常工作電位較低且具有比較高的容量,也因此,目前商業化的鈉離子電池產品所使用的負極幾乎都是硬碳。
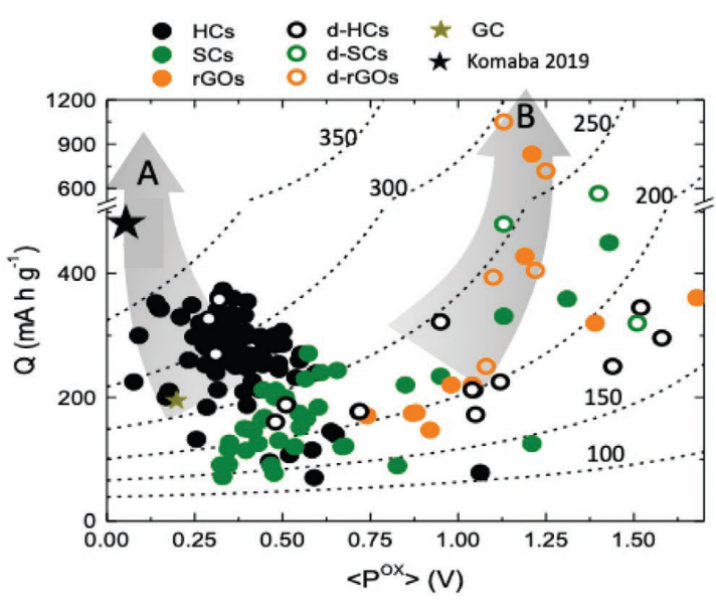
圖3:不同碳基材料的比容量和平均氧化電位。
2、正極側 由于鈉和過渡金屬離子之間較大的半徑差異,有許多功能性的結構都可以實現鈉離子的可逆脫嵌。主要的正極材料包括:層狀過渡金屬氧化物、聚陰離子化合物、普魯士藍類似物(PBA)、基于轉化反應的材料以及有機材料。在上述材料類型中,層狀過渡金屬氧化物(NaxTMO2)、聚陰離子化合物、普魯士藍類似物(PBA,Na2M[Fe(CN)6],其中 M = Fe, Co, Mn, Ni, Cu, 等等)是目前最具發展前景三類材料。 層狀過渡金屬氧化物材料可以實現極佳的電化學性能(較高的比容量、工作電壓以及大于1000圈的循環壽命),其過渡金屬元素往往包含地殼中含量豐富的元素,而且合成過程簡單,可以滿足規模化生產的要求。
聚陰離子材料工作電壓高(對鈉電壓可高達4V),并且結構穩定,缺點是離子電導和電子電導率較低,而且較大的分子質量也拉低了比容量。其中兩種快離子導體材料Na3V2(PO4)3 和 Na3V2O2x(PO4)2F3-2x 因具有相當好的倍率性能和循環壽命在眾多聚陰離子材料中脫穎而出。但是這些材料中的變價元素V具有一定毒性。 普魯士藍類似物具有開放式的骨架結構和很強的結構穩定性,骨架內具有大量的氧化還原位點。目前這類材料可以實現很高的能量密度(大約500–600 Wh kg-1),而且可以通過較低的溫度合成。但是這種材料由于導電性不好需要加入大量碳,這降低了體積比容量。
由于這種物質一般都是在水介質中合成的,其結構中總會包含一些配位水或者間隙水,這不利于其在非水系體系的應用,但卻有利于實現在水系體系中杰出的循環穩定性。另外,由于氰酸根的存在這種材料還有潛在的毒性。 基于轉化反應的正極材料具有很高的理論容量,但是這種材料也具有基于轉化反應和合金化反應的通病——過大的體積變化。另外這類材料還具有較大的過電勢以及較慢的Na離子傳導速度。對于這類材料的開發仍處于起始階段。 有機正極材料不含過渡金屬元素,成本更低并且具有更小的分子量,另外還具有結構多樣性、安全性,機械柔性等。羰基化合物(PTCDA和硫氰酸二鈉)是近年來被研究最廣泛的一類有機正極材料,其主要的缺點是會溶于有機電解液導致容量迅速衰減,其較低的電導率也導致倍率性能不佳。目前此類材料的發展也出于起始階段。
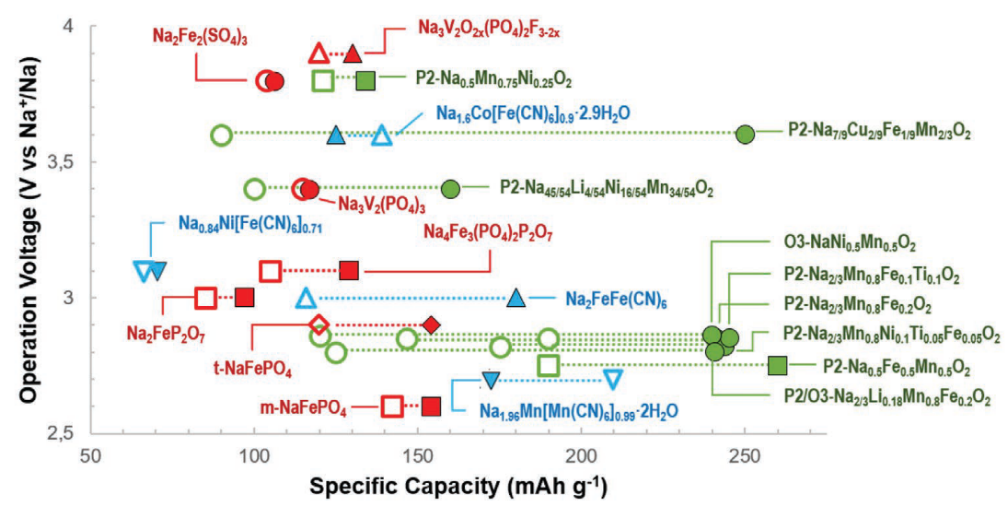
圖4:鈉離子電池體系中最具代表性的負極材料總覽。 總的來說(如圖4),層狀氧化物在三種最有前景的材料中展現了最高的理論容量。聚陰離子具有較低的理論比容量但是它們的實驗比容量非常接近理論容量。不同種類PBA的理論比容量相差較大,并且由于存在意料之外的儲鈉位點有時展現出比理論容量更高的容量。三種類型的材料的實驗比容量大概都在100-200mAh/g之間,這對于制造商業化的電池來說足夠了。
3、電解液 目前開發出的鈉離子電池的電解質與鋰離子電池同樣豐富,包括水系、有機系、固態三大類。它們在不同溫度下的離子電導率如圖5所示。
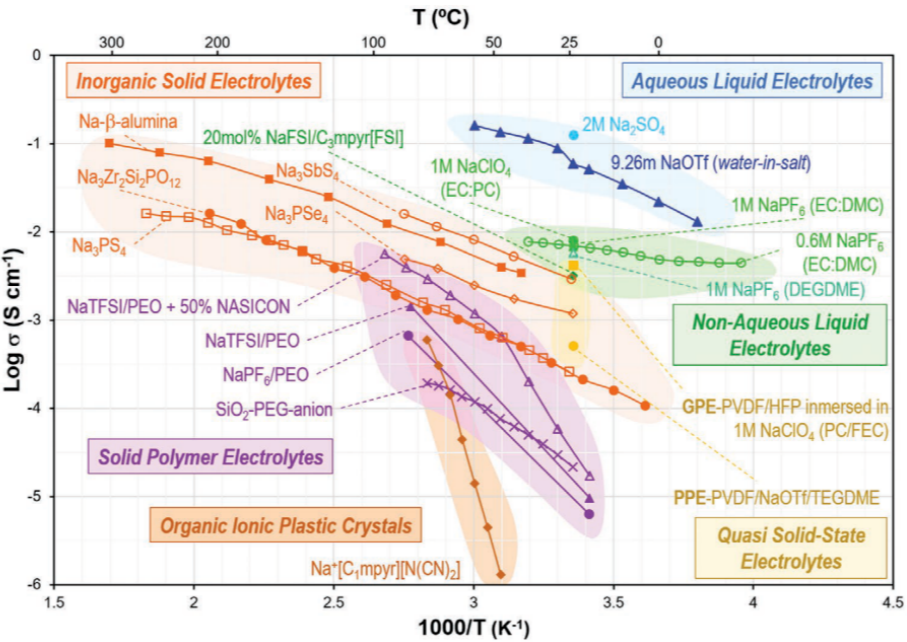
圖5:代表性鈉基電解質的溫度-離子導電性概覽。
水系電解質成本低、安全性高、環境友好,但是由于水的分解電壓限制,其工作窗口太窄,同時還得考慮與電極的適配問題,例如會不會產生腐蝕?如果是嵌入型電極材料,氫離子會不會嵌入進去? 非水系液態電解質仍然是發展最成熟的體系。目前最常見的溶劑是EC:PC 、 EC:DEC也有部分電解液使用PC作單一溶劑。NaClO4則是目前使用最多的鈉鹽,它具有良好的電化學行為,成本低,但是缺點是有爆炸的危險。FEC是最常用的添加劑,有利于在負極形成薄且穩定的SEI。 離子液體電解液通常在60-80℃展現最佳的性能。在室溫下,其離子電導率太低,粘度又太高。離子液體中研究最多的有機分子是咪唑和吡咯烷。對于這種電解液,鈉鹽的濃度是一個關鍵性因素,較高的鈉鹽濃度具有更好的穩定性,并且能經受住更大的電流,但相應成本也會上升。離子液體電解質可以被視為是下一代鈉離子電解質,但是其成本還需進一步下降,工作溫度也需要進一步優化。
固態聚合物電解質含有鈉鹽和彈性聚合物基體,具有良好的通用性、靈活性和熱力學穩定性,但在室溫下的離子電導率很差。通過調節電解質鹽(NaPF6、NaTFI、NaFSI…)和聚合物基體,可以提高這些體系的離子電導率。聚環氧乙烷(PEO)是最常見的能溶解多種鈉鹽的聚合物。 復合固態聚合物電解質由無機填料(SiO2, Al2O3, TiO2…)和固態聚合物電解質組成,由于結晶度和玻璃化轉變溫度(Tg)的降低以及無機填料表面基團與聚合物鏈和鹽的相互作用,提高了離子導電性。 無機固態電解質包括陶瓷體系,因此比較硬,比如氧化物、磷酸鹽、亞硫酸鹽或氫化物等。其中β″-Al2O3 和 快離子導體 Na3Zr2Si2PO12是至今為止使用的最多的固態陶瓷電解質。
無機固態電解質一般只適合高溫或中高溫狀態下使用,例如Na-S電池。其最大的問題在于高硬度帶來的界面接觸問題。對此,科研界提出了用NASICON電解質加少量離子液體組合的方式來緩解界面問題。玻璃材料的使用是另一種前進方向,由于它們易于成型或形成薄膜,它們可以提供與電極的良好接觸。在這方面,硫化物化學是最有前途的化學之一。在LIBs玻璃狀硫化物方面積累的經驗激發了人們對Na10GeP2S12、Na10SnP2S12或Na3PS4等硫化物的興趣。 準固態電解質即指使用液體成分作為增塑聚合物電解質(PPE)以及凝膠聚合物電解質,其中液體增塑劑的含量在50 %左右。
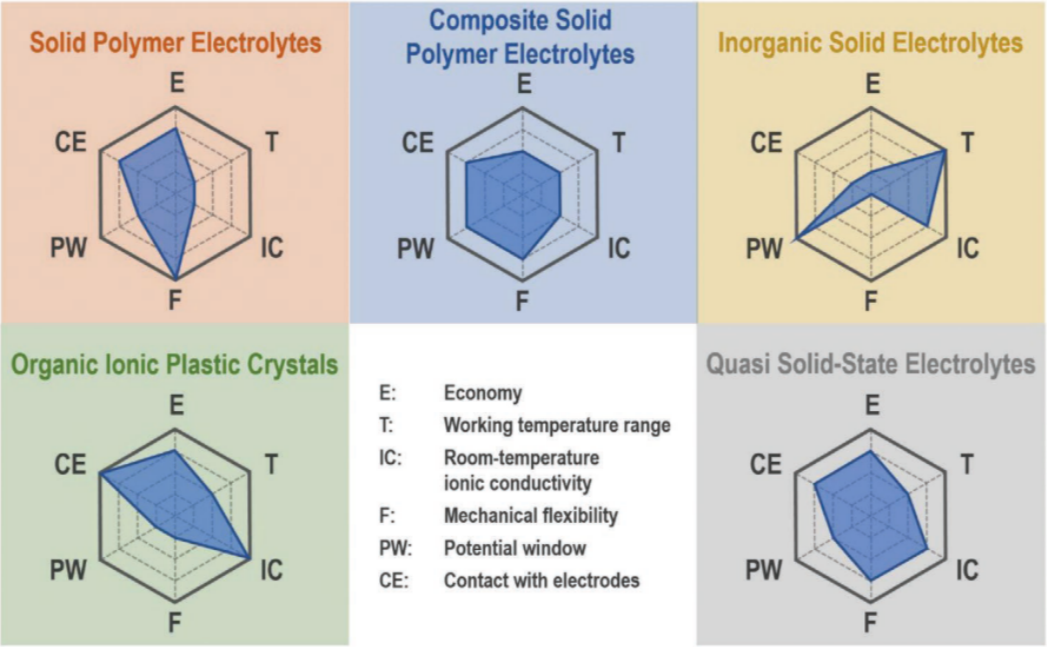
圖6:總結了上文介紹的固體和準固體電解質的主要優缺點。
鈉離子電池電解質的基本要求? 在SIB體系中,電解質是發生電化學反應所必需的離子電荷載體。理想的情況下,鹽/溶劑的結合必須滿足高離子電導率,在寬的電勢范圍內具有電化學穩定性和化學穩定性、良好的熱穩定性、低成本、工藝簡單、低毒性和環境友好型等特點。鈉離子電池對電解液的設計又提出了以下特殊要求:
(1)SIB電解液不僅要考慮高電導率和大的鈉離子遷移數,還要考慮其熱穩定性、經濟效益和固體電解質界面的穩定性。
(2)電解液在不同電極表面產生的SEI層具有不同的組成和性質,從而影響SIB的電化學穩定性,工業生產要注重電解液與電極的匹配。
(3)對一系列電解液在不同體系下進行基礎性的實驗,通過先進的表征與模擬計算來探索溶劑的離子尺寸、溶劑化離子尺寸等,這些參數將會影響在不同結構材料中的儲鈉機制。
(4)應更集中地針對電解液的離子傳輸進行研究,界面性質與電極表面的鈉化合物的形成密切相關,這會表現出不同的離子電導特性和機械強度等特征。因此,在商業上可行的鈉離子電池電解液須滿足以上標準,從而實現鈉離子電池在市場上的高效利用。 鈉離子電池電解質的分類? 和鋰離子電池相似,鈉離子電池電解質主要分為液體電解質、固液復合電解質和固體電解質三大類。其中液體電解質又分為有機液體電解質、水系電解質和離子液體電解質。固體電解質分為無機固體電解質和固體聚合物電解質。有機液體電解質又被分為酯基和醚基電解液。
一般情況下,液體電解質的離子電導率高于固體電解質,因為它們具有較好的流動性,有利于鈉離子的快速遷移。本文將從有機液體電解質、水系電解質和離子液體電解質三個方面介紹鈉離子電池的液體電解質。? 有機液體電解質 鈉離子電池碳酸酯電解液碳酸酯作為一類常用的鈉離子電池有機電解液溶劑,通常具有較強的溶鹽能力。鈉離子電池常用的碳酸酯溶劑主要有:碳酸乙烯酯(EC)、碳酸丙烯酯(PC)、碳酸二乙酯(DEC)、碳酸二甲酯(DMC)等,其物理化學性質見表。?
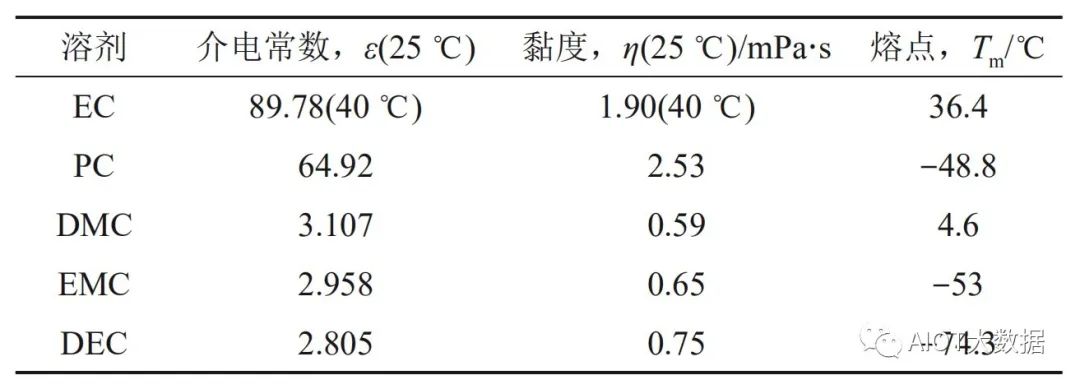
表:碳酸酯溶劑的物理化學性質?
其中,EC和PC溶劑具有電化學窗口寬、介電常數大、化學穩定性好的優點,是鈉離子電池中極具吸引力的有機溶劑。EC 溶劑還可以在碳類負極表面還原形成較穩定的鈍化層,抑制溶劑在低電位下的持續分解。但是,EC溶劑的熔點較高(36.4 ℃),室溫下以固體形式存在,富含EC的有機電解液的低溫性能一般較差。PC溶劑具有低成本、溫度窗口寬的優勢,被認為是一種可以單獨作為鈉離子電解液的有機溶劑。但PC溶劑在硬碳(HC)負極表面難以形成穩定的SEI膜,導致其持續與負極發生副反應,影響電池的循環壽命。因此,在鈉離子電池電解液應用中,含有EC或PC的二元或三元碳酸酯溶劑得到研究者的關注。
? 鈉離子電池醚類電解液? 在鋰離子電池中,醚類電解液很少被作為電解質使用,因為它們在陽極上鈍化能力差,在超過4V以上的工作電壓下不穩定。然而,近年來,在鈉離子電池領域中,醚類電解質已經被廣泛地使用,因為它們在鈉電體系中具有更好的抗氧化還原能力,相比酯類電解質其可以在負極表面生成更薄和具有穩定的SEI膜和高的首次庫侖效率。在碳酸酯類電解液中,Na+不能在石墨層間形成穩定的二元石墨插層化合物結構,導致Na+很難有效地可逆插入石墨電極中。
Adelhelm等發現二甘醇二甲醚(DEGDME)分子可與Na+共同嵌入石墨層間形成三元石墨插層化合物,且不會造成石墨層狀結構的剝離。這個現象引發了研究人員對鈉離子電池醚基電解液的關注。醚類溶劑與鈉離子電池電極材料的電化學兼容性也得到很多研究者的關注。Cui 等研究了醚基電解液中金屬鈉表面SEI的特性,不同的醚溶劑和NaPF6鹽都有利于在金屬鈉表面形成薄且致密的無機SEI膜,其主要成分是Na2O和NaF,能夠有效抑制鈉枝晶的生長。
水系電解質? 水系鈉離子電池是鈉離子電池領域近年來研究的熱點之一。原因是水系鈉離子電池具有以下優點: ① 水溶液電解液代替有機電解液,采用中性電解質,無酸堿污染,本質上解決了有機電解液易燃等安全性問題,穩定安全; ② 資源豐富,價格低廉; ③ 離子電導率高,即使是大尺寸、高厚度的電極,也能實現較高效率和能量密度; ④ 不易燃,不易爆,不易腐蝕,不含危險、有毒物質,可以作為標準品進行運輸; ⑤ 維護成本低,不需要定期維護;
⑥ 水系鈉離子電池相比鋰電池,生產工序簡單,對環境沒有氧氣、水分、潔凈度等要求,容易實現低成本制備,容錯率高。? 但是,在水系電解液中,鈉離子電池的反應熱力學性質受到水分解反應的嚴重影響,存在著水分解引起的負極析氫和正極析氧的副反應問題。
另外,許多鈉鹽化合物在水中的溶解度很大,或遇水容易分解,進一步限制了儲能材料的選擇范圍。不同的電極材料已經被發展適用于水系鈉離子電池。 正極材料主要包括氧化物、聚陰離子材料以及普魯士藍類似物等;負極材料主要包括金屬氧化物以及NASICON型化合物等。 鈉離子電池離子液體電解液? 離子液體(IL)通常由一種特殊的有機陽離子和一種無機或有機陰離子組成,室溫下一般為液體。
在離子液體發展的初期,由于黏度和熔點較高、價格昂貴、需要更高的工作溫度限制了其在電池中的應用。與傳統的電解液相比,離子液體具有可設計性好、電化學窗口寬、安全性能高的優點,近些年來又重新被重視。離子液體電解液作為鈉離子電池電解液的研究多集中在咪唑、吡咯烷(Pyr+)陽離子以及雙三氟甲磺酰亞胺(TFSI?)和雙氟磺酰亞胺(FSI?)陰離子等。
總之,水系和非水系液態電解質的離子電導率值最高,盡管前者的電化學穩定性窗口較低,后者存在與SEI穩定性和可燃性相關的問題,但這些缺點可以通過設計功能性固體電解質來克服。
02 商業化情況
目前商業化鈉離子電池使用的負極材料都是硬碳。而三類主要正極材料都已經有實現商業化生產的例子。英國的Faradion公司、中國的中科海鈉公司都開發出了具有較高比容量的層狀氧化物正極材料,由其構成的全電池甚至可以超過鋰離子電池中的磷酸鐵鋰電池。聚陰離子類的快離子導體以及PBA類材料的正極材料能量密度低一些,但卻可以實現極高的功率密度,適用于高功率輸出設備的需求。美國的Novasis Energies、隸屬于斯坦福的Natron Energy公司則成功開發出了以PBA為正極的的鈉離子電池。
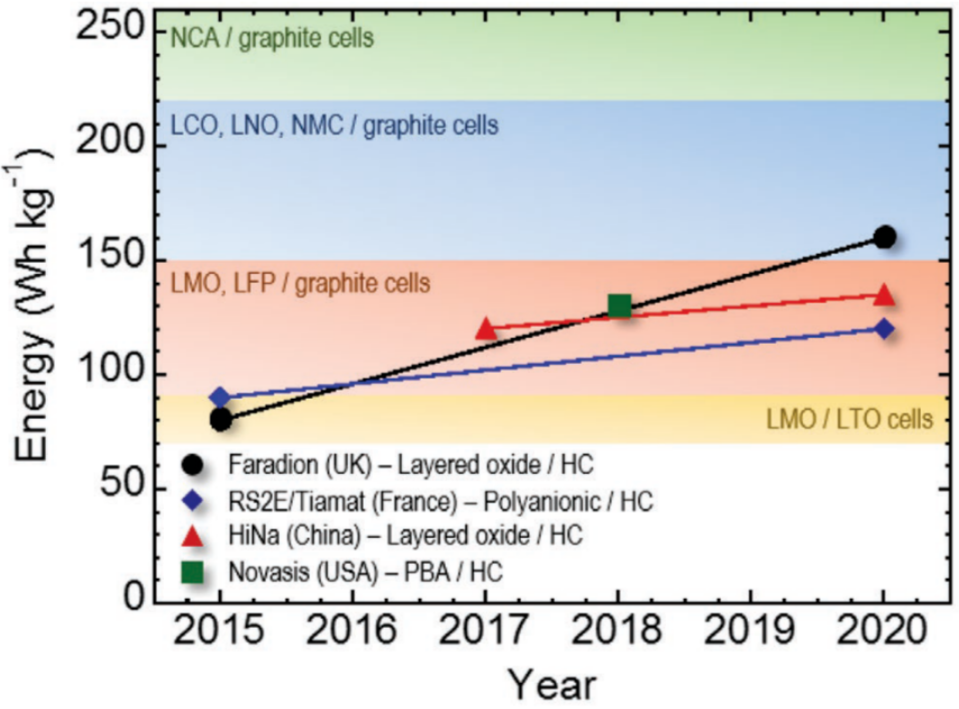
圖7:按比能量和發布年份列出的商用非水系鈉離子電池
英國的法拉第公司(Faradion)在2015年制造了第一個電動自行車的非水系鈉離子電池組。這款電動自行車使用了軟包電池結構的400 Wh電池組。該電池是使用鈉鎳層狀氧化物NaaNi(1-x-y-z)MnxMgyTizO2作為正極制造的。目前,該公司聲稱能夠生產12 Ah 150–160 Wh kg-1(或270–290 Wh L-1)的電池,在1C倍率下循環壽命超過3000圈,并且能夠在-20和60℃之間運行。 同樣是2015年,法國電化學儲能研究網絡(French research network on electrochemical energy storage)推出了第一個18650 Na離子電池,即所謂的RS2E。電池使用Na3V2(PO4)2F3作為正極材料,比能量為90 Wh kg-1。
之后,使用同樣的技術,法國Tiamat開發出了能夠達到2到5 kW kg-1的功率密度(相對于LIBs增加了5倍)的電池,該電池能夠在5分鐘內充滿電。 2015年,美國夏普實驗室與J.B. Goodenough密切合作,證明普魯士白陰極(Na1.92Fe[Fe(CN)6])可以成功規模生產,并組裝得到電壓為3 V的電池。在這一背景下,Novasis Energies最近通過改進電池的組成和加工工藝,使用NaxMnFe(CN)6得到了容量密度為100–130 Wh kg-1(或150–210 Wh L-1)的電池。 2020年,中國的中科海鈉開發出了基于O3相復合正極材料的10 Ah袋式和18650圓柱形電池,重量能量密度達到135 Wh kg-1,放電速率可從1C變化到5C,容量保留率達到90%,在3C下可循環超過3000次。
此外,電池可在?30℃下以0.3 C的速率放電,同時仍保留80%的室溫容量,并在高達85℃的溫度下儲存3天后,在后續循環中可完全恢復容量。 來自斯坦福大學的Natron Energy是一家新成立的公司,它使用PBA作為正極和負極,并用水系電解質開發了一種電池。與有機電池相比,這種電池的能量密度雖然更低,但卻具有高達775 W kg-1(或1550 W L-1)的功率密度。
電池能夠在12C下運行25000圈,容量保持率達70%。 在性能方面,室溫非水系NIB已經具替代部分鋰離子電池的能力(圖7)。此外,考慮到它們仍處于商業化初期,而且大多數研究工作都集中在電極活性材料上,電解質、粘合劑、集電器和其他電池組件的進一步改進還將使鈉離子電池得到進一步發展。 在未來,鈉-空氣或鈉-氧(Na–O2)和室溫鈉-硫(Na–S)電池都是很有前途的高能量密度存儲技術,可以滿足靜態儲能的要求。
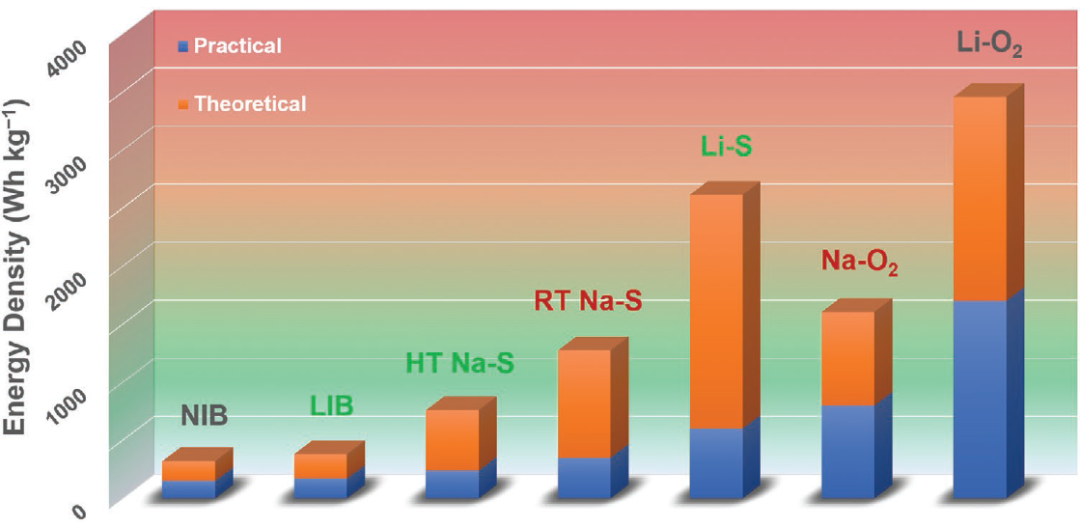
圖8:二次電池的理論和實際能量密度,包括NIB鈉離子電池、LIB鋰離子電池、HT-Na–S高溫鈉硫電池、RT-Na–S室溫鈉硫電池、Li-S鋰硫電池、Na–O2鈉氧電池和Li-O2鋰氧電池。RT-Na-S和Na-O2的理論值分別基于Na2S和Na2O2的放電產物。綠色字體的電池系統已經商業化,灰色字體的電池系統已經在研究界得到廣泛的研究,紅色字體的電池系統則需要進一步開發。 鈉離子電池的能量密度可以做到150Wh/kg上下,與磷酸鐵鋰電池、錳酸鋰電池比較接近,循環壽命可以做到3000~6000次,與磷酸鐵鋰相當,優于錳酸鋰和三元鋰,熱穩定性和安全性與磷酸鐵鋰基本相當。
電池成本分析,鈉離子電池的BOM成本約為0.25元/Wh,而磷酸鐵鋰的BOM成本已超過0.35元/Wh,理論上鈉離子電池材料成本比磷酸鐵鋰電池低30%以上。但現階段鈉離子電池體系由于制備工藝不成熟、生產設備有待改善,導致生產效率較低,產品一致性差,生產良率不高,生產成本明顯高于鋰離子電池,一定程度上抵消了材料成本優勢。 隨著產業鏈逐步完善,以及制程工藝的完善、生產設備的改良,鈉離子電池的成本優勢將會逐步凸顯出來。
總結來說,鈉離子電池具有較為明顯的成本優勢(大規模產業化之后),在循環壽命、安全性方面與磷酸鐵鋰相當,在倍率性能、高低溫性能方面都不弱于各種類型的鋰離子電池,因此比較適合對能量密度要求不高,但是對成本比較敏感,或者對循環壽命要求比較高的應用場景,比如輕型電動車、中低續航的新能源汽車(300公里續航以下)、備用電源、基站電源、電力儲能、工程機械、工業車輛等。 二輪車用鈉電池狀況
憑借優質的性能、低廉的成本等多重優勢,鈉離子電池此番贏了鋰離子電池,成為電動二輪車的新選擇。
“我們預計未來全球電動二輪車銷量穩步增長,增速穩定在10%,預計鈉離子電池對電動二輪車的滲透率在未來幾年呈現快速增長趨勢,由2022年接近0%到2030年的35%至40%。電動二輪車對鈉離子電池需求規模從2021年的0GWh增長到2030年的30GWh。”招商證券研究團隊表示。
電動二輪車行業變革 鈉離子電池系優質替補
中國是全球最有吸引力的電動二輪車市場。
根據弗若斯特沙利文報告,中國電動二輪車總銷量由2017年的3050萬輛增長至2021年的4980萬輛,復合年增長率為13.0%,總銷量占2021年全球總銷量的75.9%。
天風證券表示,電動二輪車行業當下已擺脫“同質化、價格戰”的惡性競爭階段,并逐漸進入以產品升級、產能擴張、渠道布局、品牌價值為主導的良性發展階段。
與此同時,歷經數年發展,方正證券等多家券商機構一致認為,鈉離子電池產業化在即。而鈉離子電池的產業化,將帶來電動二輪車的新一輪變革。
目前,電動二輪車市場涵蓋兩大“派別”,一是以雅迪、愛瑪為代表的傳統勢力,二是以小牛、哈啰為代表的新勢力,新勢力普遍選擇鋰電池路線,傳統勢力除了鋰電池外,還有石墨烯電池路線。
那么,鈉離子電池VS鋰離子電池,誰更勝一籌?
鈉離子電池是一種依靠鈉離子在正負極間移動來完成充電放電工作的電池,主要由正極、負極、電解液、隔膜和集流體組成,其工作原理與鋰離子電池相似。充電時,Na+從正極中脫出,經過隔膜嵌入負極并與電子結合。放電時, Na+從負極脫出經隔膜嵌入正極,電子則從負極經外電路傳遞到正極,最終正極發生氧化還原反應恢復富鈉態。
其實,鈉離子電池技術的研究可以追溯到20世紀70年代,甚至略早于鋰離子電池,但由于20世紀90年代鋰離子電池憑借更為優異的性能成功商業化,鈉離子電池的發展則一度陷入沉寂。
如今,鈉離子電池的時代即將開啟。
2022年以來,國家工信部等各部分發布的政策規劃中,多次提到加強鋰電子電池等高能量密度儲能技術的研發,7月正式推薦指定標準化鈉離子電池符號、命名等。可再生能源的前瞻性研究及儲能的配套滲透率提升已是明確的趨勢,其中鈉離子電池更是研發提升重點。
據招商證券研究,鈉離子電池相較鋰離子電池,具備顯著優勢:電解液導電性能好,低濃度電解液成本低;低溫表現好,熱穩定性高,安全性好;能量密度略低,循環次數相對較高。
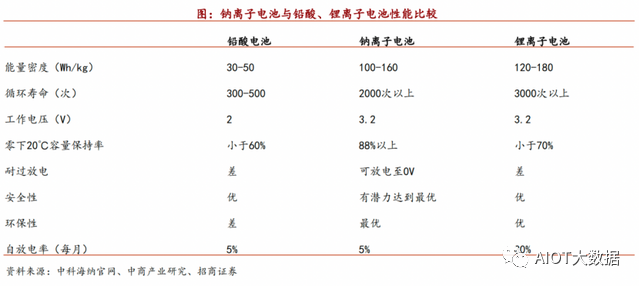
不過,鈉離子電池的成本優勢,才是其成為鋰離子電池優質替補和潛在競爭者的核心武器。
成本優勢加速行業滲透 2023年有望成為運用元年
雖然中國電動二輪車總銷量在全球范圍內遙遙領先,但中國的電動二輪車企業實際上并不那么賺錢,即便是行業巨頭雅迪、愛瑪,毛利率也常年普遍在10%-15%,凈利率不過在2%-5%之間。
那么,在成本上下功夫,就成為了電動二輪車行業打開新利潤增長空間的關鍵。
電動二輪車整車成本拆分來看,電池、電機、控制器為核心組件,成本占比分別為23%、12%、4%;車架、前叉、輪胎、充電器分別占比10%、4%、3%、2%,其他成本占比41%。
也就是說,電池是成本占比最高的部分,電池的價格變化對于單車凈利影響顯著,而鈉元素儲備豐富,成本低,將加速其在電動二輪車行業的滲透。
“近年來受新國標影響,鋰電滲透率快速上升,2021年在百分之二三十,但是2023年受鋰電池價格上漲影響,預計會跌到20%以下。在小動力領域,鈉電池因成本、安全等優勢,會有非常大的替代空間,預計23年會有幾十萬輛搭載鈉電池的電動兩輪車推向市場,2024年會有更多。未來,鈉電池在成本、安全方面有著更大優勢的話,鈉電池在小動力車型上的市占率會在30%-40%,甚至更高。”招商證券在研報中指出。
近年來,隨著對鋰離子電池需求的快速增長,鋰資源的供應愈發緊張。作為全球第四大鋰儲量國,我國卻依然有80%的鋰資源供應依賴進口,主要系我國鹽湖鋰資源品質和外部開發條件較差,導致開發難度大、成本高,供應能力較弱。
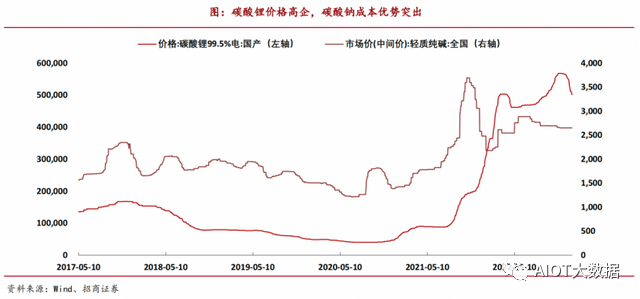
在電池正極材料中,據上海鋼聯發布數據顯示,電池級碳酸鋰的價格在2022年11月中旬達到峰值,每噸報價一度超過60萬元。今年2月中旬以來,鋰鹽價格連續下行,截至3月2日,電池級碳酸鋰均價跌至38.25萬元/噸,但相較2021年下半年依舊翻了幾番。
而鈉離子電池層狀氧化物有著先天的成本優勢,不僅因為其材料可以借鑒鋰離子電池常用的技術成熟度很高的固相法或共沉淀法實現低成本規模化生產,還因為其可供選擇的活性元素豐富。碳酸鈉提鈉簡單,供給充足,價格穩定低廉,價格僅為2650元/噸(輕質純堿,截止23年1月6日),是碳酸鋰價格的0.47%。且制備工藝簡單,僅需把金屬氧化物和碳酸鈉混合研磨加熱,并不需要太多輔料。
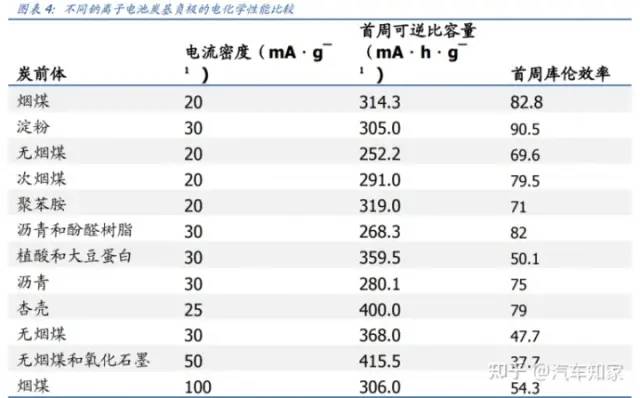
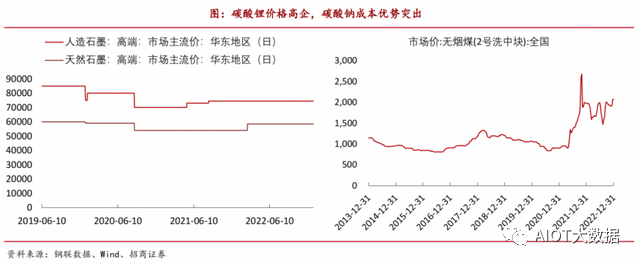
負極材料方面,石墨是目前在鋰離子電池中應用最廣泛的負極材料,具有低成本、高比容量(可達360mA·h/g,理論372mA·h/g)等優點。截至2023年2月24日,人造石墨高端、天然石墨高端報價分別為6.1萬元/噸、5.9萬元/噸。
但在鈉離子電池中,石墨材料在碳酸酯電解液中的可逆比容量不足50mA·h/g,應用受到了很大的限制,而無定形碳類負極(包括硬碳和軟碳)表現出較高的可逆比容量和較好的循環性能。其采用的無煙煤成本非常低廉,通過簡單粉碎和一步碳化便可制得(產碳率高達90%),可逆比容量達220mA·h/g。截至2022年12月31日,全國無煙煤市場價為2072.1元/噸,較石墨價格差距極大。
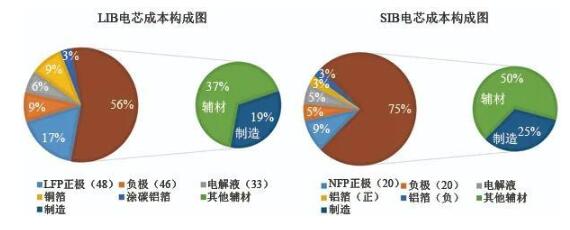
據中科海納測算,以NaCuFeMnO/軟碳體系的鈉離子電池,相較磷酸鐵鋰/石墨體系的鋰離子電池材料,成本可降低30-40%。從成本材料結構來看,鋰離子電池正極材料成本占比最高(約43%),而鈉離子電池的正極材料成本僅為26%。
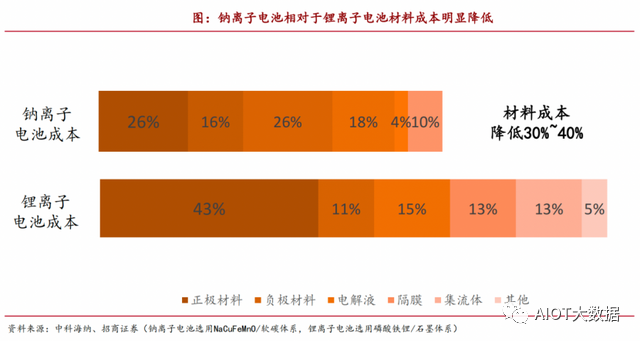
值得一提的是,在工藝制造上,鈉離子電池和鋰離子電池還具備一定的通用性,差異主要是材料體系的不同,基本可以實現與鋰離子電池生產設備、工藝的兼容,產線可進行快速切換,轉換成本較低。
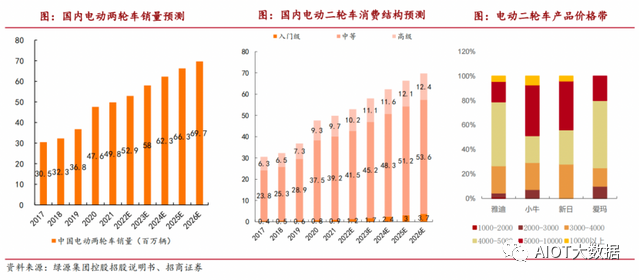
未來幾年復合增長率7.1% 主要增量將由中高級車型貢獻
展望未來,電動二輪車行業將維持高增趨勢。
從總量上看,招商證券表示,電動二輪車行業2023年仍將維持10%+的行業增長。隨著商業方面及個人消費者方面的客戶群不斷擴大,預期中國電動二輪車市場的總銷量將于2026年達到6970萬輛,較2022年的復合年增長率為7.1%。
2019年4月,電動車《新國標》開始實施,對2019年4月15日前購買的不符合《新國標》的電動兩輪車實行3-5年過渡期管理,過渡期結束后的超標電動兩輪車將禁止上路行駛。這一政策為電動車行業帶來了明顯的置換需求。
從新國標執行區域情況看,2021年新國標主要執行省市有上海、蘭州、咸寧、北京等,合計可替換量525萬輛,2022年新國標主要執行省市有重慶、錦州、宜昌、杭州等,對應可替換量合計為583萬輛。
在招商證券看來,2023年新國標主要執行省市有贛州、鄭州、長沙等,對應可替換量為590萬輛,不低于2021、2022年。
“從結構上看,行業的主要增量將由中等車型、高級車型增長貢獻,市場價格競爭正在逐步好轉,行業升級趨勢仍確定,短期部分地區存在價格戰可能,但從全局看,在產品升級的大背景下,市場已無全面價格戰空間。”招商證券進一步表示。
而從產品端來看,未來隨著鈉離子電池逐步運用,一方面,產品價格帶可以有效提升,另一方面,鈉離子電池規模逐步擴大,成本有望持續下降,單車售價及凈利空間進一步打開。
行業龍頭估值、業績 戴維斯雙擊可期
電動二輪車產業處于高速發展期,二輪車企更加“內卷”。
電動車行業領航者雅迪控股,也是全球銷冠,在國內共有3353名分銷商以及眾多子分銷商,2.8萬個銷售點遍布國內。還在德國、法國、瑞士等世界各地建立分銷渠道。產品方面,雅迪控股冠能二代系列和高端VFLY系列在駕馭性能和外觀設計上均有卓越表現。
招商證券在研報中提到,考慮到2023年雅迪控股電池自貢比例有望持續提升(有望提升至50%),此舉將會帶來公司成本端的顯著優化,當前股價對應PE分別為21X、15X、12X,參考其歷史估值中樞25X,23全年估值、業績雙擊可期。
二輪車另一巨頭愛瑪科技,深耕行業二十余載,經銷商數量超過2000家,門店數量已超3萬家,和其他行業龍頭相比,門店數量仍有1-2萬家的提升空間。公司新品開發在質量目標達成率、新品交付并上市時間目標達成率和成本目標達成率方面有明顯提升,新品的毛利水平同比亦有明顯提升。隨著新的電池技術持續運用,公司產品力有望持續領先中小品牌。
聚焦摩托車主業的錢江摩托,擁有“錢江”、“QJMOTOR”、“Benelli”等國內外知名品牌,并通過國際一流技術品牌的戰略合作,帶動公司品牌實力傳播。截至2021年,錢江摩托各品牌在國內共擁有5000多家經銷商門店,包括省會旗艦店200多家,地級專賣店2600多家,縣級體驗店3000多家。
說說普魯士藍
說起世界上最純正的藍,那冠軍一定非它莫屬。它披著一層神秘面紗,隱藏在藍藍的夜色中,托起無數人心中藍藍的夢,現代有機合成之父——“藍精靈”羅伯特·伯恩斯·伍德沃德(Robert Burns Woodward)發現。
一、普魯士藍簡介
普魯士藍(Prussian blue,簡稱PB),化學名稱為亞鐵氰化鐵(ferric ferrocyanide)或六氰合鐵(II)酸鐵(III) (ferric hexacyanoferrate),又名柏林藍(Berlin blue)、中國藍、華藍(Chinese blue)、巴黎藍(Paris blue)、米洛麗藍、密羅里藍 (Milori blue)、鐵藍(iron blue)、礦藍(mineral blue)、顏料藍27(Pigment blue 27)、貢藍等,是人類發現的第一個配位化合物。它作為一種性能優良的藍色染料,廣泛用于油漆、油墨、蠟筆、涂飾漆紙等著色。
二、普魯士藍的發現歷程
德國柏林的涂料工人海因里希·狄斯巴赫(Heinrich Diesbach)的本職工作是用明礬提取胭脂蟲中的胭脂蟲紅(cochineal),加入硫酸亞鐵并用固定堿處理使其沉淀。一天他的堿不夠用了,便向煉金術士約翰·康拉德·迪佩爾(Johann Conrad Dippel)借了一些。與往常一樣,在加入礬土后得到了白色的物質.但當他嘗試蒸發濃縮的時候,他意外地發現沉淀物逐漸變成了深藍色。他把這個現象告訴了迪佩爾,最后發現是迪佩爾之前反復用這種堿蒸餾一種“動物油(animal oil)”所導致的。在這個過程中,牛血(bullock's blood)(含碳、氮)通過焙燒進入堿液(草木灰,含K2CO3)中,得到黃血鹽。這種藍顏料很快被大量制備并投入使用,根據其發源地被命名為“普魯士藍”或“柏林藍”。普魯士軍隊的制服使用的就是這種顏色。
三、黃血鹽VS赤血鹽
顧名思義,黃血鹽是黃色的,赤血鹽是深紅色的,他們是由不同價態鐵的氰配合物形成的穩定的鉀鹽。

左為黃血鹽,右為赤血鹽
1.黃血鹽
亞鐵氰化鉀(potassium ferrocyanide)或六氰合鐵(II)酸鉀(potassium hexacyanoferrate),俗名黃血鹽,化學式為K4[Fe(CN)6],其中鐵元素顯+II氧化態。黃血鹽不易水解,可由Fe2+與KCN反應制備:
Fe2++2CN- ====Fe(CN)2↓
Fe(CN)2+4CN- ====[Fe(CN)6]4-
黃血鹽易被氧化劑氧化為赤血鹽:
[Fe(CN)6]3- + e-====[Fe(CN)6]4-?????E?=0.358 V
相比之下,Fe3+ +e====Fe2+???????????E?=0.771 V
注:數據摘自W. M. Haynes. CRC Handbook of Chemistry and Physics. 93rd ed. Boca Raton: CRC Press Inc,2012-2013:5-80~5-89.
2.赤血鹽
鐵氰化鉀(potassium ferricyanide)或六氰合鐵(III)酸鉀(potassium hexacyanoferrate(III)),俗名赤血鹽,化學式為K3[Fe(CN)6],其中鐵元素顯+III氧化態。赤血鹽會發生微弱的水解反應,使得赤血鹽毒性比黃血鹽大:
[Fe(CN)6]3-+3H2O====Fe(OH)3↓+3CN-+3HCN
E?([Fe(CN)6]3-/[Fe(CN)6]4-)不隨pH的改變而改變,赤血鹽在堿性條件下有較強氧化性。
四、普魯士藍VS滕氏藍
普魯士藍由德國人狄斯巴赫所發現,而滕氏藍(Turnbull's blue,簡稱TB),則是一種來自東方的藍。普魯士藍和滕氏藍都可作為藍色顏料使用。由于普魯士藍的藍色更深、原料更易得等原因而更受親睞。
普魯士藍可由Fe3+與黃血鹽反應制得,而滕氏藍由Fe2+與赤血鹽反應制得。如果按照復分解反應來看,那么應該是:
4Fe3++3[FeII(CN)6]4-====FeIII4[FeII(CN)6]3↓(普魯士藍)
3Fe2++2[FeIII(CN)6]3-====FeII3[FeIII(CN)6]2↓(滕氏藍)
如果對比鐵與氰基的比例,可以發現不溶性普魯士藍(insoluble Prussian blue)和滕氏藍的化學式并不相同。但前人對它們做了許多研究,如單晶X射線衍射(single crystal X-ray diffraction)[3]、中子衍射(neutron diffraction)[4]、氧化電勢(oxidization potential)的測量[5]、順磁磁化率(paramagnetic susceptibility)的測定[6]、聲子吸收光譜(phonon absorption spectrum)[7]和穆斯堡爾譜(M?ssbauer spectrum)[8]等方法,最終表明它們其實具有相同的結構,均為FeIII4[FeII(CN)6]3·xH2O(x=14~16)。這樣便能使不溶性普魯士藍和滕氏藍擁有相同的化學式[4,8-9]:
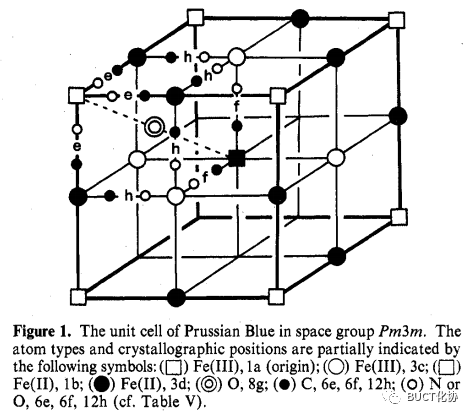
(圖注:Pm3m空間群下的普魯士藍。上述符號部分地表示了原子類型和晶體位置)
曾經認為普魯士藍的顏色是通過兩種價態鐵之間的共振實現的,但梅爾文·B·羅賓(Melvin B. Robin)通過量子力學的計算否定了這種觀點。實際上,低自旋的Fe(II)與高自旋的Fe(III)之間電荷轉移(charge-transfer)吸收可見光,形成藍色。而通過對穆斯堡爾譜的解析,上式中的FeII3[FeIII(CN)6]2(鐵氰化亞鐵)被認為是滕氏藍的前體物質或普魯士藍的電子激發態,而非滕氏藍。
不過,華中師范大學祝心德等三位教授重新研究了兩者的穆斯堡爾譜,并認為普魯士藍和滕氏藍是兩種不同的物質。他們推斷普魯士藍和滕氏藍有相同的晶體結構和外接離子位置,只是它們的電子結構不同。對于普魯士藍為什么比滕氏藍顏色更深,他們給出了兩種合理的解釋:一是在氰配合物中,中心離子FeIII比FeII的分裂能Δo更大,發生d-d躍遷時吸收光的波長更短,顏色更淺,因此由含[FeIII(CN)6]3-的赤血鹽制得的滕氏藍比由含[FeII(CN)6]4-的黃血鹽制得的普魯士藍顏色更淺。二是經過他們的計算機擬合,滕氏藍存在Fe2+與鄰近[FeIII(CN)6] 3-之間的電子躍遷而普魯士藍中不存在,這也表明滕氏藍電子躍遷所需能量大,顏色淺。
除了不溶性普魯士藍和滕氏藍,還有一種以膠體的形式存在的可溶性普魯士藍(soluble Prussian blue, KFeIII[FeII(CN)6])或稱亞鐵氰化鐵鉀(potassium ferric ferrocyanide)或六氰合鐵(II)酸鐵(III)鉀(potassium ferric hexacyanoferrate)?[8],將黃血鹽與鐵鹽混合即可得到。唯一的制法區別是,如若Fe3+過量,則得到不溶性普魯士藍。
K++Fe3++[FeII(CN)6]4-====KFeIII[FeII(CN)6]
在可溶性普魯士藍的結構中,K+占據一半(實際超過一半)的1/8晶胞空隙且兩兩不相鄰(未畫出),Fe(II)與Fe(III)通過氰基兩端緊密橋聯:
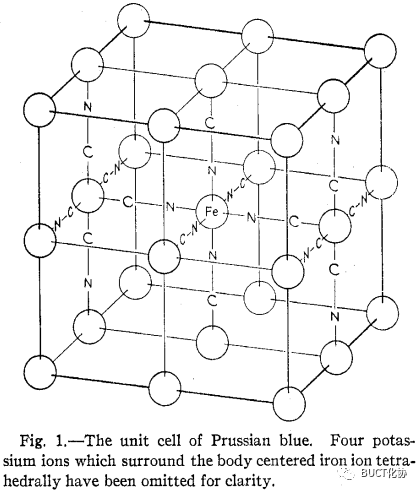
圖注:(可溶性)普魯士藍晶胞。為清晰起見,體心處鐵離子周圍的呈四面體分布的四個鉀離子被省略。
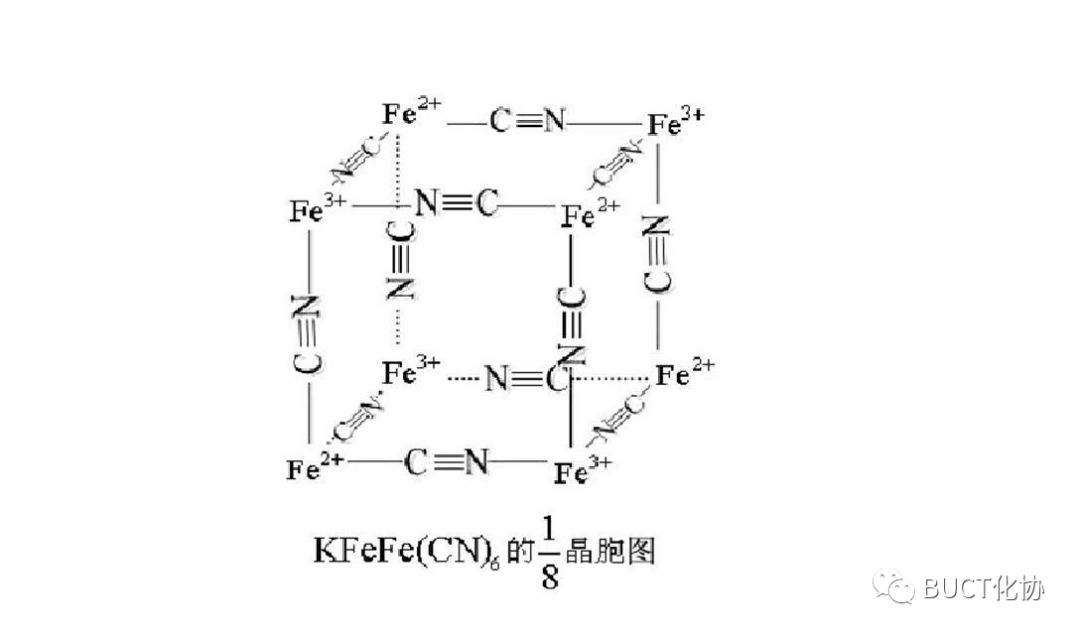
可溶性普魯士藍KFeIII[FeII(CN)6]的1/8晶胞圖
五、柏林白VS柏林綠
在大一“元素及化合物性質(二)”實驗中,如果你別有用心的話,將Fe2+與黃血鹽混合、Fe3+與赤血鹽混合,不出意外,也都會得到沉淀物。其中,Fe2+與黃血鹽反應得到白色沉淀柏林白(Berlin white, FeII2[FeII(CN)6]或K2FeII[FeII(CN)6])、威廉姆斯白(Williamson's white)、普魯士白(Prussian white)或埃弗里特鹽(Everitt's salt),即亞鐵氰化亞鐵(ferrous ferrocyanide)或亞鐵氰化亞鐵鉀(potassium ferrous ferrocyanide);Fe3+與赤血鹽反應得到綠色沉淀柏林綠(Berlin green, FeIII[FeIII(CN)6])或普魯士棕(Prussian brown)經部分氧化形成的普魯士綠(Prussian green)(類似于氫氧化亞鐵的氧化),即鐵氰化鐵(ferric ferricyanide) 。
如果你還有印象的話,狄斯巴赫最開始得到的白色物質便是柏林白。當他蒸發濃縮的時候,柏林白中4/7的Fe(II)被空氣中的氧氣氧化為Fe(III),于是便形成了普魯士藍。
柏林白和柏林綠沒有普魯士藍和滕氏藍顏色那么深,原因就是在于它們之中鐵元素具有相同的價態,不易發生電荷的轉移。
六、普魯士藍的其它用途 ? 除了用作性能優良的藍色染料,普魯士藍還有許多其它用途逐漸被人們發現,尤其是普魯士藍納米顆粒在醫學、材料學等領域更是前景廣闊,近年來相關文獻不計其數。下面僅簡要介紹其兩種重要用途,余者還請讀者自行查閱有關文獻。?
治療鉈中毒和排除放射性銫
普魯士藍中的鐵與氰基結合得足夠緊密,劇毒的氰根離子幾乎不可能游離出來,因此普魯士藍本身是無毒的。可溶性普魯士藍有一半的晶胞空隙中填充了鉀離子,在劇毒的鉈離子(Tl+)濃度較高時,會將普魯士藍中多余的鉀離子置換出來(而不是填充剩余空隙),從而降低鉈離子濃度,達到解毒的目的。 ?
1994年11月24日起,清華大學學生朱令出現中毒癥狀,經診斷疑似兩次攝取致死劑量的鉈。經服用普魯士藍后,體內的鉈被逐漸排出,但由于確診時間過長,錯過了寶貴的治療時間,醫生們雖然盡全力挽回了朱令的生命,但她卻成了“植物人”。案件至今仍未破解。 ? 與排除體內鉈的作用機制相似,普魯士藍也能對與鉈離子半徑相近的銫離子(Cs+)有吸附作用。因此,普魯士藍也被用來修復被銫的放射性同位素銫-137污染的環境,和促進排除輻射病患者體內的放射性銫。 ? 2.用作普魯士藍基修飾電極傳感器 ? 在氧化酶的作用下,許多生物小分子能被氧氣氧化為水和二氧化碳等物質,但其中不免有少量過氧化氫的產生。過氧化氫濃度與酶底物濃度成正比,因此通過檢測過氧化氫濃度即可反映出氧化反應進行的程度。傳統方法中電極所需電勢較高,許多易氧化的物質參與反應會干擾測量結果。阿貝爾卡德·布瓦耶(Abelkad Boyer)等人首先研究了普魯士藍修飾碳糊電極(Prussian-blue-modified carbon paste electrode),較好地解決了這個問題。
? 鑒于普魯士藍電催化劑相比于鉑能更好地催化過氧化氫的還原反應,采用普魯士藍基修飾電極的第一代電流型葡萄糖生物傳感器(Prussian blue-based first-generation biosensor)橫空出世。它對工作電極的電勢要求更低,這減小了還原劑對傳感器響應的影響。過氧化氫的氧化作用可監測其響應。通過比較不同酶電極上陰陽極信號,找到最佳條件,就可以逐步提升生物傳感器的選擇性。 ? 利用普魯士藍優良的磁、電和光學性質,也可以制造出許多種其它的生物傳感器,它們有壽命長、pH穩定性高等諸多優點。 ? 七、結語 普魯士藍與其它無機物和有機物相比擁有極其特殊的結構特征,它一定還有許多未知的性質和用途等待我們去不斷探索、不斷發掘。 ? 用于水性單價離子電池的普魯士藍類似物正極材料 美國俄勒岡州立大學紀秀磊教授課題組
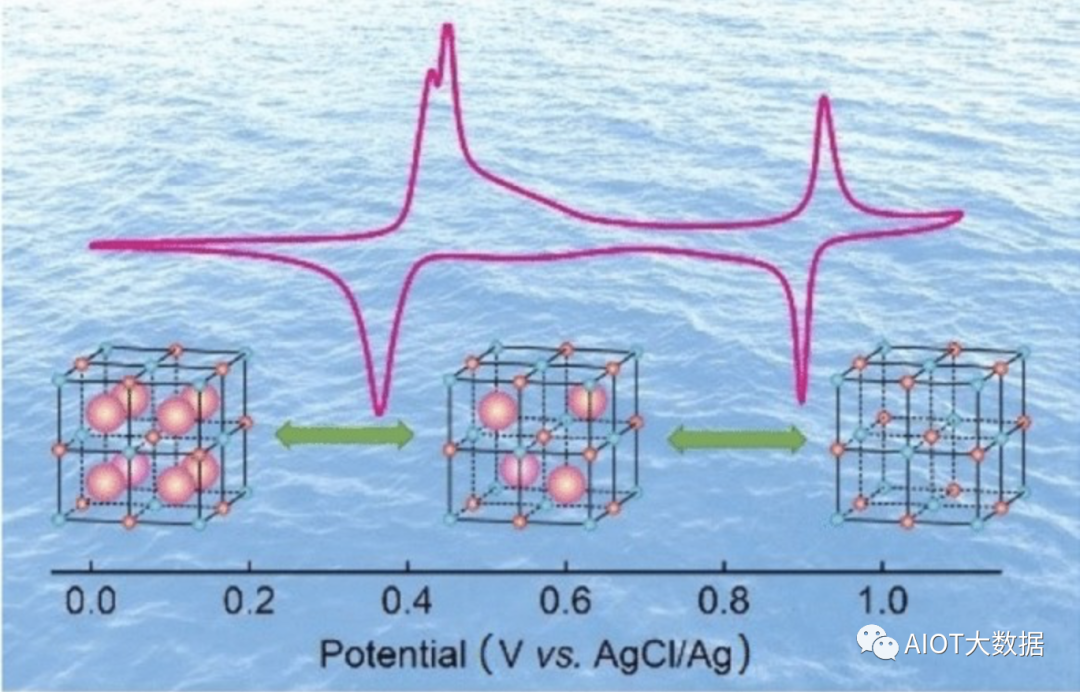
(一)前言
清潔能源(太陽能、風能)的開發使用依賴于廉價、安全的儲能電池系統。目前,鋰離子電池廣泛應用于較為高端的儲能領域,如手機、筆記本、電動汽車等,但是在大規模儲能領域卻受到限制。其一是鋰元素在地殼中的儲量很低(~0.000 02),不足以支持電網級別的儲能應用;其二是可燃碳酸酯電解液的使用,導致鋰離子電池存在較大的安全隱患。相比之下,基于水系電解液的鉛酸電池具有安全性高、價格低廉等優點,目前已在規模儲能領域有所應用。然而,鉛酸電池毒性大,循環性能有限,能量密度較低(30 Wh kg?1),并不是一種理想的規模儲能電池。因此,開發一種資源豐富、價格低廉,且電化學性能(能量密度、循環等)優于鉛酸的水系二次電池體系,對于規模儲能具有重大的現實意義。
自從1994年Jeff Dahn首次提出水系二次鋰離子電池的工作原理之后,研究者逐漸將水系電池擴展到鈉、鉀、鈣、鎂、鋁、鋅等離子體系。尤其是近年來新型水系電解液的發展(如高濃度、混合型等),將水系電池的研究熱情推到一個新的高度。在二次電池體系中,電極材料往往起到主導性的作用,尤其對于規模儲能型電池,電極材料更需要同時滿足低成本、高性能、可持續等特點。
目前的水系電極材料,大致分為氧化物、磷酸鹽、有機物以及普魯士藍四大類。其中,氧化物結構緊密,局限于Li、Na電池體系;而磷酸鹽因其較高的分子量,導致比容量偏低(60–120 mAh g?1)。有機物材料可以儲存多種離子體系,但通常電導率低、振實密度低,限制實際應用。相比之下,普魯士藍具有誘人的應用前景,不僅具有開放性的晶體結構、可逆的氧化還原過程,適合多種離子的普適性儲存,而且合成簡便,通過簡單的液相沉淀法即可制備,避免了球磨、高溫煅燒等高能耗過程,降低了材料制備成本。
普魯士藍類材料代表著一大類過渡金屬氰化物,分子式一般可以表示為AxM[Fe(CN)6]·mH2O,其中A和M分別代表陽離子(如Li+, Na+, K+等)和過渡金屬離子(如Fe, Co, Ni, Cu等)。圖1(a)給出了結構完整的普魯士藍晶體結構示意圖。其中,Fe元素與氰根的碳原子形成6配位,M則與氰根的單原子形成6配位,根據–Fe–CN–M–化學鍵的有序排列,最終形成了三維立方體結構,A+陽離子和沸石類型水分子占據在小立方體的中心。根據Fe/M氧化狀態的不同,普魯士藍類材料可以進一步分為普魯士黃(Prussian Yellow,Fe和M均為+3價,簡寫為PY)、普魯士藍(Prussian blue, Fe為+2價M為+3價,或者Fe為+3價M為+2價,簡寫為PB)和普魯士白(Prussian white,Fe和M均為+2價,簡寫為PW)等三種。然而,在實際制備中,PBA材料容易形成鐵氰根Fe(CN)6空位,導致M/Fe偏離1:1的計量比(通常大于1),而且會引入更多的配位水分子,從而形成AxM[Fe(CN)6]1?y·□y·mH2O的分子式。為便于理解,圖1(b)給出了具有1/4 Fe(CN)6空位的PBA材料,該空位位于結構中心,同時引入了6個配位水分子。需要說明的是,在實際樣品中,這些結構空位會隨機地分布在整個晶體結構中。
根據“結構決定性質”的觀點,我們不難發現,PBA電極材料具有多方面的優點。第一,結構中具有兩對潛在的氧化還原活性中心,M3+/M2+和Fe3+/Fe2+,對應著高達150–190 mAh g?1的理論比容量(按照A2MFe-PWA計算,A = Li, Na, K)。第二,由于氰根的配位效應,碳配位的Fe3+/Fe2+和氮配位的M3+/M2+電對具有0.6–1.2 V的反應電位(相對于標準氫電池),利于提升全電池的電壓。第三,PBA具有結構開放的三維網絡結構,離子通道為3.2 ?,內部空隙為4.6 ?,適合多種離子的儲存。第四點,開放的晶體結構還可以緩沖離子在嵌入脫出時的體積變化,有利于提升電極的長期循環性能。最后,PBA材料為難溶于水的沉淀,理論上,可以避免電極材料的溶解流失。
由于PBA材料的結構特點,PBA材料已經廣泛應用于多種水系離子電池體系,如單價、二價、三價等。尤其是,在單價離子電池體系中,PBA表現出最優的綜合電化學性能。另外,從實際應用的角度出發,單價離子電池更容易設計匹配全電池,比二價、三價似乎更接近應用。更為重要的是,由于這些離子的性質相近,又都可以嵌入PBA材料,為研究“離子–材料”間的相互作用,提供了極大的便利。因此,在本綜述中,我們選擇了代表性的PBA水系電池研究成果,分析比較了相同材料在儲存不同離子(Li+, Na+, K+, H+, NH4+)時的電化學反應行為差異,并對其儲能機理進行了分析討論,突出強調了“電荷載流子”對電極材料性能的關鍵影響。
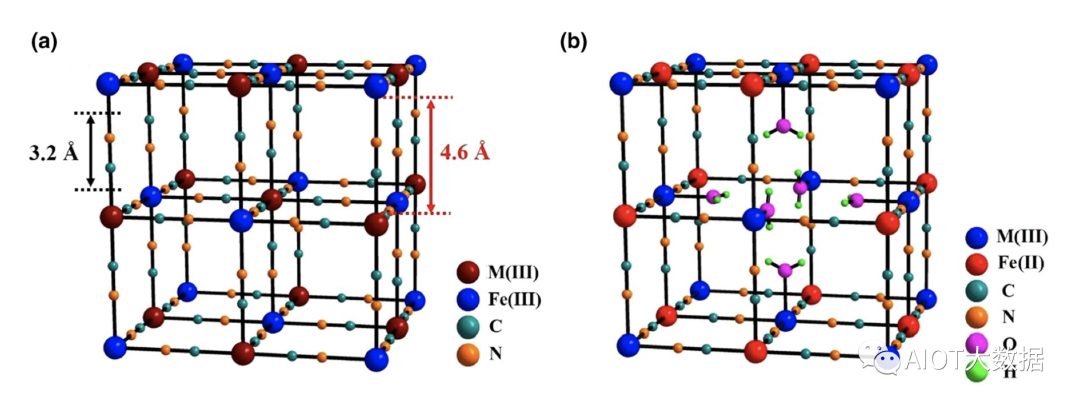
圖1 普魯士藍材料的晶體結構示意圖:(a)完整的MIII[FeIII(CN)6]?2H2O材料;(b)含1/4 Fe(CN)6空位的MIII[FeII(CN)6]3/4·□1/4·3.5H2O材料。
(二)內容概括
2.1 水系鋰離子電池
在各種水系離子電池中,水系鋰離子電池研究最早,研究機理也最為深入。但是PBA材料在水系鋰離子電池中的研究并不多見,主要原因在于PBA材料的離子通道(3.2 ?)與水化鋰離子尺寸(3.82 ?)不匹配。由于Li+較高的水合能,水分子難以被脫離,當太大的水合離子試圖強行進入PBA結構,會導致PBA材料的結構損壞,進而導致循環性能衰減。
Yi Cui等人早在2011年分析比較了NiFe–PBA和CuFe–PBA材料儲存不同離子的行為,發現PBA材料表現出很強的離子傾向性:NH4+?> K+?>Na+?> Li+,表現為不僅Li+的反應電位最低,循環性能也最差。最近的研究也發現,FeFe–PYA在水系Li+電解液中具有很快的容量衰減和形貌變化,但XRD峰位卻無變化,推測是水合Li+離子聚集在PBA表面附件,或者進入到鐵氰根空位的位置。因此,PBA材料在水系鋰離子電池中的應用,受到本征晶體結構的極大限制。
2.2 水系鈉離子電池
相比于水系鋰離子電池,水系鈉離子電池資源更為豐富,更適合規模儲能。另外,鈉離子的離子尺寸較大,更適合嵌入PBA的晶體結構。因此,PBA作為水系鈉離子電池的正極材料,得到了十分廣泛的研究與關注。在各種PBA材料中,NiFe–PBA和CuFe–PBA的研究較早,循環性能也十分優異(>2 000 次),但因為Ni、Cu離子的電化學惰性,導致這兩種材料為單電子反應,實際比容量較低(~60 mAh g?1)。相比之下,兩電子反應的FeFe–PBA, MnFe–PBA和CoFe–PBA則可以提供更高的反應容量,然而,他們的循環性能往往較差。早期的電分析文獻甚至認為,PBA材料性能衰減的原因在于水化鈉離子的尺寸太大,會破壞PBA材料的晶體結構,因此將鈉離子歸結為“阻斷離子(blocking ions)”的范疇。
根據“結構決定性質”的觀點,電池研究者發現,PBA嵌鈉性能的衰減,實際上來源于PBA結構的不完整。在常規的液相沉淀法中,PBA材料結晶速率快,結晶度低,還含有大量的鐵氰根空位(圖1(b)),這導致在兩電子反應的過程中,晶體結構容易破壞,循環性能快速衰減。因此,合成低空位、高結晶度的PBA材料,是實現兩電子PBA循環穩定的關鍵。從配位化學的角度來說,Mn+離子既可以與水分子配位,形成水合Mn+(H2O)m離子,也可以與[Fe(CN)6]n?陰離子配合,形成M/Fe計量比1:1的M[Fe(CN)6]化合物。相比之下,形成M[Fe(CN)6]化合物是熱力學上十分傾向的反應,這也是PBA材料發生沉淀反應的根本動力;但是,該物質的反應動力學較慢。在常規的快速沉淀法中,許多水合的Mn+(H2O)m離子往往來不及脫去全部水分子,從而直接以水合離子形式參與配位反應,導致了Fe–CN–M和Fe–CN–M?H2O化學鍵的同時存在。這些配位水分子,進一步導致了鐵氰根空位的產生。因此,降低結晶速率是合成低缺陷、高結晶PBA材料的關鍵因素。
在合成低缺陷PBA材料方面,武漢大學的楊漢西教授課題組較早做出了機理層面的研究工作。發現,當把Fe3+與[Fe(CN)6]3?溶液混合時,并不會得到沉淀,而是一種深棕色的溶液,該顏色來自于Fe3+···[Fe(CN)6]3?絡合物。當緩慢加熱到60 ℃時,Fe3+···[Fe(CN)6]3?絡合物會緩慢氧化水分子或者溶液中的氯離子,形成Fe3+···[Fe(CN)6]4?化合物,該物質具有極低的溶解度常數(Ksp),從而形成大量細小的晶核,促進格林綠晶體緩慢結晶。最終,格林綠材料含有13%的鐵氰根空位,遠小于常規的25%,而且表現出完整的立方體形貌,也反應出結晶過程的緩慢與充分。
圖2(a)給出了該物質的緩慢結晶示意圖。同時,該材料的儲鈉電化學性能(比容量、循環),遠遠高于常規樣品(圖2(c, d))。另外一種制備方法被稱為絡合結晶法,或者控制結晶法(圖2(b)),即在反應前加入另外一種絡合劑(如檸檬酸根等),與Mn+離子預先形成配位,從而降低初始態的PBA濃度。由于絡合劑的競爭反應,檸檬酸絡合的Mn+離子會緩慢釋放出低濃度的Mn+離子,與鐵氰根反應,從而延緩了結晶速率,最終也可以得到低缺陷、高結晶的PBA材料。圖2(e)給出了低缺陷CoFe–PWA材料的充放電曲線,表現出十分穩定的兩電子嵌鈉反應,比容量為~125 mAh g?1。目前,這兩類方法已經廣泛應用于合成低缺陷的PBA材料。
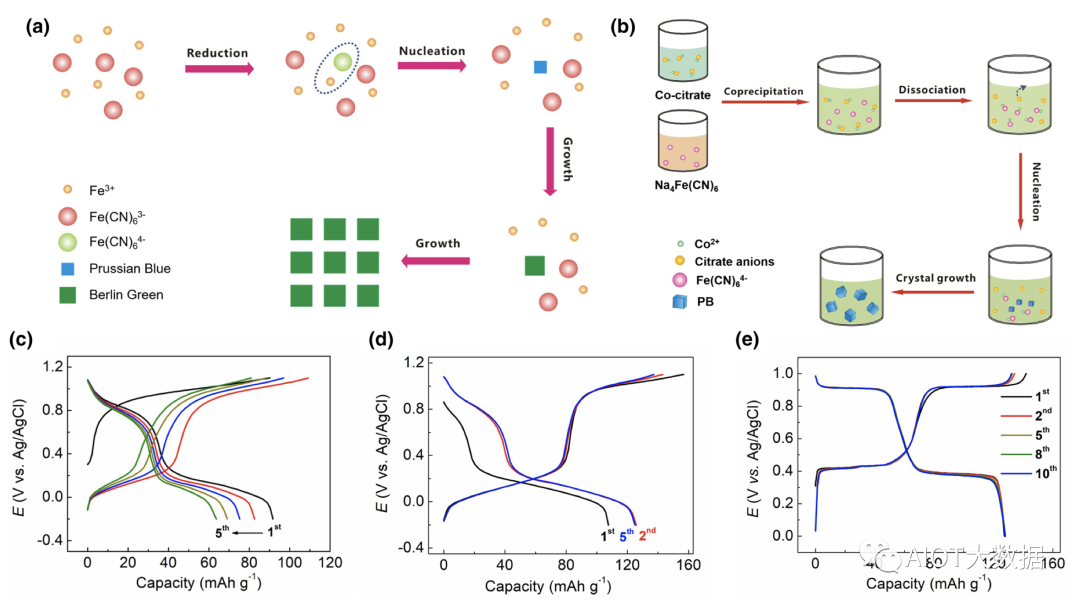
圖2 (a)格林綠材料的緩慢結晶示意圖;(b)絡合結晶法合成低缺陷的CoFe–PWA材料;(c)常規PBA材料的充放電曲線;(d)低缺陷格林綠的充放電曲線;(e)低缺陷CoFe–PWA材料的充放電曲線
2.3 水系鉀離子電池
相比于鋰、鈉離子,鉀離子的離子半徑較大(1.38 ?),限制了嵌鉀電極材料的開發。PBA因其開放的晶體結構,是為數不多的高性能儲鉀正極材料。2011年,Yi Cui報道了NiFe–PBA和CuFe–PBA在水系鉀離子電池中的性能,二者分別具有5 000和20 000圈的循環性能,但是比容量較低,僅為~60 mAh g?1. 為開發高容量正極,需要將目光轉移到FeFe, MnFe和CoFe–PBA上。
Wang 等利用單一鐵氰源法,通過緩慢結晶,制備了K2FeFe(CN)6·2H2O化合物,比容量達到120 mAh g?1. 相比于Na2FeFe(CN)6, 該K2FeFe(CN)6正極的反應電位更高,而且表現出2個充放電平臺(而不是斜坡),表明由于鉀離子較大的離子半徑,PBA結構發生了從立方相到單斜相的轉變。MnFe–PBA也可以表現出兩電子嵌鉀反應,比容量可達~130 mAh g?1,但是由于材料溶解流失的問題,需要使用高濃度電解液以改善循環性能。Hu等人報道了22 mol kg?1 KCF3SO3高濃度電解液對MnFe–PBA循環性能的改進,并與有機小分子負極匹配,構建了能量密度~80 Wh kg?1的水系鉀離子全電池。相比之下,兩電子反應的CoFe–PBA還鮮有報道,可能原因是CoIII/CoII電對對配位環境更為敏感,較大的鉀離子會影響整體材料的電子結構、配位環境等。
由于鉀離子半徑太大,開發適合的儲鉀負極材料十分困難,因此,研究者們構建了混合型離子電池。例如,使用PBA材料為儲鉀正極,磷酸鈦鈉為儲鈉負極,Na/K混合溶液為電解液,可以構建Na/K混合離子電池。電池的工作原理為:利用PBA材料的離子選擇性(K > Na > Li),PBA會優先儲存鉀離子;利用NaTi2(PO4)3負極的框架尺寸效應,鉀離子太大不能嵌入,但可以嵌入較小的鈉離子。但是,該混合電池會消耗電解液,因此,計算電池的能量密度,需要考慮電解液的用量。
2.4 水系銨離子電池
相比于水系鋰、鈉、鉀離子電池,銨離子電池的研究起步較晚,研究較少,可能在于銨離子更大的離子半徑(1.48 ?),限制了材料的開發。但是,銨離子的大小與PBA的空腔尺寸可以很好地匹配,導致許多PBA材料不僅表現出更高的嵌銨反應電位,也給出優異的循環性能。
為了構建“搖椅型”銨離子全電池,需要找尋一種富含銨離子的PWA材料。美國俄勒岡州立大學的紀秀磊課題組以“富鈉態”NiFe–PWA為原料,利用PWA框架對銨離子的喜好,通過液相的離子交換法,成功制備了“富銨態”PWA材料(圖3(a))。發現,當PWA晶格中為鈉離子時,晶體結構為扭曲的單斜相,當鈉離子全部被替換為銨離子時,PWA恢復為經典的立方相結構(圖3(a)),這也證明了PWA結構對銨離子的喜好。而且,充放電測試表明,該“富銨態”PWA材料的平均反應電位高于“富鈉態”材料0.2 V(圖3(b)),有利于提升水系全電池的電壓。該材料也表現出長達2 000圈的循環穩定性能。
開發兩電子儲銨PBA材料,研究者嘗試了之前水系Na、K電池體系的低缺陷FeFe–PBA材料。雖然氮配位FeIII/FeII電對的反應電位得到了提高,但是FeFe–PBA材料卻只表現出一對氧化還原峰。即使掃描到更高電位,碳配位的FeIII/FeII電對也無明顯活性(圖3(c))。其他的兩電子MnFe和CoFe材料,在銨離子電池體系,也同樣表現出類似的行為。這似乎暗示銨離子影響了PBA材料的本征電化學行為。雖然FeFe–PBA的比容量降低為~90 mAh g?1,但是由于銨離子與PBA框架的高度匹配,在整個嵌入反應過程中,材料的體積變化率小于1%,屬于“零應變”材料的范疇;相比之下,水化鈉離子的嵌入會引起顯著的體積膨脹,而鉀離子的嵌入則降低結構的對稱性,成為單斜相結構(圖3(d))。最終,銨離子表現出最佳的循環性能(圖3(e)),在大電流循環下,經過5萬圈循環,仍然具有78%的容量保持率。
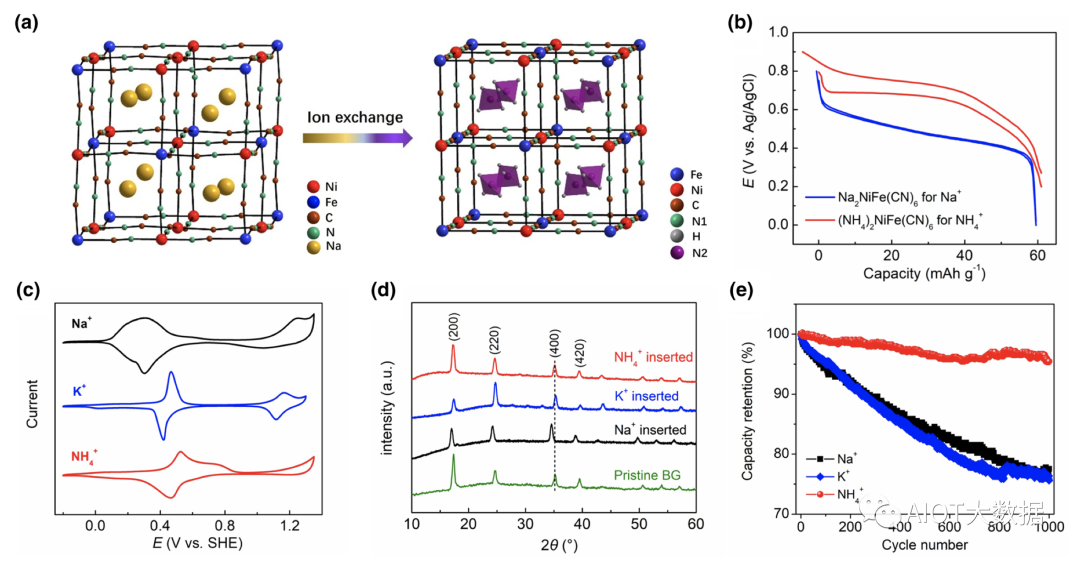
圖3(a)離子交換法制備“富銨態”PWA材料;(b)NiFe–PWA嵌鈉、銨充放電曲線比較;(c)FeFe–PBA在水系Na+, K+和NH4+電解液中的循環伏安曲線;(d)FeFe–PBA嵌入Na+, K+和NH4+后的結構變化;(e)FeFe–PBA嵌入不同離子的循環性能
2.5 水系氫離子電池
相對于其他離子,氫離子最具最小的分子量(+1.0 g mol?1)和最小的離子半徑(~0.89 fm),因此更容易嵌入材料的晶體結構,實現較高的反應容量。在早期的研究中,研究者也往往加入一定的酸溶液,以提升PBA材料嵌鈉、鉀離子的循環穩定性能。但是,考慮到PBA結構的離子選擇性(NH4+?> K+?>Na+?> Li+),似乎最小的氫離子并不是合適的選擇。如圖4(a)所示,低缺陷的FeFe–PBA可以實現穩定的Na+、K+嵌入反應,但是在H2SO4水溶液中,容量卻衰減很快。因此,早期的電分析、電催化文獻,也把氫離子歸屬為PBA“阻斷離子”的范疇。
實際上,氫離子的水合能很高,嵌入PBA材料的形式可能是水合的氫離子,如H3O+,該離子的尺寸(1.0 ± 0.1 ?)與裸Na+半徑(1.02 ?)接近;或者,嵌入的形式為純的質子,嵌入后與PBA中的水分子結合形成水合氫離子。因此,氫離子仍可以在部分PBA材料中實現穩定的嵌入反應。雖然PBA材料嵌入氫離子的反應電位不如Na+, K+和NH4+離子高,但是反應電位仍然高于Li+,如圖4(b)所示。
氫離子在水溶液中具有最高的離子電導率,這是由于氫離子具有獨特的“格羅特斯”傳遞機理(Grotthuss Mechanism):在氫鍵鏈接的水分子鏈上,氫離子可以通過改變氫鍵-共價鍵的結合方式,實現自身的快速傳輸(圖4(c))。可以理解為氫離子撞擊水分子鏈,改變氫鍵–共價鍵結合方式,從而撞出另一端的氫離子,該速率遠遠快于溶劑化氫離子的緩慢擴散。利用這一原理,紀秀磊課題組設計了一種高度水合、缺陷的CuFe–PBA材料,結構中充滿了沸石水分子和配位水分子,二者通過氫鍵鏈接,構建了巨大的氫鍵網絡結構(圖4(d))。測試發現,該PBA材料可以表現出高達4 000 C的倍率性能(圖4(e))和長達73萬圈的循環性能。如此快速的倍率性能來源于氫離子在氫鍵網絡中的高度傳輸。而且,即使將反應溫度降低為?40 ℃,在電解液部分凝固的狀態下,缺陷態NiFe–PBA仍可以表現出50 C的高倍率行為(圖4(f))。
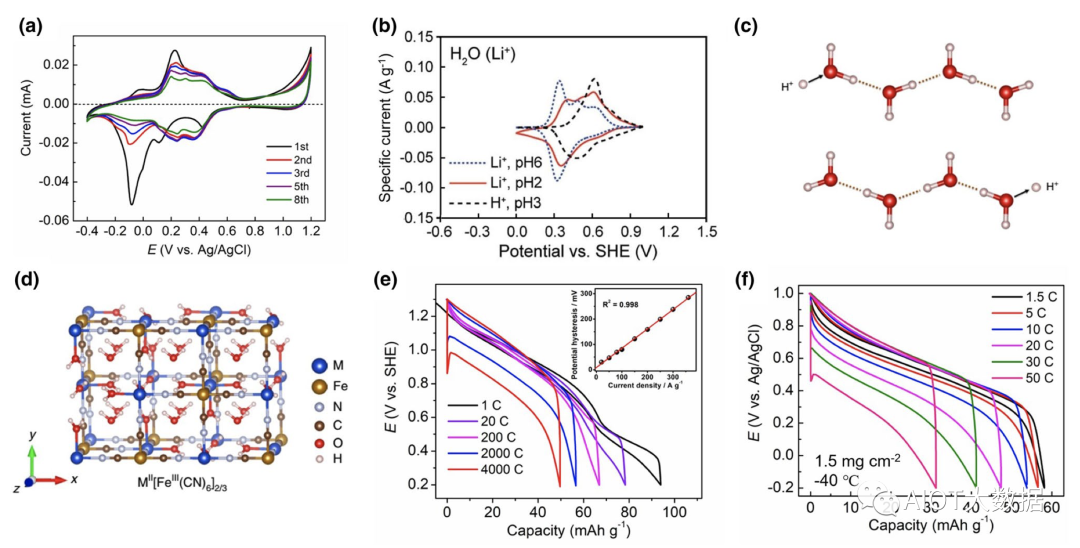
圖4(a)低缺陷FeFe–PBA在0.1 M硫酸水溶液中的循環伏安曲線;(b)NiFe–PBA嵌入H+和Li+的循環伏安曲線比較;(c)氫離子的格羅特斯傳遞機理示意圖;(d)高度缺陷的MFe-PBA材料;(e)高度缺陷CuFe–PBA材料的倍率性能;(f)高度缺陷NiFe–TBA材料在?40 ℃低溫下的倍率性能。
五、重要結論
(1)電荷載流子對于PBA材料具有顯著的影響,會綜合影響電極反應的熱力學、動力學和可逆性。由于PBA材料自身的大框架結構,整體的離子傾向度表現為NH4+?> K+?> Na+?≈ H+?> Li+。對于PBA材料,鋰離子不是十分合適的離子體系,Na+和K+能夠表現出最高的比容量,NH4+能夠釋放出最高的反應電位和循環性能,而H+則有望實現極高的反應動力學。這一現象也表明,在未來研究中,可以根據材料或者離子的本征特性,針對性地進行“離子/材料”組合的設計與優化,以實現對高能量、高倍率、或長循環電極反應的需求。
(2)在各種PBA材料中,NiFe–PBA和CuFe–PBA容量較低,而且Ni/Cu元素價格較高,限制大規模儲能應用。CoFe–PBA的反應電位、比容量都較高,但是電化學性能受離子體系的影響很大,而且Co元素十分昂貴,因此不適合規模儲能應用。相比之下,FeFe–PBA和MnFe–PBA最具實際應用前景,不僅價格低廉,而且比容量和反應電壓都相對較高,因此應該作為未來研究的重點。
(3)雖然單一PBA材料在單一離子體系中的性能與機理,得到了廣泛的研究,但多集中于應用層面;對于不同離子對PBA材料性能、反應機理的影響,缺乏深入、系統的機理研究。比如,CoFe–PBA材料,為何在Na+體系表現為兩電子反應,而在K+體系卻僅為單電子反應?為何MnFe和FeFe–PBA材料卻不受K+的限制?因此,深入理解微觀離子對電極材料的影響機制,對于構建高性能的電極材料、電池體系,具有十分重要的意義。
(4)PBA材料的應用研究需要采取更為嚴格的測試條件,以更好驗證在水系電池實際應用中的可能性。比如,目前的文獻數據,使用了較為大量的導電炭(10%–20%)、很薄的電極(1.5–10 mg cm?2)以及大量的電解液,實際應用需要降低導電炭的使用比例、厚的電極載量以及少量電解液等。另外,水系PBA電池的長循環性能,不能僅僅按照循環次數來衡量,更應該考察循環時間,特別是小電流下的循環次數和時間。由于水系電解液容易分解,研究者多采用大電流密度進行循環,以達到降低副反應的目的,但這樣會高估PBA材料在水系電池中的循環性能。因此,未來需要建立相對實際、統一的測試標準。
?
編輯:黃飛
?
 電子發燒友App
電子發燒友App





















評論