(文章來源:小材科研)
自組裝聚合物膠束作為多功能藥物遞送系統的應用已受到廣泛關注,已有種類繁多的聚合物膠束給藥系統進入臨床實驗或被FDA批準使用。然而,它們的治療效果并沒有達到預期,主要原因之一在于大多數聚合物膠束不能承受高倍稀釋及與血液成分的相互作用,導致藥物的提前暴釋和非特異性體內分布。
物理或化學交聯是改善自組裝體穩定性的最直接方法,但其同時也降低了納米系統的響應性和釋放速率。聚合物膠束的物理或化學交聯已成為克服組裝物固有不穩定性的直接方法,然而,交聯過程可能會損害納米系統的響應性,導致有效載荷的釋放效率低下因此,聚合物自組裝體的穩定和響應仍是納米載體領域存在的矛盾難題。
為了解決該問題,四川大學高分子材料學院丁明明、譚鴻和傅強教授提出一種交聯誘導再組裝(CIRA)策略,該策略可同時提高聚合物膠束的動力學和熱力學穩定性以及還原響應性。該研究團隊設計并合成可點擊的多嵌段聚氨酯(MPU),其主鏈含有二硫鍵,側鏈具有可點擊的活性位點。進一步利用聚合物膠束界面層的點擊交聯化學反應驅動聚合物再組裝,誘導聚氨酯的軟段和硬段發生相分離,將聚合物膠束內核中的刺激敏感基團遷移到界面,形成可逆穩定的二硫交聯層。
CIRA功能化能夠顯著提高聚合物膠束的熱力學和動力學穩定性、刺激響應性,在體內外實現靈敏的藥物控釋開關。因此,CIRA方法能夠有效增強腫瘤靶向,改善藥物生物分布并獲得出色的腫瘤抑制效果。該工作為高分子自組裝結構調控提供新方法,并為藥物傳遞提供了具有應用潛力的多功能納米平臺。
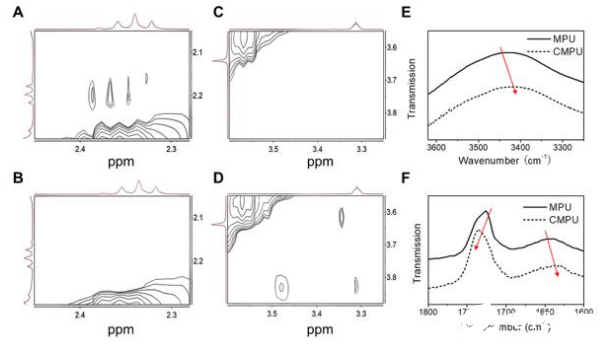
為了驗證CIRA的基本概念,研究團隊首先合成了一個可點擊的多功能聚氨酯(MPU)。聚合物是由可降解聚(ε-己內酯)(PCL)、可斷裂的聚乙二醇鏈接含有pH敏感的苯甲酸亞胺鍵(BPEG)、L-賴氨酸乙酯二異氰酸酯(LDI)以及L胱氨酸(Cys - PA)生成的可還原擴鏈劑。制備的MPU可以自組裝成直徑約為53nm的帶負電荷的膠束。該結構為球形核-殼結構,其疏水核心由不溶性PCL軟段構成,周圍為可酸分離的親水BPEG暈。硬節段主要分布在亞表面,由于鄰近的疏水軟節段,部分仍分布在膠束核內。在聚合物膠束形成后,界面上的炔位可以通過點擊化學作用使目標配體或殼層交聯。
為了實現可逆交聯和點擊交聯,團隊設計并合成了一種還原親裂交聯劑(SSAz)所得到的交聯劑包含一個二硫鍵和兩個疊氮化物位點,允許在水溶液中使用銅催化的烷基-疊氮化物環加成(CuAAC)有效地交聯MPU膠束。在交聯后,膠束尺寸從53nm增加到111nm,這可能是由于自組裝結構的改變或重新聚合的存在。利用靜態光散射(SLS)測量了膠束的質量-平均分子量。CMPU膠束的計算聚集數(Nagg)幾乎是MPU膠束的兩倍。這個結果暗示了可能是膠束間的交聯導致了膠束的重新聚集,有而產生微觀相分離。
進一步研究CIRA對于高分子納米材料生物學性能的影響,以抗腫瘤應用為模型,發現CIRA功能化的膠束能夠顯著提高納米系統的穩定性,實現靈敏的藥物控釋開關,從而延長藥物循環時間,改善藥物組織分布,在體內外實現良好的抗腫瘤效果。該工作為高分子自組裝行為提供了新的理解,并為多功能納米藥物載體的設計提供新思路。
綜上所述,該團隊開發了一個多功能的聚氨酯模型,其主鏈上有二硫鍵,側鏈上有可點擊的活性位點。聚合物在水溶液中自組裝成核-殼膠束,并在軟段和硬段之間進行了交聯誘導再組裝和微相分離。由于在膠束界面上發生了簡單的點擊反應,CIRA推動了二硫鍵從內芯向膠束亞表面的遷移。因此,可以同時提高膠束的熱力學穩定性和氧化還原反應性,從而增強腫瘤靶向性、特異的細胞內藥物傳遞,并在體內外獲得良好的治療效果。該工作為大分子的自組裝提供了一個新的視角,并為為多功能納米藥物載體診療應用提供了一個有前途的納米平臺。
(責任編輯:fqj)
-
納米技術
+關注
關注
2文章
201瀏覽量
25849 -
高分子
+關注
關注
1文章
35瀏覽量
11007
發布評論請先 登錄
相關推薦
汽車高分子材料光老化試驗方法匯總

高分子半導體的特性與創新應用探索
光伏組件EVA膠膜(DSC法)交聯度測試
村田貼片電容超小尺寸(1411)導電性高分子鋁電解電容器

變速箱軸承位出現磨損,在線緊急修復原來是用這種方法

搪瓷釜脫瓷嚴重漏介質,用高分子復合材料輕松修補

憶阻器誘導的超混沌、多渦旋和極端多穩態小數階HNN:鏡像加密和FPGA實現
淺談e-PTFE防水透氣膜漏水的2大原因分析

高分子基柔性電容式壓力傳感材料的研究進展綜述
駿鼎達今日上市,專注高分子改性保護材料
高分子聚合(PPTC)設備如何提供必要的過熱和過電流保護
直播預告 | 松下導電性高分子聚合物SP-Cap電容JX/KX系列





 多嵌段高分子交聯誘導膠束再組裝并實現藥物智能釋放開關
多嵌段高分子交聯誘導膠束再組裝并實現藥物智能釋放開關












評論