(文章來源:bioprint菌)
血栓及其并發癥是心血管疾病發病率和死亡率的主要原因之一。雖然急性血栓事件可能需要使用溶栓劑(如組織纖溶酶原激活劑(TPA))治療,但是血栓不能被完全去除,殘余的血栓會隨著時間的推移通過周圍組織侵入的成纖維細胞發生纖維改變,最終形成永久性的血栓。如果形成靜脈壁僵硬和靜脈高血壓,這在臨床上表現為血栓形成后綜合征,引起水腫,疼痛,嚴重者還會面臨截肢。
目前,建立一個體外仿生平臺來研究血栓形成中的細胞相互作用和潛在療法方面是非常必要的,然而在模擬血管的各種結構和生物方面以及利用相對復雜的制造過程的能力方面受到限制。
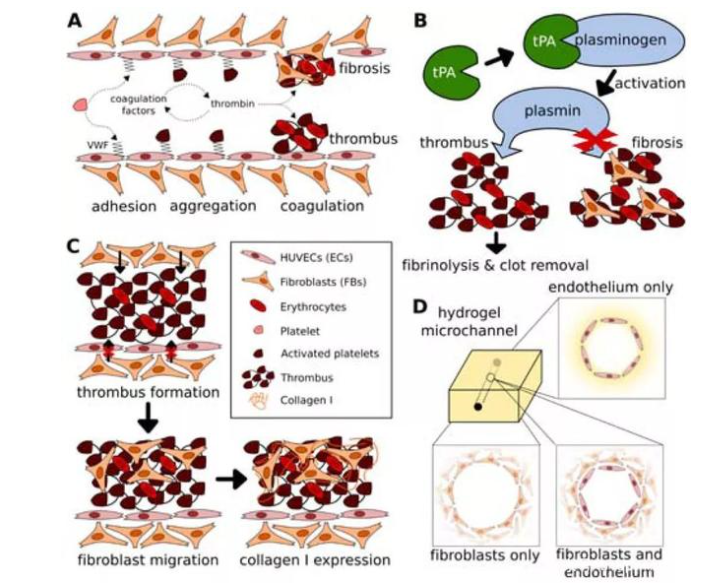
因此,Yu Shrike Zhang團隊開發了一種利用3D打印技術以構建高度仿生血栓-芯片模型的方法。該模型是由一層融合的人內皮細胞包覆在明膠甲基丙烯酰基(GelMA)水凝膠中的空心微通道組成,其中人全血被注入并誘導形成。組織纖溶酶原激活劑的持續灌注導致非纖維化凝塊的溶解,說明了該模型的臨床相關性。進一步將成纖維細胞包裹在GelMA基質中,表明這些細胞有可能遷移到凝塊中,隨后隨著時間的推移沉積I型膠原,從而促進纖維細胞的形成。該模型在用于研究血管纖維化病理方面有重大的意義。
首先,研究團隊進行了血管化結構的3D打印。該結構是用Pluronic沉積了一個由犧牲支架組成的模具,并使其干燥過夜。隨后,將GelMA溶液填充模具并使用光交聯引發凝膠化。通過將整個構建體浸入冷的PBS中去除Pluronic結構,形成了水凝膠微通道。同時為了模擬內皮功能,研究人員將表達GFP的HUVECs接種到微通道中并培養直至達到匯合。結果顯示,HUVECs在播種后不久就開始在微通道內表面上擴散,直到第2天沿微通道的長度形成匯合的內皮層。對于分叉通道,在整個微通道上都觀察到了類似的趨勢,包括分叉點。
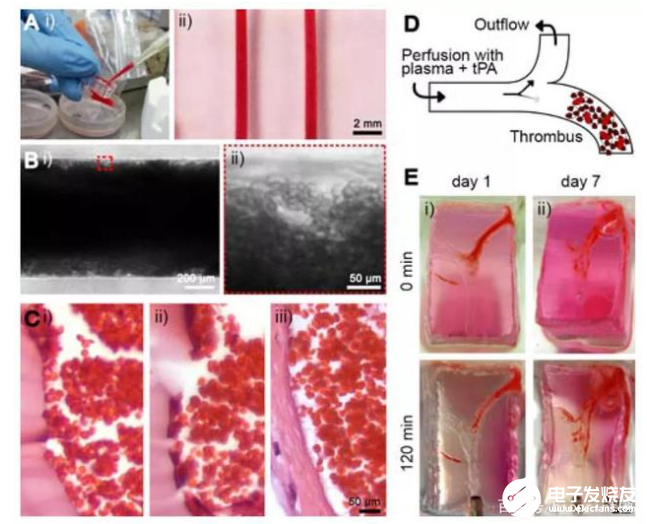
然后,研究人員探討了血管化水凝膠微通道作為研究血栓形成模型的潛在應用。對于芯片上的血栓形成模型來說,重要的是用血栓溶解劑治療后的凝塊的體內血栓溶解活性;對于溶栓實驗來說,通過采用分叉型微通道配置可以驗證芯片上的血栓形成模型中TPA的溶栓潛力。結果表明,利用犧牲性生物打印制作的體外分叉血栓形成模型的仿生特性,在研究血栓形成,溶栓和相關病理學方面有巨大的潛在用途。
最后,為了驗證內皮的完整性受到損害時,在水凝膠微通道基質中包被的成纖維細胞會遷移到血管腔中促進血栓纖維化這一假設。研究人員制作了三種類型的模型:i)在水凝膠中沒有成纖維細胞的內皮化微通道作為對照;ii)非內皮化微通道,在基質中具有成纖維細胞以模擬受損血管;iii)內皮化的微通道在基質中具有成纖維細胞,以模仿正常血管。這項研究中描述的仿生人類單片血栓形成模型為今后研究提供了開展體外研究的能力,特別在發展個性化血管疾病建模方面有重大進展。
(責任編輯:fqj)
-
仿生學
+關注
關注
2文章
8瀏覽量
7416 -
3D打印
+關注
關注
26文章
3547瀏覽量
109036
發布評論請先 登錄
相關推薦
DMD芯片在3D打印中的創新應用
FPC與3D打印技術的結合 FPC在汽車電子中的應用前景
透明樹脂材料3D打印服務全透應用案例
3d打印機器人外殼模型ABS材料3D打印噴漆服務-CASAIM
3D打印汽車零部件建模設計3D打印服務





 通過3D打印技術實現的高度仿生的血栓-芯片模型
通過3D打印技術實現的高度仿生的血栓-芯片模型













評論