制藥業(yè)是大企業(yè),但通常不被認(rèn)可的大部分是具有復(fù)雜供應(yīng)鏈,精細(xì)化學(xué)工藝和產(chǎn)品且必須滿足嚴(yán)格質(zhì)量控制要求的制造業(yè)。業(yè)內(nèi)很少有人考慮如何安全,有效,大規(guī)模地以可靠的質(zhì)量和精確計(jì)量的劑量來(lái)生產(chǎn)藥物。
更有趣的是,簡(jiǎn)單的事實(shí)是,制藥廠經(jīng)常使用已經(jīng)過(guò)時(shí)數(shù)十年的制造工藝來(lái)生產(chǎn)復(fù)雜的藥物,并且在可比較的行業(yè)(例如化學(xué)制造)中正在逐步淘汰這種工藝。使用物聯(lián)網(wǎng)傳感器數(shù)據(jù)和預(yù)測(cè)性維護(hù)進(jìn)行實(shí)時(shí)資產(chǎn)管理對(duì)于制藥行業(yè)的成功和革命至關(guān)重要。
批處理過(guò)程和過(guò)渡困難
藥品通常采用分批處理的方式生產(chǎn),包括將化合物在大桶中混合,然后長(zhǎng)時(shí)間拖延以測(cè)量每種中間產(chǎn)品的質(zhì)量,然后進(jìn)行下一步,有時(shí)在另一家工廠進(jìn)行。機(jī)械不能連續(xù)使用。有關(guān)條件,狀態(tài)和質(zhì)量的信息通常分布在各種各樣的獨(dú)立系統(tǒng)中。仍收集一些關(guān)鍵數(shù)據(jù)并將其存儲(chǔ)在紙質(zhì)日志中。
如果制造過(guò)程是連續(xù)的,并用于從汽車到化學(xué)工業(yè)的各個(gè)方面,則制造效率會(huì)更高,在這種情況下,化合物可以不間斷地在工廠內(nèi)移動(dòng),并經(jīng)過(guò)測(cè)試和測(cè)量,從而發(fā)揮了物聯(lián)網(wǎng)的優(yōu)勢(shì)。連續(xù)制造還可以更靈活地響應(yīng)需求。如果需要更多,您可以運(yùn)行更長(zhǎng)的時(shí)間來(lái)逐步增加產(chǎn)品,而隨著批次的增加而增加數(shù)量則需要開(kāi)始一個(gè)全新的批次,這意味著所有的延遲和供過(guò)于求的可能性。
不幸的是,在制藥業(yè)實(shí)現(xiàn)現(xiàn)代化生產(chǎn)工藝的途徑并非一帆風(fēng)順。
法規(guī)驅(qū)動(dòng)的行業(yè)
考慮到藥品制造中錯(cuò)誤的可能后果,對(duì)藥品進(jìn)行了嚴(yán)格的監(jiān)管。這些法規(guī)幫助延遲了制造流程,現(xiàn)在將推動(dòng)變革。
當(dāng)美國(guó)食品藥品監(jiān)督管理局(FDA)批準(zhǔn)藥品時(shí),批準(zhǔn)的不僅是活性化合物。包括制造過(guò)程本身的詳細(xì)信息(包括工廠布局)。過(guò)程中的任何更改都需要獲得相關(guān)文件工作的明確監(jiān)管批準(zhǔn)。在其他行業(yè)中,持續(xù)的流程改進(jìn),更快的庫(kù)存訪問(wèn)和步驟的取消是公司競(jìng)爭(zhēng)優(yōu)勢(shì)的一部分。制藥業(yè)轉(zhuǎn)型需要更多的計(jì)劃。
FDA已經(jīng)認(rèn)識(shí)到固有的監(jiān)管困難,并成立了新興技術(shù)團(tuán)隊(duì)(ETT),其目的是鼓勵(lì)采用新的制造方法,尤其是連續(xù)制造。目的是在任何法規(guī)提交之前,他們將在開(kāi)發(fā)的早期與制藥公司會(huì)面。任何提議的制造過(guò)程都將在提交批準(zhǔn)之前進(jìn)行全面審查。
盡管FDA對(duì)全球藥品批準(zhǔn)產(chǎn)生巨大影響,但它遠(yuǎn)非唯一一家此類機(jī)構(gòu)。全球有100多個(gè)藥品監(jiān)管機(jī)構(gòu),全球制藥商在計(jì)劃更改生產(chǎn)流程時(shí)必須考慮到每個(gè)機(jī)構(gòu)。
早期的成功
ETT已經(jīng)證明了其有效性。自2015年以來(lái),Vertex一直在為囊性纖維化藥物Orkambi使用連續(xù)生產(chǎn)。經(jīng)過(guò)漫長(zhǎng)的開(kāi)發(fā)周期,Janssen(現(xiàn)為強(qiáng)生公司的一部分)于2016年轉(zhuǎn)向其HIV藥物Prezista的連續(xù)生產(chǎn)。兩者都與FDA密切互動(dòng),以確保在將藥物提交批準(zhǔn)之前批準(zhǔn)了制造過(guò)程。強(qiáng)生特別指出,結(jié)合以前由物聯(lián)網(wǎng)傳感器實(shí)現(xiàn)的單獨(dú)測(cè)試和采樣步驟是一項(xiàng)重大改進(jìn)。
合規(guī)優(yōu)勢(shì)
物聯(lián)網(wǎng)在合規(guī)性方面的優(yōu)勢(shì)可能是其業(yè)務(wù)案例的重要組成部分,因?yàn)槲锫?lián)網(wǎng)提供了監(jiān)視和記錄制造過(guò)程中每個(gè)步驟的所有事件,變化和集中度的能力。從物聯(lián)網(wǎng)傳感器收集的數(shù)據(jù)使工廠操作員可以了解整個(gè)過(guò)程中發(fā)生的情況。如果某種化合物的特定運(yùn)行與某種問(wèn)題有關(guān),這也可以為召回提供復(fù)雜的跟蹤。
物聯(lián)網(wǎng)還允許監(jiān)視和記錄承包制造組織(CMO)的活動(dòng),這些活動(dòng)執(zhí)行大部分實(shí)際制造。藥物供應(yīng)鏈變得越來(lái)越復(fù)雜,其中活性藥物成分(API)的制造,整體配方和包裝通常在不同的地方進(jìn)行,通常由不同的簽約供應(yīng)商進(jìn)行。
因此,藥品監(jiān)管機(jī)構(gòu)對(duì)監(jiān)控,跟蹤和報(bào)告的需求可以推動(dòng)物聯(lián)網(wǎng)的采用并降低其速度。法規(guī)遵從性是經(jīng)常被低估的IoT驅(qū)動(dòng)程序。
物聯(lián)網(wǎng)與制藥業(yè)的發(fā)展之路
制藥設(shè)備及其組成成分往往非常昂貴,并且制造條件必須保持在極窄的公差范圍內(nèi)。連續(xù)制造將使生產(chǎn)線上任何地方設(shè)備故障的后果更加嚴(yán)重。批處理可以在一個(gè)地方或另一個(gè)地方等待一會(huì)兒,這使得單點(diǎn)設(shè)備故障顯得更為寬容。使用物聯(lián)網(wǎng)傳感器數(shù)據(jù)和預(yù)測(cè)性維護(hù)進(jìn)行實(shí)時(shí)資產(chǎn)管理至關(guān)重要。
除了停產(chǎn)線的成本外,還有保持質(zhì)量的問(wèn)題,這是FDA最重要的考慮因素。他們總是犯謹(jǐn)慎的一面,所以任何可能引起質(zhì)量問(wèn)題的藥物都是有罪的,直到被證明是無(wú)辜的。因此,預(yù)計(jì)故障,基于磨損的更換以及最少的計(jì)劃外停機(jī)時(shí)間將使管理制造質(zhì)量,效率和法規(guī)遵從性變得更加容易,同時(shí)還能靈活地適應(yīng)不斷變化的市場(chǎng)需求。
責(zé)任編輯:YYX
-
物聯(lián)網(wǎng)
+關(guān)注
關(guān)注
2909文章
44567瀏覽量
372810 -
FDA
+關(guān)注
關(guān)注
0文章
76瀏覽量
18325
發(fā)布評(píng)論請(qǐng)先 登錄
相關(guān)推薦
醫(yī)療物聯(lián)網(wǎng)的技術(shù)發(fā)展及Silicon Labs解決方案
集成電路與物聯(lián)網(wǎng)發(fā)展關(guān)系
制劑車間物聯(lián)網(wǎng)系統(tǒng)建設(shè)方案

物聯(lián)網(wǎng)學(xué)習(xí)路線來(lái)啦!
物聯(lián)網(wǎng)技術(shù)的未來(lái)發(fā)展

數(shù)字化轉(zhuǎn)型,企業(yè)發(fā)展必經(jīng)之路 #人工智能 #plc #物聯(lián)網(wǎng)
淺談安科瑞EMS2.0能效管理平臺(tái)在制藥廠潔凈室的電氣設(shè)計(jì)與選型
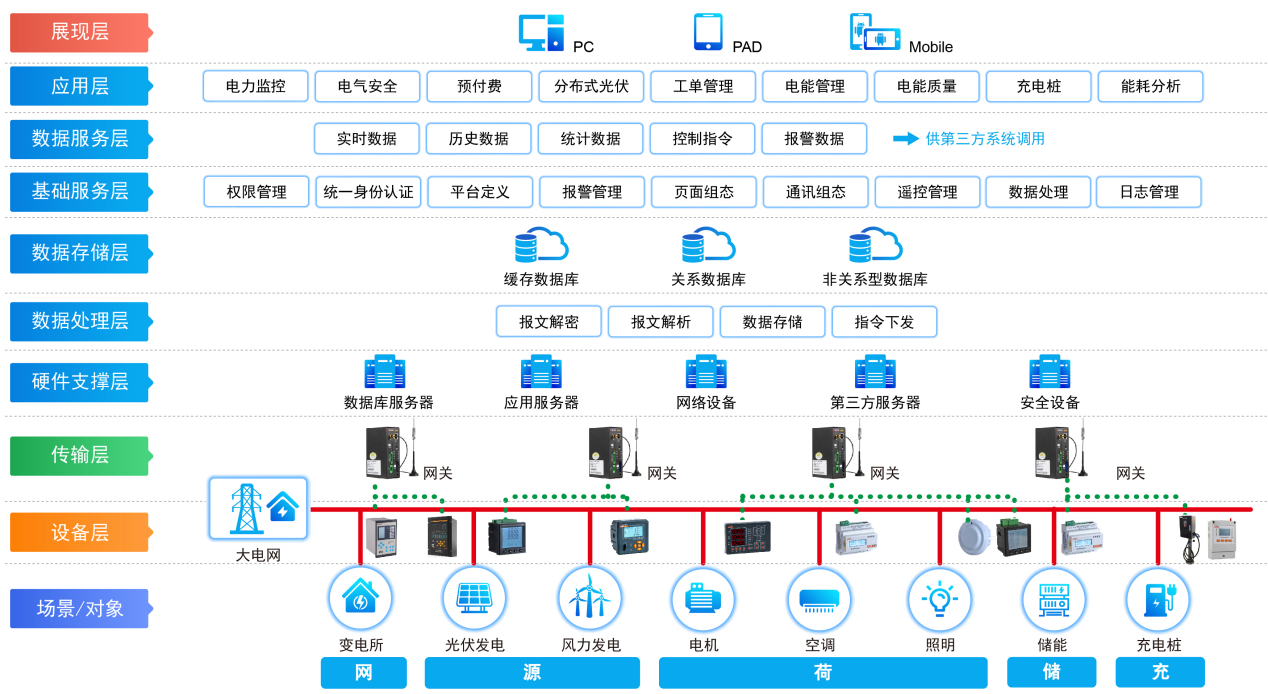
什么是物聯(lián)網(wǎng)技術(shù)?
2024:電梯物聯(lián)網(wǎng)的必然之路|梯云物聯(lián)
“物聯(lián)網(wǎng)+農(nóng)業(yè)”助力農(nóng)業(yè)節(jié)水增效高質(zhì)量發(fā)展
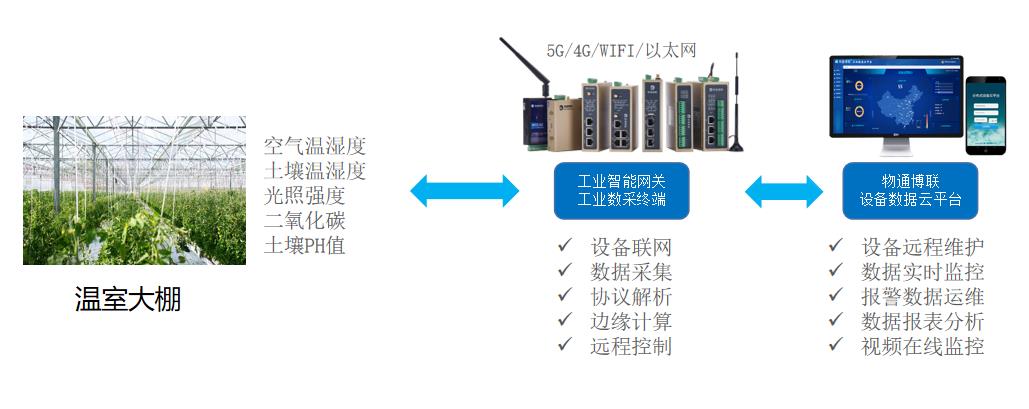
工業(yè)物聯(lián)網(wǎng)之電梯物聯(lián)網(wǎng)行業(yè)發(fā)展趨勢(shì)及發(fā)展機(jī)遇風(fēng)險(xiǎn)特征分析|梯云物聯(lián)
4G物聯(lián)網(wǎng)開(kāi)關(guān)求助
以創(chuàng)新驅(qū)動(dòng)農(nóng)業(yè)可持續(xù)發(fā)展之路,共謀發(fā)展新篇張

淺析泛在電力物聯(lián)網(wǎng)發(fā)展形態(tài)與挑戰(zhàn)




 物聯(lián)網(wǎng)與制藥業(yè)的發(fā)展之路
物聯(lián)網(wǎng)與制藥業(yè)的發(fā)展之路










評(píng)論