2020年11月,北京大學核物理與核技術國家重點實驗室楊根研究組與定量生物中心羅春雄研究組在《Lab on a Chip》以正封面發表題為“A novel microfluidic device integrating focus-separation speed reduction design and trap arrays for high-throughput capture of circulating tumor cells”的研究論文,實現了快速高效和高純度的從癌癥患者血液中分離循環腫瘤細胞(Lab Chip 20: 4094-4105, 2020)。
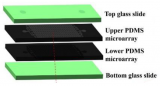
芯片的整體示意圖
癌癥從發生到臨床發現往往需要10年的時間,癌癥治療的根本途徑是早期發現或者對已轉移瘤能有效治療。循環腫瘤細胞(circulating tumor cells, CTC)是指從原位瘤脫落下來進入到循環系統的腫瘤細胞。作為精準醫療和液態活檢核心靶標的CTC,不僅可用于癌癥轉移前的早期篩查,而且在臨床腫瘤的分期、預后、特異性藥物篩選、療效檢測、治療和復發監測等方面都具有極其重要的臨床應用價值。然而由于CTC在血液中數量極其稀少(約1-100個/mL),其高效高準確捕獲一直是前沿科學難題和臨床應用的關鍵障礙。
楊根課題組與羅春雄研究組密切合作,提出了一種整合型的微流控芯片新設計,將基于流線的降速結構和基于過濾的捕獲結構進行整合,能在很大流速范圍內(5-40 mL/h)都實現高效率(高達94.8%)和高純度捕獲(4log 白細胞去除率)。課題組也與山東齊魯醫院濟寧分院進行了臨床雙盲實驗,對11例肺癌、乳腺癌和肝癌患者血液中的CTC進行了雙盲檢測,檢出率高達100%,其中CTC個數從6-117個/mL不等,平均值31個/mL,中位數25個/mL。由于該芯片具有成本低,方便快速,效率高,對操作條件不敏感魯棒性好等特點,非常適合大規模臨床應用。目前該微流控芯片已申請國內專利和國際專利各一項。
北京大學核物理與核技術國家重點實驗室的17級博士生蘆春洋和物理學院17級碩士生許健為該文的第一作者,核物理與核技術國家重點實驗室的楊根副教授和物理學院羅春雄教授為本文的共同通訊作者,其他參與人還包括核物理與核技術國家重點實驗室的王宇鋼教授、北京大學物理學院歐陽頎院士,以及物理學院博士生韓錦濤和李曉等。該工作獲得了國家自然科學基金重點和面上項目等的資助和支持。
楊根研究組一直圍繞癌癥診斷和治療的核心科學問題持續進行研究。涉及基于激光脈沖質子加速器研究FLASH超高劑量率放療的基礎生物物理過程(Frontiers in Cell and Developmental Biology, Accepted, 2021);揭示了癌干細胞(Cancer Science 111: 467-476, 2020;封面)、細胞外環境(Biotechnic & Histochemistry 95: 605-612, 2020;Biomedical Microdevices 22: 40-47, 2020)和細胞內染色質結構(Science China Life Sciences 63: 825-834, 2020)在癌癥轉移等過程中的關鍵作用;應邀總結和展望了基于CTC的新型POC癌癥診斷策略(Sensors 20, 6073; doi:10.3390/s20216073, 2020);針對間皮素陽性的實體瘤(胰腺癌、間皮癌、卵巢癌、肺腺癌和三陰性乳腺癌),開發了基于抗體和放射性alpha核素At-211的特異性治療偶聯物(Journal of Radiation Research 61: 684-690, 2020)和基于正電子核素Cu-64/I-124的特異性顯像探針(Molecular Pharmaceutics 17, 1875-1883, 2020,封面文章)。
責任編輯:lq
-
微流控芯片
+關注
關注
13文章
275瀏覽量
18855 -
微流控
+關注
關注
16文章
534瀏覽量
18913 -
精準醫療
+關注
關注
0文章
14瀏覽量
2347
原文標題:北大研發新型微流控裝置,可用于循環腫瘤細胞的高通量捕獲
文章出處:【微信號:MEMSensor,微信公眾號:MEMS】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦




 一種整合型的微流控芯片新設計
一種整合型的微流控芯片新設計












評論