這項(xiàng)研究工作由華盛頓大學(xué)生物工程系Folch實(shí)驗(yàn)室與人類生物學(xué)部Gujral實(shí)驗(yàn)室合作完成。
對(duì)特定患者完整的腫瘤樣本進(jìn)行功能性藥物篩查是為每個(gè)患者確定最佳療法的一種前景看好的方法。患者癌變組織活檢對(duì)單類藥物(或藥物組合)的反應(yīng)高度依賴于腫瘤微環(huán)境(TME),其中包括多種駐留和浸潤(rùn)的宿主細(xì)胞、分泌因子和細(xì)胞外基質(zhì)蛋白等。但是,當(dāng)前評(píng)估特定組織樣本藥物反應(yīng)的技術(shù),要求該組織樣本局部或整個(gè)脫離腫瘤微環(huán)境,這通常會(huì)導(dǎo)致臨床應(yīng)用的藥物不如預(yù)測(cè)效果好。比如,腫瘤球體模型在高通量藥物篩選實(shí)驗(yàn)中獲得了廣泛應(yīng)用。而該腫瘤球體是將細(xì)胞從患者組織切片中分離出來(lái),在特殊的基質(zhì)中培養(yǎng),從而產(chǎn)生細(xì)胞與細(xì)胞、細(xì)胞與基質(zhì)相互作用的3D多細(xì)胞球體。然而,這類腫瘤球體僅保留有限的腫瘤微環(huán)境,這就突出了對(duì)新型高通量藥物篩選平臺(tái)的需求。
據(jù)麥姆斯咨詢報(bào)道,華盛頓大學(xué)(University of Washington,簡(jiǎn)稱:UW)生物工程系Folch實(shí)驗(yàn)室與人類生物學(xué)部Gujral實(shí)驗(yàn)室合作,開(kāi)發(fā)了一種微流控平臺(tái),可將微量藥物輸送到被稱為“立方體”的小組織模型的活檢中。在微流控裝置中,該“立方體”通過(guò)含有分散孔的微通道流動(dòng),這些分散孔捕獲立方體用于培養(yǎng)和多藥物作用。研究小組最近在英國(guó)皇家化學(xué)學(xué)會(huì)(Royal Society of Chemistry)期刊Lab on a Chip上發(fā)表了一項(xiàng)使用該平臺(tái)的概念驗(yàn)證研究。借助該平臺(tái),科學(xué)家們旨在簡(jiǎn)化直接在人體內(nèi)的藥物測(cè)試,以準(zhǔn)確預(yù)測(cè)人體的藥物反應(yīng),并縮短藥物開(kāi)發(fā)時(shí)間。首席研究員Albert Folch博士補(bǔ)充說(shuō):“我們已經(jīng)展示了一種新的微型組織形式,它完整、形狀規(guī)則且易于在多孔格中大量排列(可用于藥物測(cè)試)。我們相信,這為未來(lái)繞過(guò)動(dòng)物實(shí)驗(yàn)直接在人體中篩選藥物(目前仍無(wú)法實(shí)現(xiàn))提供了可能。”
微流控平臺(tái):可以在保存良好的微環(huán)境下對(duì)活組織的等尺寸微尺度“立方體”模型進(jìn)行多藥物測(cè)試(圖片來(lái)源:Albert Folch博士)
該研究將小鼠肝臟活組織切片,并將膠質(zhì)瘤細(xì)胞衍生的異種移植瘤切成400 μm × 400 μm × 400 μm大小相同的數(shù)千個(gè)立方體狀切片,形成“立方體”組織模型。該“立方體”的尺寸在保存腫瘤微環(huán)境方面足夠大,在維持營(yíng)養(yǎng)輸送和活性方面又足夠小,以確保其在微流控設(shè)置中適當(dāng)流動(dòng)。“立方體”的小尺寸允許最大限度使用小型臨床樣本,這些樣本通常很難獲得,并且有多種用途(包括診斷性組織學(xué)檢查、免疫組織化學(xué)和分子研究等)。為了驗(yàn)證“立方體”的完整性和活性,研究人員用開(kāi)頂式光片(OTLS)顯微鏡對(duì)固定和光學(xué)透明化肝臟“立方體”的3D組織微環(huán)境進(jìn)行了可視化觀察。他們?cè)诟闻K、血管和肝臟特異性結(jié)構(gòu)中識(shí)別出不同的細(xì)胞類型,證明了組織樣本的完整性。此外,通過(guò)免疫染色檢查的膠質(zhì)瘤“立方體”顯示出持續(xù)的增殖,最小的細(xì)胞死亡以及內(nèi)皮細(xì)胞和免疫細(xì)胞的存活,證明了“立方體”的活性和功能性。
最后,研究人員利用膠質(zhì)瘤“立方體”模型,評(píng)估了不同濃度順鉑(一種細(xì)胞毒性化療藥物)的效果。經(jīng)過(guò)兩天的治療,在大部分濃度的測(cè)試中觀察到明顯的細(xì)胞死亡(相對(duì)于未處理的立方體),這突出了該系統(tǒng)在藥物測(cè)試中的實(shí)用性。綜上所述,該研究將腫瘤“立方體”的顯微解剖與微流控相結(jié)合,能夠在完整組織中更好地保護(hù)組織微環(huán)境,以進(jìn)行藥物測(cè)試。Folch博士分享了使用這種“立方體”模型平臺(tái)的未來(lái)發(fā)展方向:“我們正在準(zhǔn)備更大吞吐量的平臺(tái)(如384孔平臺(tái)),可以捕獲并容納從每個(gè)微小腫瘤獲得的大量‘立方體’。我們了解過(guò)很多關(guān)于腫瘤球體及有機(jī)技術(shù)的設(shè)想——在某種意義上說(shuō),我們的‘立方體’模型是‘新一代球體模型’,因?yàn)樵摗⒎襟w’是直接從患者體內(nèi)取出的,沒(méi)有對(duì)腫瘤微環(huán)境造成任何重大破壞,因此我們相信我們可以準(zhǔn)確地重現(xiàn)藥物和腫瘤的相互作用。”
該研究得到了美國(guó)國(guó)家癌癥研究所(National Cancer Institute)的資助,朱諾醫(yī)療(Juno Therapeutics)的試點(diǎn)撥款,華盛頓大學(xué)CoMotion的創(chuàng)新資助。其它資助者或資助獎(jiǎng)項(xiàng)有:香港研究資助局(Hong Kong Research Grant Council)、墨西哥科技理事會(huì)(Consejo Nacional de Ciencia y Tecnología)的國(guó)際學(xué)者獎(jiǎng)、美國(guó)國(guó)防部(Department of Defense)的前列腺癌研究項(xiàng)目(Prostate Cancer Research Program)以及美國(guó)國(guó)家科學(xué)基金會(huì)(National Science Foundation)的研究生研究獎(jiǎng)學(xué)金計(jì)劃(Graduate Research Fellowship Program)。
美國(guó)Fred Hutch癌癥研究中心和華盛頓大學(xué)癌癥聯(lián)盟成員Albert Folch、Robert Pierce和Taran Gujral對(duì)該項(xiàng)研究做出了貢獻(xiàn)。
責(zé)任編輯:lq
-
模型
+關(guān)注
關(guān)注
1文章
3229瀏覽量
48813 -
微流控
+關(guān)注
關(guān)注
16文章
526瀏覽量
18891
原文標(biāo)題:“立方體”腫瘤組織模型結(jié)合微流控,實(shí)現(xiàn)完整組織中的藥物測(cè)試
文章出處:【微信號(hào):MEMSensor,微信公眾號(hào):MEMS】歡迎添加關(guān)注!文章轉(zhuǎn)載請(qǐng)注明出處。
發(fā)布評(píng)論請(qǐng)先 登錄
相關(guān)推薦
從片上系統(tǒng)(SoC)到立方體集成電路(CIC)

使用原代腫瘤細(xì)胞進(jìn)行藥物篩選的數(shù)字微流控系統(tǒng)
基于漩渦湍流輔助的微流控平臺(tái),可實(shí)現(xiàn)類精子結(jié)構(gòu)的微型機(jī)器人一步成型

普及水肥一體化技術(shù),讓農(nóng)業(yè)產(chǎn)量翻倍
S型微流控芯片的優(yōu)勢(shì)
言犀智能體平臺(tái)上線了!趕緊來(lái)試試!連接大模型與企業(yè)應(yīng)用的“最后一公里”
玻璃微流控芯片前景分析
創(chuàng)意挑戰(zhàn)丨從0自制“自平衡立方體”(分享開(kāi)源資料)

創(chuàng)意挑戰(zhàn)丨從0自制“自平衡立方體”(分享開(kāi)源資料)
介紹一種用于絕對(duì)定量的微腔式數(shù)字PCR微流控芯片
淺談微流控芯片技術(shù)

使用Arduino Nano制作一個(gè)4×4×4 LED立方體
一種光固化通道數(shù)字微流控芯片(pCDMF)
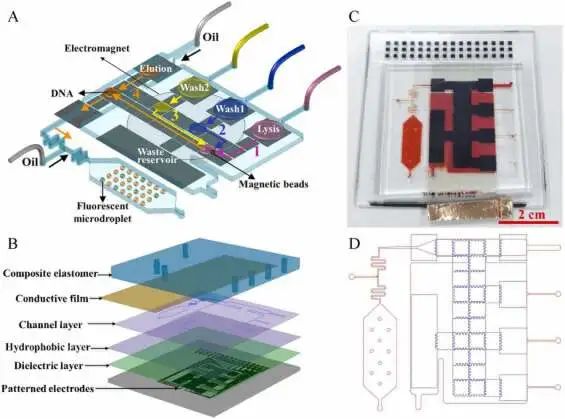




 一種微流控平臺(tái)將微量藥物輸送到被稱為“立方體”的小組織模型的活檢中
一種微流控平臺(tái)將微量藥物輸送到被稱為“立方體”的小組織模型的活檢中











評(píng)論