一般情況下,可充電電池中電解液主要以無水有機溶液為主,具有較高的電化學窗口,因而可以發揮出遠高于傳統二次電池如鉛酸電池、氫鎳電池的能量密度,但是有機電解液易燃有毒及嚴格的操作條件等限制了其在大規模儲能的應用,因而發展綠色環保的高比能新電池體系成為當前的研究熱點之一。
自1994年報道了以VO2做負極,LiMn2O4做正極,LiNO3水溶液做電解液的水系鋰離子電池后,具有高導電,高倍率性能的水系電池就受到人們廣泛關注。
與有機電解液相比,水系電解液安全、綠色、高效且可以在更寬的溫度范圍工作(如傳統的有機電池僅能在低于60℃的條件下工作),因而采用水系電解液取代有機電解液是解決有機電解液易燃、有毒、安全性低的有效方法之一。但是水系電池仍然存在固有缺陷,如較窄的電化學窗口(《1.23V),存在副反應,電極材料的分解等,這些因素限制了水系電池的發展。
一、水系電解液面臨的問題與挑戰
水系電解液作為電池(電容器)的重要組成部分,其中發生的化學/電化學過程遠比有機電解液要復雜得多,會發生許多副反應,從而使得水系電池(電容器)循環穩定性很差,且輸出電壓低,電池比能量約為40-50Wh/kg,與鎳鉻電池相當。這些副反應主要包括:
(1)電極材料與水或氧反應。一般情況下,水系電解液無毒無害且穩定存在,在空氣中組裝即可。Li等在理論上證明了當電解液中有氧氣或水存在時,會使得負極材料被O2和H2O氧化而非發生電化學氧化還原過程,通過除氧或調節電解液在適當的pH值可以保證電極材料的穩定性;
(2)質子共嵌反應。因為H+的半徑比Li+小很多,因此Li+發生嵌入反應時,會伴隨H+的嵌入。質子共嵌反應一般與電極材料的晶體結構與電解液的pH值有關。通常,尖晶石Li1-xMn2O4與橄欖石Li1-xFePO4不存在質子共嵌現象而層狀材料如Li1-xCoO2 , Li1-xNi1/3Mn1/3Co1/3O2在較低的酸性電解液中會發生質子共嵌現象,可以通過碳包覆改性或調節電解液pH值來改善;
(3)析氫/析氧反應。為使電極材料發揮出最大容量,電池(電容器)的電化學窗口應該小于電解液的分解電壓,而水的電化學穩定窗口僅為1.23V,在此區間內,電極材料無法發揮出最大容量,必然會發生水的分解,即導致析氫/析氧反應的發生,電極附近pH值發生變化,電極材料穩定性變差。解決此方法可以通過構建穩定的電極電解液界面或抑制水的活度來實現;
(4)電極材料的分解。通常低溫條件下制備的材料具有較大的比表面積,或者含有多變價金屬元素的材料(VO2 , LiV3O8 , LiV2O5)在水溶液中不穩定,易分解,因此適用于水系電解液的材料很少 。電極材料應盡量選擇比表面積小的電極材料,可以通過摻雜、碳包覆等方式來提高材料的穩定性。
總之,基于水系電解液中反應的復雜性,水系儲能裝置電壓普遍低于1.5V,且循環穩定性很差,無法實現大規模商業化應用。要改善水系儲能裝置的性能,除了電極材料的選擇、優化組裝條件等,提高電解液的電化學窗口是解決水系電池低壓低能量密度的關鍵技術之一。
二、電解液電壓改善方法及進展
2.1 構建穩定的電極電解液界面
穩定的電極-電解液界面是實現拓寬電化學窗口的有效方法之一,隨著電解質的分解,在固體電極和電解液之間形成穩定的中間相,這些中間相通常是離子導電而電子不導電的。
2015年,Suo等報道了一種“Water-in-salt“ 體系,即采用有機鹽雙三氟甲基磺酰亞胺鋰(LiTFSI)與水形成的超高濃度水溶液,在該體系中溶質的質量和體積遠高于溶劑。此時,每個離子周圍的水分子數遠低于常規水系電解質中的“溶劑化數”,包含陰離子的鋰離子溶劑化鞘,離子之間的相互作用增強,促進中間相的形成(如圖1所示)。
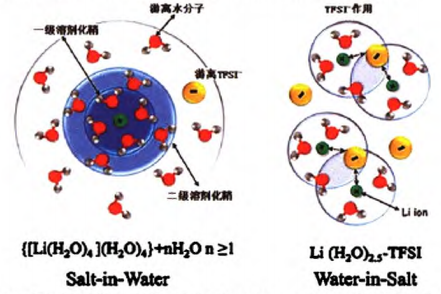
圖1 Li+溶劑化鞘在稀溶液與”Water-in-salt”溶液中的演化
該水溶液室溫時可達到21 mol/L。通過測試不銹鋼集流體的循環伏安曲線確定該電解液的電化學窗口,如圖2所示。從圖中可以發現這種高濃度的電解液主要對析氫反應有抑制作用,且隨TFSI濃度的增加,抑制作用增強,電位由2.63V降至1.9V,從而拓寬到3.0V。
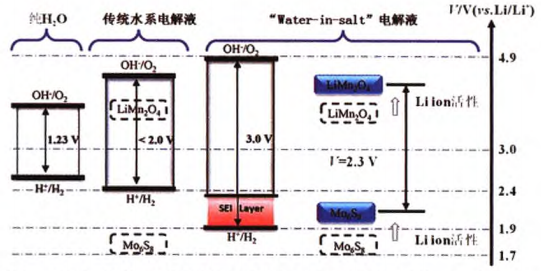
圖2 高濃度水系電解液的電化學窗口及對LiMn2O4/Mo6O8電池的電壓調節作用
為測試這種電解液的性能,Wang課題組采用LiMn2O4和Mo6O8電極組裝全電池,其全電池電壓高達2.3V , 比能量將近100Wh/kg,遠高于鉛酸蓄電池,且4.5C倍率下循環1000次,庫侖效率為100% ,具有較高穩定性。
總之,高濃度LITFSI鹽溶液會在負極表面形成一層氧化物薄膜,這是第一次在水系電解液中提出SEI膜的概念。該電解液體系的發現,打破了傳統的通過犧牲電壓來達到電池穩定性的觀念,使電池的電壓和穩定性有大幅度提升,這在水系儲能裝置領域是一個重大突破,同時中間相的形成和作用為我們研究水系電池打開了新思路。
在上述研究的基礎上,Wang課題組又采用了一種新的陰極添加劑-三(三甲基硅基)硼酸(TMSB),添加劑的氧化形成了CEl(正極-電解液中間相),提高了LiCO2在水系電解液中的穩定性。理論計算表明,TMSB的最高分子占據軌道(HOMO)是檢測氧化反應的關鍵因素,通過與“water-in-salt“ 體系中H2O和TFSI陰離子的HOMO對比,TMSB的HOMO遠高于電解液中的水分子或TFSI陰離子(如圖3所示)。
這表明,電解液氧化反應首先發生在TMSB上,且進一步模擬實驗表明,添加劑的水解會在陰極表面形成不溶性的共沉淀物,抑制了Co的溶解和析氧反應,提高了LiCO2的循環穩定性。
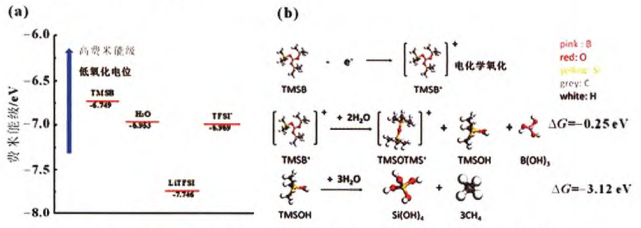
圖3 (a) TMSO,H2O,LITFSI和TFSI的最高占據軌道;(b)TMSB電化學氧化分解機理
同時該課題組指出了添加劑的選擇標準:
(1)添加劑的氧化電位比“water-in-salt”體系中水的氧化電位低;
(2)添加劑不可水解。
Wang課題組采用LiCO2和Mo6O8電極組裝全電池,其全電池電壓高達2.5V,且0.5C倍率下循環1000次,容量每次僅衰減0.013%,穩定性極高,這是第一次提出正極表面中間相的存在,這一新發現為研制高能量密度的穩定高電壓水電池提供了一定的啟示。
Wang等研究人員的研究表明,中間相的形成可以阻止電極與水直接接觸,同時構建穩定的電極-電解液界面,在提高電池電壓的同時提高電池的循環穩定性。
2.2 水合物熔融鹽
除了形成穩固的界面,高濃度電解液本身也可以起到抑制水的活度及材料溶解的作用。2016年, R.S.Kuhnel等采用高濃度LiTFSl為電解液,成功地抑制了AI的溶解,有望采用輕質的鋁做集流體,降低電池生產成本提高效益。
同年, Yumada課題組報道了水合物熔融鹽電解質,即包含高濃度的金屬鋰鹽及極少水的一類電解液。在這種電解液中,所有的水分子與金屬陽離子配位,同時保持流動性。該課題組采用雙三氟甲基磺酰亞胺鋰(LITFSl)與雙(五氟乙基磺酸)亞胺鋰( LiBETI)的二元體系作為電解液,該電解液體系中,陰離子的存在促進了Li+的溶劑化,同時具有“增塑性”抑制鋰鹽與鋰鹽溶劑結晶的產生,保證了電解液的流動性。
相圖研究表明【 如圖4(a)】,LITFSl和LiBETI摩爾比為7:3比與H2O有更大的相容性(如圖4),高比例下電解液的電化學窗口拓寬到3.8V。基于此水合物熔融鹽體系,由 Li4Ti5O12電極與 LiCoO2/Li4Ti5O12組成的全電池電壓為2.3-3.1V,平均比能量高達130Wh/kg,這一研究推動了水系電池的發展。

圖4 (a) Li(TFSI)x(BETI)1-x混合物液相線;(b)室溫水合物熔融鹽的制備
2.3 電解液的pH值調節
理論上,由于析氫析氧反應的存在,使得水系電解液的電化學窗口限制在1.23V左右,通過調節電解液的pH值,可以有效抑制析氫/析氧反應,拓寬電化學穩定窗口。
早在2005年,V.Khomenko等指出析氫和析氧反應的過電勢取決于電解液的pH值,并探究了α-MnO2和活性炭組裝的水系非對稱電容器,以KNO3(2 mmol/L , pH=6.4)電解液為基礎,通過添加HNO3和KOH來調節電解液的pH值,測定α-MnO2和活性炭的電位與pH值關系。結果表明,pH為6.4的條件下α-MnO2可以達到更寬的電化學窗口0.47-1.19V,而活性炭的電化學窗口為-0.88-0.47V,因此組裝的電容器電位高達2.1V。
2010年,M.P.Bichat等采用海藻碳組裝的電容器在中性電解液(Na2SO4)中的工作電壓達到1.6V,這是第一次證明在中性電解液中,如果材料表面具有足夠的表面官能團,尤其是醌類基團,材料就可以與電解液發生贗電容反應。與有機電解液相比,中性電解液有望應用于環境友好的電容器領域。
2011 , Yang采用水合石墨烯薄膜作為電極制備高壓超級電容器在中性 Li2SO4電解液中的最大電壓高達1.6v,甚至1.8V。2013年,Chen等研究人員基于酸堿雙電解質采用陶瓷超離子導體薄膜作為離子交換介質,正極采用酸性電解液提高析氧電位,負極采用堿性電解液降低析氫電位,使得電解液原來的電化學窗口由1.23V拓寬到3.0V(如圖5所示),并在此電解液的基礎上組裝了Zn/KMnO4水系電池,其工作電壓高達2.8V。
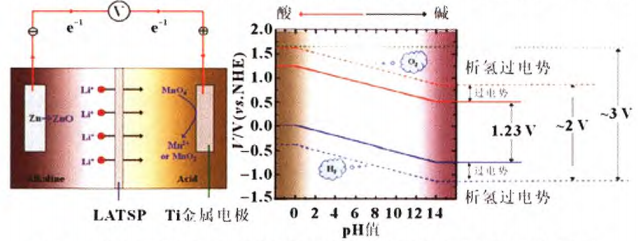
圖5 (a) Zn/KMnO4電池的結構及工作原理;(b)電解液在不同pH值下的穩定窗口
2017年, Wang課題組采用LiTFSI做電解液,用HTFSI調節電解液pH=5,以 LiNi0.5Mn1.5O4/Mn6S8組裝的電池電壓為3.0V,比能量高達126Wh/kg,且5C倍率下每次容量衰減0.075%。目前為止,可以使水系儲能裝置實現高壓的方法及進展如圖6所示。
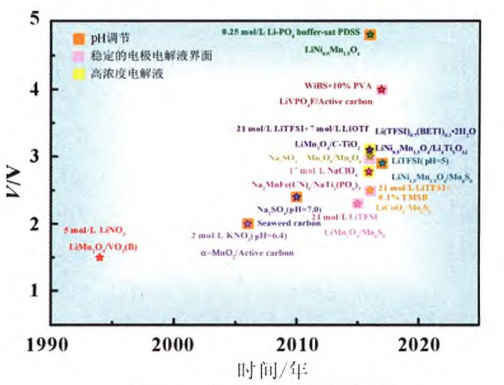
圖6 電壓改善方法及進展
三、結論與展望
水系電解液因其高安全性、高倍率性能,有望取代有機電解液成為新一代電化學儲能裝置,可以緩解環境污染及化石能源的消耗,但是水系固有的電化學窗口大大限制了其使用。近幾十年來,人們對水電池進行了大量的研究,以提高電池的電壓,目前有效提高水系電池電化學窗口的方法主要有pH值調節、中間相的形成和濃縮電解質,但對這些新的電池體系所涉及的機制仍然缺乏完整的理解。
總之,通過選擇合適的電極材料、電解液、pH值控制和電池組裝工藝的優化,可以構建出一種既具有穩定比能量又具有較高電壓的水系儲能裝置。但是距離水系儲能裝置實現大規模的商業化應用還有很長一段路要走,必須指出的是,水系電解液的研究是一個新的領域,具有很高的學術價值,其實際應用需要在科學的指導下大膽假設,小心求證,合理判斷。
編輯:jq
-
電解液
+關注
關注
10文章
848瀏覽量
23093 -
電池組裝
+關注
關注
0文章
5瀏覽量
6167 -
電極材料
+關注
關注
0文章
84瀏覽量
6583
發布評論請先 登錄
相關推薦
快充過程析鋰、SEI生長和電解液分解耦合機制的定量分析

鈉電新突破:實現寬溫長壽命電池的電解液革新
海瑞思雙工位電解液質譜檢漏解決方案為新能源汽車產業持續發展筑牢安全防線
AI大模型的最新研究進展
鎳氫電池的電解液是什么
高壓電解電容虛標原因,高壓電解電容虛標怎么判斷
新宙邦擬在美國投建10萬噸/年電解液項目
鋰離子電池生產過程中濕度控制的重要性





 解析高電壓水系電解液最新研究進展
解析高電壓水系電解液最新研究進展











評論