癌癥已成為對人類生命健康的危險之一,死亡率和發病率持續升高。液體活檢作為新興的腫瘤診斷技術,因其無創性、敏感性、操作便捷等優勢受到關注。液體活檢使用的生物標記物主要有循環腫瘤細胞(CTCs)、細胞外囊泡(EVs)和循環腫瘤DNA。循環腫瘤細胞是一類從腫瘤部位脫落進入外周血液循環系統的癌細胞。研究表明其與癌癥病人的腫瘤轉移、癌癥復發、治療效果評估、用藥指導及預后等密切相關。然而,CTCs在癌癥病人血液中的數量稀少,多數情況下在1 mL血液中僅有幾個;此外,目前主流循環腫瘤細胞分離方法均是基于一種腫瘤標志物,如上皮細胞粘附分子(EpCAM)、人表皮生長因子受體2(HER2)、葉酸受體等,而由于腫瘤異質性的存在會導致基于單一腫瘤標志物的捕獲方法效率不理想。
針對上述挑戰,中國科學院蘇州納米所裴仁軍研究團隊利用單寧酸(TA)功能化磁性納米顆粒(MNPs),建立了一種從患者血液樣本中有效分離異質性CTCs的簡單、廣譜的方法。研究利用單寧酸與鐵離子的配位作用制備了功能化四氧化三鐵磁性納米顆粒,該材料從8種癌癥病人的血液樣品檢測到CTCs。與免疫磁珠及微流控芯片技術相比,其操作過程簡便,僅需要一種化學分子的修飾即可實現對多亞型癌細胞的有效捕獲(圖1)。相關研究成果以Tannic Acid (TA)-functionalized Magnetic Nanoparticles for EpCAM Independent Circulating Tumor Cell (CTC) Isolation from Patients with Different Cancers為題,發表在ACS Applied Materials & Interfaces 2021, 13, 3694-3700上。蘇州納米所博士研究生丁丕為論文第一作者。
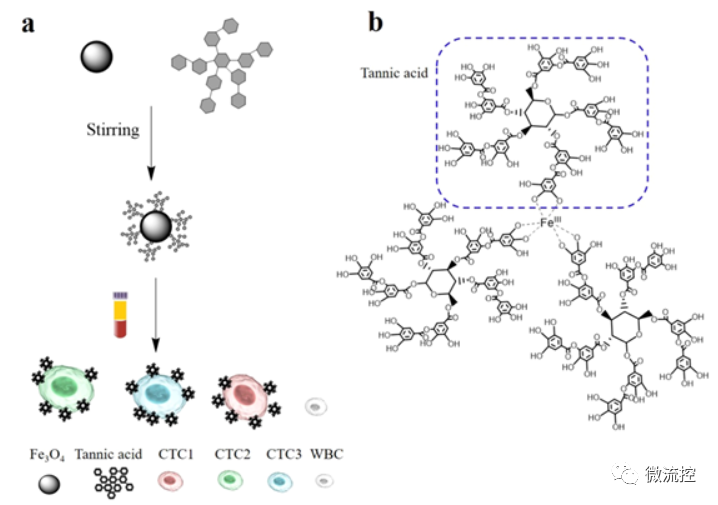
圖1 (a)單寧酸功能化磁性納米顆粒從血液中分離循環腫瘤細胞的原理圖;(b)單寧酸分子結構
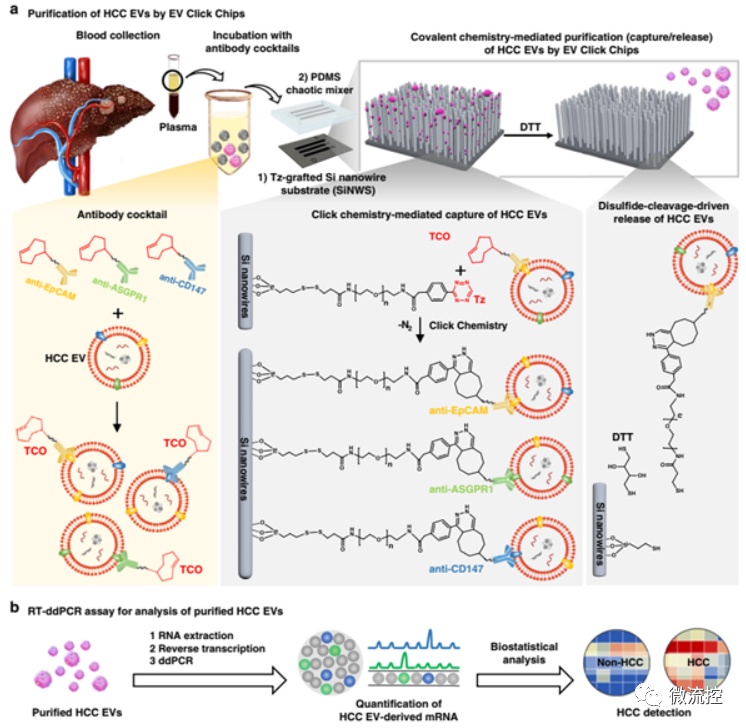
圖2 肝細胞癌細胞外囊泡的純化與分析。(a)EVs點擊芯片的裝置結構及工作原理;(b)將純化的肝細胞癌EVs進行反轉錄微滴數字PCR(RT-ddPCR),以獲得10個肝細胞癌特異性基因的檢測,這些基因可用于區分出肝細胞癌患者
EVs是由細胞產生的納米級囊泡,包含DNA、蛋白質、信使RNA、非編碼RNA等成分。研究表明,EVs與腫瘤的發生、發展、轉移以及抗藥性相關,通過對其內部信息的分析可用于癌癥的早期診斷、復發監測、抗藥性檢測等。目前,EVs分離的方法,主要包括超高速離心法、免疫磁珠法以及柱層析法。利用這些方法分離得到的樣本普遍存在較多的非腫瘤來源的EVs,從而對腫瘤的檢測信號造成干擾。此外,肝細胞癌來源的EVs還存在著高度異質性,這些因素導致肝細胞癌來源EVs的特異分離更加困難。
為了解決上述問題,美國加州大學研究團隊與裴仁軍研究團隊合作,利用肝細胞癌特異的三種抗體,與納米結構基底的微流控芯片進行“點擊化學”反應,對病人血漿中的腫瘤來源EVs進行捕獲,實現肝細胞癌來源EVs的高效高純度分離。科研人員將三種反式環辛烯(TCO)修飾的抗體與人工樣本進行孵育,對癌細胞EVs進行特異識別和標記,而后將標記后EVs的樣本通入四嗪(Tz)修飾的納米基底芯片內,通過TZ-TCO之間高效的“點擊化學”反應將抗體與抗原的免疫結合轉換成穩定的共價鍵結合,從而實現EVs的精準捕獲。研究利用微滴式數字PCR(ddPCR)技術對選定的10基因組合對臨床血漿樣本的診斷進行驗證。該研究提供了一種HCC EVs純化系統,并對HCC特異性的mRNA轉錄進行數字評分,可準確區分HCC患者與無癌癥和其他惡性腫瘤患者。相關研究成果以Purification of HCC-specific Extracellular Vesicles on Nanosubstrates for Early HCC Detection by Digital Scoring為題,發表在Nature Communications 2020, 11, 4489上。蘇州納米所博士孫娜為論文第一作者。
研究工作得到中科院對外合作重點項目的支持。
責任編輯:lq
-
納米
+關注
關注
2文章
696瀏覽量
36976 -
微流控芯片
+關注
關注
13文章
270瀏覽量
18833
原文標題:蘇州納米所腫瘤液體活檢研究獲進展
文章出處:【微信號:Micro-Fluidics,微信公眾號:微流控】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
Aigtek功率放大器如何幫助制備(1~100nm)級的納米薄膜

離子束與材料的相互作用
OptiSystem應用:EDFA中離子-離子相互作用效應
單層半導體中的新磁性:交換能量的關鍵作用
鐵磁性的概念、產生機理、應用
哈爾濱工業大學/南方科技大學:聚焦離子束制備高分辨率電化學-電致發光耦合雙極納米電極陣列傳感器

磁性開關可以由什么構成
鐵鋰離子電池的優缺點及應用
磷酸鐵鋰電池和三元鋰電池充電器可以通用嗎
MRAM(磁性只讀存儲器)和FRAM(鐵電RAM)有何區別




 利用單寧酸與鐵離子的配位作用制備了功能化四氧化三鐵磁性納米顆粒
利用單寧酸與鐵離子的配位作用制備了功能化四氧化三鐵磁性納米顆粒











評論