核酸脂質體納米粒LNP介紹及其制備方法
1.什么是核酸脂質體納米粒LNP
脂質體(Liposome)最早在1961年由科學家Alec Douglas. Bangham 和 R. W. Horne在顯微鏡下發現。脂質體是由脂質分子組成的囊泡結構,其脂質雙分子層形成疏水外殼和內部的水相空腔,兼具親水和疏水特性。脂質納米粒(Lipid Nanoparticle,LNP)是使用脂質形成納米微粒的一種。在過去,科研人員通常使用脂質納米粒直接包裹化學藥物,在基因治療領域,研究人員開始使用脂質納米粒包裹核酸,如mRNA、siRNA、pDNA等,稱為核酸脂質納米粒。
針對Covid-19新型冠狀病毒的mRNA疫苗開發,從病毒序列到成功上市只用了短短一年不到的時間。這在從前是無法想象和實現的。在這次針對Covid-19新型冠狀病毒的mRNA疫苗上,莫德納(Moderna)采用了自主開發的可電離脂質SM-102,而輝瑞和BioNTech則從Acuitas公司獲得了一種名為ALC-0315的可電離脂質的許可。
mRNA分子由于疫苗的關系為大眾所認識,但是很多人卻不知道mRNA疫苗的幕后功臣,甚至可以說是整個機理的關鍵所在,是將mRNA封裝并且安全有效地送進機體細胞的脂質納米粒(Lipid Nanoparticle,LNP)。從技術上來講,核酸藥物的研發主要有三個壁壘:第一個是原料端,包括mRNA原料序列的篩選和修飾;第二個是遞送系統;第三個是整個藥物的生產工藝。目前采用微流控技術產生脂質納米顆粒(LNP),將mRNA包裹在LNP 納米顆粒中,再進入人體, 是FDA唯一批準上市的mRNA傳遞技術,并且已經在世界各地注射上億劑的mRNA新冠疫苗中采用,其技術的安全性和有效性已經在這次全球的新冠疫情中得到驗證。
2.核酸脂質體納米粒LNP的作用機理
在包裹核酸的脂質納米粒配方中,起關鍵作用的是可電離脂質。例如Onpattro中的Dlin-MC3-DMA(簡稱MC3),其pKa值在6.3-6.5 之間,這個特性讓它在血清的環境中表面電荷基本為中性,有利于細胞將帶有核酸片段的脂質納米粒整個吞進細胞內,形成胞內體(endosome)。 一旦進入細胞后,胞內體的酸性環境使電離脂質的頭部質子化并帶正電荷,從而與胞內體的內膜融合,釋放目標核酸到細胞中發揮作用。
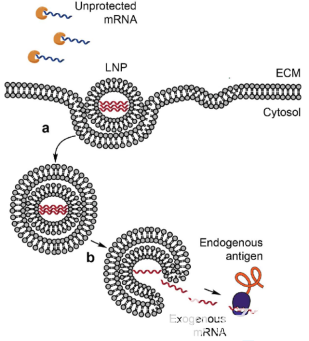
圖1 核酸脂質體納米粒LNP的作用機理
3.核酸脂質體納米粒LNP制備方法
最適合的技術還是采用微流控混合技術來制備核酸脂質納米粒,該方法相對簡便快速,條件溫和,同時容易實現生產放大。微流控技術基本原理:將脂質與核酸分別溶解在水相和有機相后,將兩相溶液注入制備系統的兩條入口通道,一端是RNA的水溶液,一端是脂質的乙醇溶液,通過兩相的快速混合,完成核酸脂質納米顆粒的合成。 改變流體注入速度和比率,可以控制脂質納米顆粒的粒徑大小。將各種脂質溶解在乙醇中,mRNA溶于酸性水緩沖液中,將兩相快速混合。通過稀釋乙醇相,脂質的溶解度降低,在混合溶液中逐漸析出凝固并形成脂質納米粒,同時高效包載mRNA。再經緩沖液膜包超濾或者透析除去殘留的乙醇,中和緩沖液的pH值。
4.制備核酸脂質體納米粒LNP的微流控芯片結構
利用微流控芯片技術制備核酸脂質體納米粒LNP主要是實現充分的混合,常采用魚骨結構。芯片中魚骨結構區域使流經的液體產生混沌流動,大大提高了液體的混合效率,比傳統的攪拌混合均一性好,從而在芯片的出口處快速產生均勻的流體。其中的魚骨結構可以是凸起(如圖2所示),也可以是凹陷(如圖3所示),制備效果跟體系有關,其粒徑大小主要跟流速比有關。
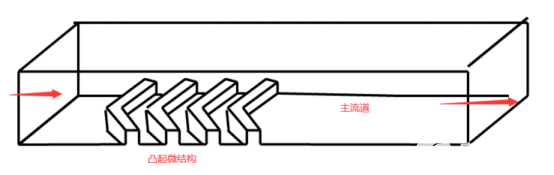
圖2魚骨結構凸起
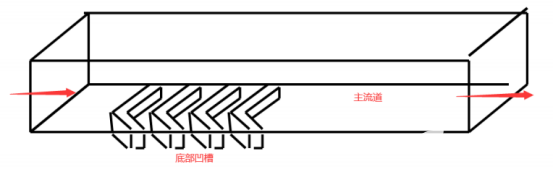
圖3魚骨結構凹陷
目前高校研究所及部分公司客戶尚處在核酸脂質體納米粒LNP的配方開發階段,常選用帶魚骨結構的PDMS芯片進行研究,一方面是因為PDMS材質的芯片加工周期短,成本低,另一方面是因為PDMS芯片的特性使得實驗參數更易獲得。以下3款核酸脂質體納米粒LNP制備微流控芯片是研究者經常使用的。
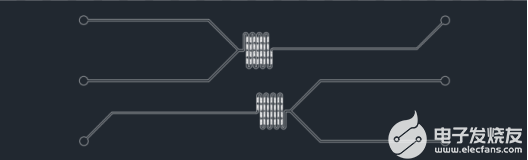
圖4ZX-LS-11核酸脂質體納米粒LNP制備芯片(魚骨結構凸起)
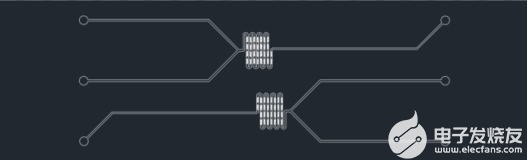
圖5ZX-LS-31核酸脂質體納米粒LNP制備芯片(魚骨結構凹陷)

圖6ZX-LS-31P核酸脂質體納米粒LNP制備芯片(魚骨結構凹陷)

圖7魚骨結構核酸脂質體納米粒LNP制備芯片實物圖(PDMS微流控芯片)
5.制備核酸脂質體納米粒LNP的進樣設備
中芯啟恒恒壓泵(壓力驅動微流體進樣儀)用于生成穩定無脈沖的液流,其響應時間短,適用于各種要求苛刻的微流體應用。壓力控制器由計算機通過USB接口控制,使用中芯啟恒FluidicLab Suite軟件,可以生成復雜的壓力或流速曲線(如正弦波,方波,三角波等)。配套的中芯啟恒FluidicLab Suite軟件可記錄并輸出壓力控制器產生的數據。

圖8中芯啟恒恒壓泵連接示意圖
將壓力控制器1通道與4 mm PU管一端連接,然后把連接儲液池的PTFE管與流量傳感器的“in”接口相連,流量傳感器的另一端“out”連接PTFE管作為液體輸出口,最終組裝出設備如圖1所示。其余3個通道的連接與之相同。進樣原理是:以氣推液,氣體管在儲液池頁面以上,出液管在儲液池液面以下,氣體擠壓液面,將液體從出液管擠出,實現進樣操作。
5.1 恒壓泵(壓力驅動微流體進樣儀)特點:
壓力輸出波動小于0.02%,響應時間9 ms,無論恒流輸出還是變流速輸出,均可應對自如。
卓越的性能:
1)內置壓力傳感器,高速PID控制,壓力輸出波動:< 0.02%
2)響應時間:< 9 ms
3)可安裝四個獨立的壓力輸出通道多種壓力輸出范圍(0-0.2 bar,0-2 bar, 0-8 bar, -1-1 bar, -1-6 bar),并可根據客戶要求定制
4)可設置恒流輸出(需接流量傳感器)和壓力波形輸出
5.2 壓力控制器軟件的使用:
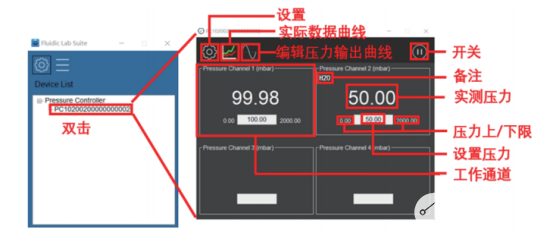
圖9中芯啟恒恒壓泵壓力控制窗口
如圖9所示,可以直接設置各通道的壓力參數,每個通道的壓力參數可以設置不同。
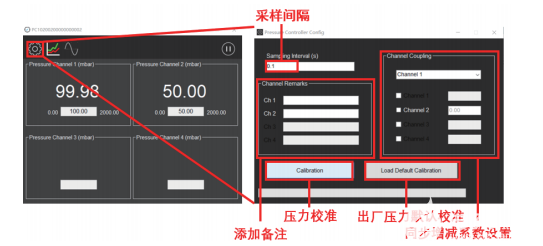
圖10中芯啟恒恒壓泵壓力控制設置窗口
如圖10所示,用戶可以設置實時壓力的讀取間隔,其最低設定值為0.001s (實測讀取時最短讀取周期約為0.02 s,低于此間隔的數據是重復的)。備注信息,壓力校準和同步增減系數設置(多路壓力協同輸出)也可以在此操作。
6.制備的核酸脂質體納米粒LNP的粒徑范圍
如圖11所示,利用帶魚骨結構的微流控芯片制備的核酸脂質體納米粒LNP平均粒徑在142nm左右。
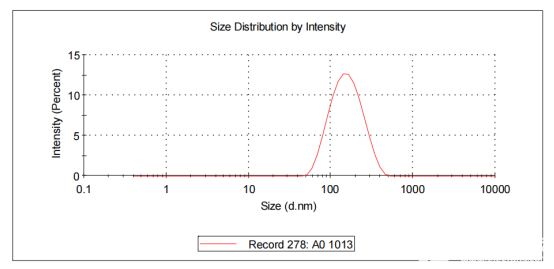
圖11制備的核酸脂質體納米粒LNP的粒徑范圍
審核編輯:湯梓紅
-
芯片
+關注
關注
455文章
50732瀏覽量
423262 -
納米
+關注
關注
2文章
696瀏覽量
36980
發布評論請先 登錄
相關推薦
Aigtek功率放大器如何幫助制備(1~100nm)級的納米薄膜

不同材料的 EBSD 樣品制備方法

FIB技術在透射樣品制備中的應用

單面磷化銦晶片的制備方法有哪些?
氮化硅薄膜的特性及制備方法

透射電鏡(TEM)樣品制備方法

氮化硅薄膜制備方法及用途

安泰功率放大器在磁性納米粒子血管精細成像方法中的應用
ATA-7010高壓放大器在納米薄膜制備中的作用有哪些
如何利用家庭用具制備石墨烯懸浮液

江西薩瑞微獨家研發【一種LDMOS場效應管及其制備方法】

用光子連接懸浮在真空中的納米粒子,并控制它們之間的相互作用
石墨烯粉體制備方法





 核酸脂質體納米粒LNP的制備方法
核酸脂質體納米粒LNP的制備方法










評論