人類誘導多能干細胞(hiPSC)技術可用于疾病建模和藥物開發,由hiPSC衍生的心肌細胞(hiPSC-CM)形成的心臟組織模型可用于減少和改進藥物開發中動物試驗的使用。但是,使用hiPSC-CM預測藥物安全性和有效性,所要面臨的的關鍵挑戰,一方面在于這些細胞的不成熟,特別是hiPSC-CM表現出的自動節律性(沒有電刺激的自發跳動)以及動作電位特征的不成熟。另一方面在于,物種之間的內在差異削弱了動物模型預測藥物安全性和有效性的能力。
據麥姆斯咨詢報道,為了克服以上問題,近日,加利福尼亞大學伯克利分校(University of California,Berkeley)的研究人員基于微流控技術構建了人類心肌細胞芯片系統——也稱為微生理系統(microphysiological systems,MPS),再現了人類心肌組織微環境的三維(3D)架構,以此來探索心肌細胞的關鍵生理功能。研究發現,通過機械刺激和代謝信號的適當組合,可以促進hiPSC-CM成熟,相關成果發表在Nature Biomedical Engineering。
研究人員首先制作了心臟MPS,以增強多層組織自組裝的一致性。簡而言之,使用兩步光刻法制作芯片,該芯片由以下部分組成:(1)一個細胞裝載端口,通向一個帶有兩個大“錨定柱”和幾個較小微柱的細胞培養室;(2)一個培養基裝載端口,通向沿著細胞培養室周圍運行的培養基通道。培養基通道和細胞培養室(高50μm)通過一系列窗孔(2μm高×2μm寬)連接,這些窗孔在特定的體積流量下提供對流的屏障,以便所有培養基中的因子通過擴散到達培養室中的細胞。其中,心臟MPS的制作利用PDMS模具復制法(使用Dow Chemical生產的Sylgard 184套件,即Sylgard基本組分與交聯劑按照10:1 比例混合),并使用氧等離子體對PDMS和玻璃基底進行鍵合。
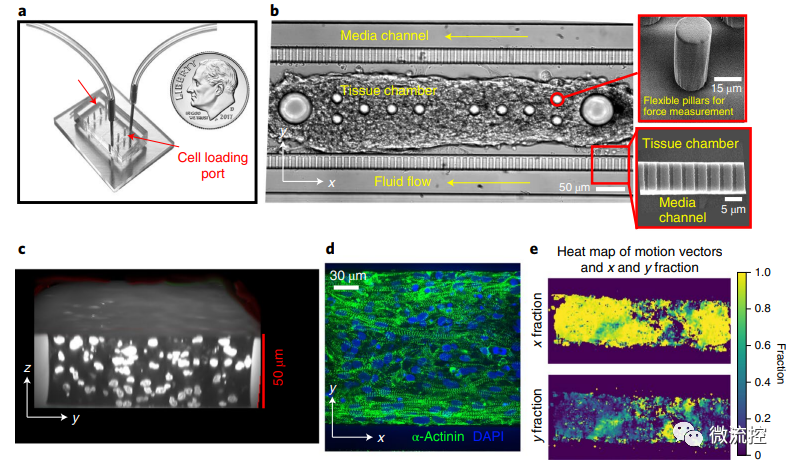
hiPSC-CM芯片的構建和表征
已有的研究表明心臟代謝相關基因表達的患者間差異很大,這些差異反映在患者來源的hiPSC-CM的轉錄組中。因此,研究人員在標記為野生C型(WTC)的細胞體系中測試了成熟培養基(MM)的影響。通過相關實驗,研究人員確定了與標準培養基(SM)相比,基于脂肪酸的MM可導致更成熟的線粒體表型,并改善MPS中的鈣處理。
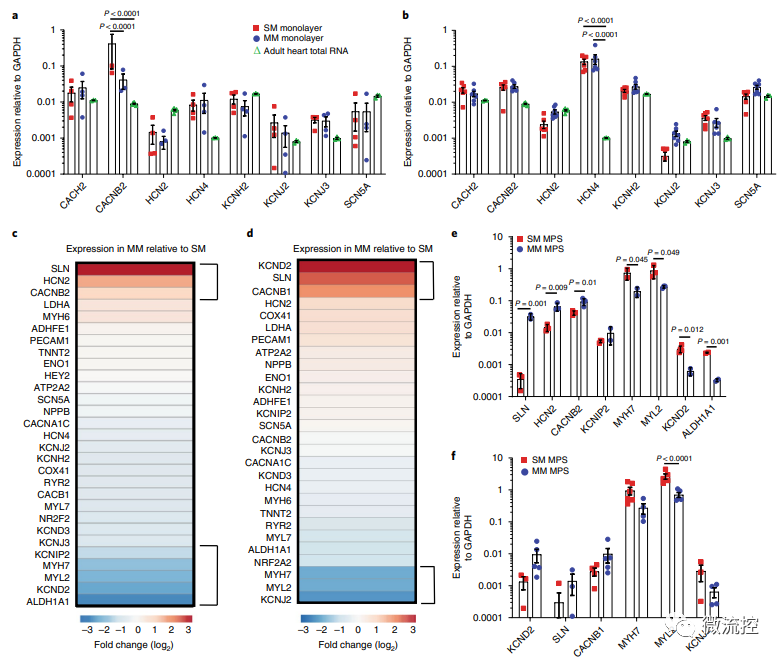
基于脂肪酸的MM處理后的單層細胞和MPS的基因表達分析
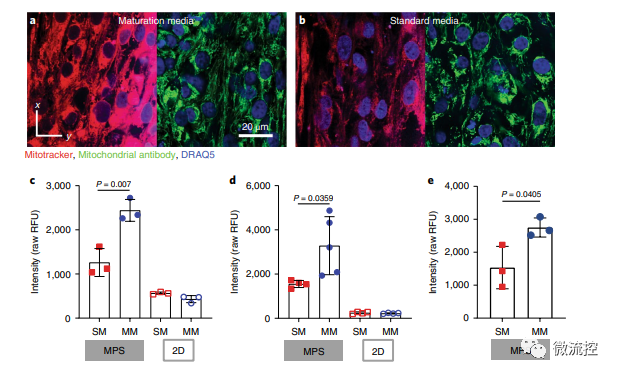
MM處理后的MPS的線粒體形態
除此之外,研究人員還觀察到培養基對動作電位時程(action-potential duration,APD)不同細胞來源的依賴性影響。具體而言,在成熟培養基情況下,APD異常延長的組織,表現出較短的APD,而APD異常短的組織,表現出延長的APD。無論細胞來源如何,組織成熟都降低了自發搏動率和APD的變異性,并導致細胞表型趨同(APD在300-450ms范圍內,這是人類左心室心肌細胞特征),從而可以改進致心律失常藥物的藥效模型。
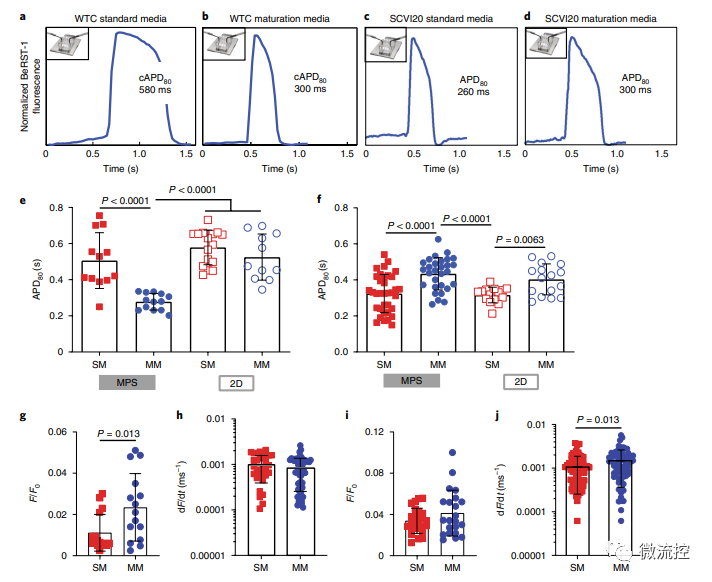
成熟心臟MPS的動作電位表征
為了了解hiPSC-CM對介質的不同反應,我們使用預測計算模型來確定特定電流、通量和鈣處理機制對觀察到的對動作電位和鈣瞬變的變化的貢獻。模型預測,不同基因型的未成熟MPS之間的個體電流不同。MM治療導致了一組對離子電流和鈣處理參數的趨同適應,并且MM引起的模擬電流變化與MM和SM對比所表現的藥理學變化一致。這些結果表明,SM的糖酵解環境可能會放大來自不同品系的hiPSC-CM在動作電位和鈣處理方面的差異。基于脂肪酸的MM可以減少這些差異,同時還可以減少來自同一患者細胞的樣品內變異性,以便進行更具預測性的藥物測試。
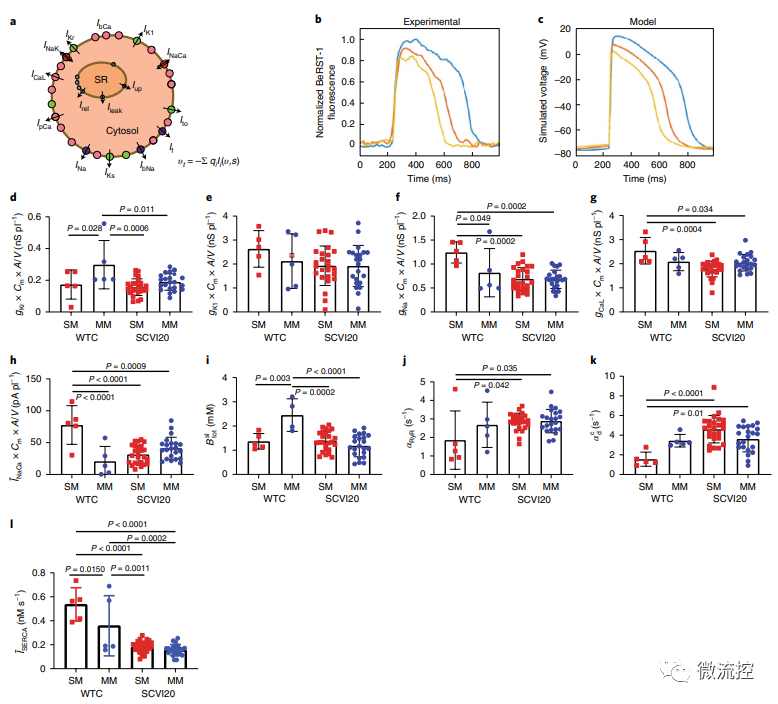
電流和鈣處理機制對單層細胞和MPS動作電位貢獻的數學模型
論文鏈接:
https://doi.org/10.1038/s41551-022-00884-4
審核編輯 :李倩
-
芯片
+關注
關注
456文章
51075瀏覽量
425861 -
微流控
+關注
關注
16文章
539瀏覽量
18935
原文標題:基于微流控的心肌細胞芯片系統,可用于疾病建模和藥物開發
文章出處:【微信號:Micro-Fluidics,微信公眾號:微流控】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
研究人員采用3D打印出一個厘米級的人體心臟泵
1毫升血可“看見”基因表達, “彩虹芯片”為心臟病治療提供新可能
用人類細胞3D打印出了功能正常的厘米級人體心臟肌泵模型
一款模擬心臟心肌搏動和毛細血管屏障功能的心臟芯片
基于GaN光學芯片的高度集成、微型化、低成本光學顯微傳感系統
一種可分離的治療性微針(MN)貼片介紹
高壓功率放大器磁場促心肌組織成熟化的實現中的應用

功率放大器在磁場促心肌組織成熟化的實現中的應用

功率放大器在磁場促心肌組織成熟化的實現中的應用

心肌細胞搏動時鈣離子濃度的變化與細胞收縮在時間上的先后分析
三星計劃推出4億像素傳感器,報告稱全球前十芯片公司今年投資下降 16%





 基于微流控技術構建了人類心肌細胞芯片系統
基于微流控技術構建了人類心肌細胞芯片系統










評論