骨組織工程克服了臨床上骨缺損治療方法的局限性,其中干細(xì)胞作為組織工程的重要組成部分受到越來越多的關(guān)注。盡管干細(xì)胞治療已成為一種很有前途的臨床方法,但將干細(xì)胞直接注射到靶組織可能會導(dǎo)致細(xì)胞存活率、保留率和植入率降低,這極大地限制了干細(xì)胞治療的實際應(yīng)用。細(xì)胞輸送系統(tǒng)的開發(fā)有望克服上述限制。
南京大學(xué)附屬鼓樓醫(yī)院、東南大學(xué)的趙遠(yuǎn)錦教授利用全水相微流控電噴霧技術(shù)開發(fā)了一種新型的生物質(zhì)核殼微囊,其中含有干細(xì)胞核心以及由纖維素納米晶體(CNC)和海藻酸鹽(ALG)組成的生物質(zhì)殼。所設(shè)計的核殼微囊在培養(yǎng)過程中顯示出較高的細(xì)胞活力。動物實驗表明,含干細(xì)胞的核殼微囊具有良好的生物相容性和骨缺損治療效果,在組織工程和再生醫(yī)學(xué)領(lǐng)域具有廣闊的應(yīng)用前景。相關(guān)研究成果以“Biomass Microcapsules with Stem Cell Encapsulation for Bone Repair”為題發(fā)表在Nano-Micro Letters上。
首先,研究人員對干細(xì)胞包埋核殼微囊進(jìn)行了制備。干細(xì)胞(骨髓間充質(zhì)干細(xì)胞,BMSC)微囊由雙乳液毛細(xì)管微流控電噴霧裝置產(chǎn)生,如圖1a所示。通過光學(xué)顯微鏡(圖3a)和掃描電子顯微鏡(圖2b-e)對干細(xì)胞微囊進(jìn)行了表征。由于添加了CNC,微囊呈球形,表面粗糙,空隙小(圖2a,e)。
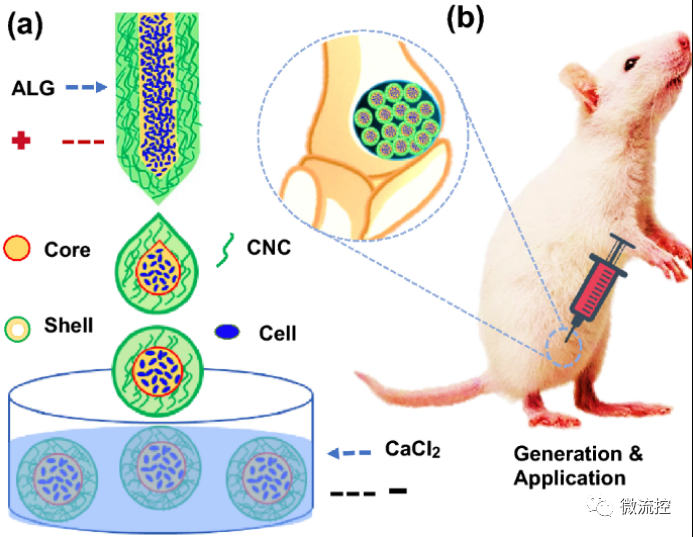
圖1 載干細(xì)胞微囊的產(chǎn)生和應(yīng)用示意圖
a)微流控電噴霧制備微囊的過程;b)用于骨修復(fù)的核殼微囊示意圖。
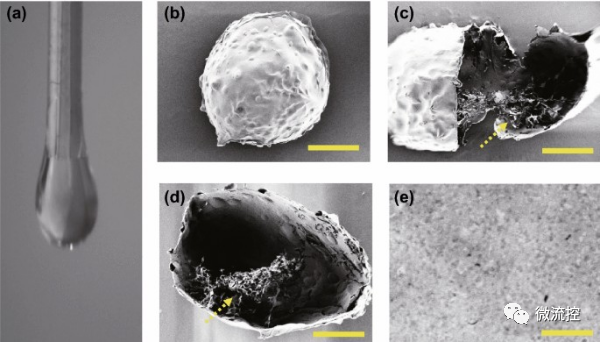
圖2 載干細(xì)胞的核殼微囊的制備
a)微囊微流控電噴霧過程的實時圖像;b-e)微囊(b)、干細(xì)胞微囊內(nèi)部(c)、微囊內(nèi)的干細(xì)胞(d)以及微囊表面(e)的放大圖的掃描電子顯微鏡圖像,黃色箭頭表示微囊中的細(xì)胞,(b、c和d)中的標(biāo)尺為100μm,(e)中的標(biāo)尺為10μm。
接著,研究人員對微囊尺寸的影響因素進(jìn)行了驗證。生成的微囊具有很好的均一性,尺寸大小為351.1±16.3μm,其中核心直徑為293±12.8μm,符合標(biāo)準(zhǔn)尺寸分布(圖3a,b)。研究發(fā)現(xiàn),影響微囊大小的因素包括脈沖電場電壓、收集距離和生物質(zhì)溶液的濃度。生物質(zhì)濃度和收集距離與微囊的直徑呈正相關(guān)。而微囊的直徑大小隨著電壓的增大而減小。內(nèi)相流速的增加導(dǎo)致核心直徑的增加和外殼厚度的減少,以及整個微囊直徑的略微增加(圖3c)。同時,增加外相流速可以增大微囊的直徑和外殼厚度,同時減小核心直徑(圖3d)。
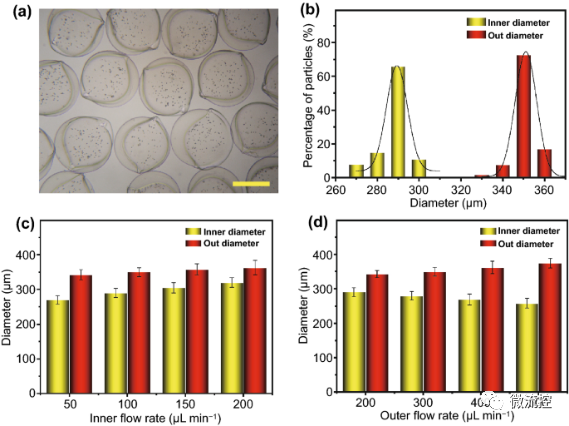
圖3 控制微囊大小的因素
a,b)微囊的形態(tài)(a)和尺寸分布(b);c,d)內(nèi)相(c)和外相(d)流速與微囊尺寸的關(guān)系,標(biāo)尺為200μm。
隨后,研究人員進(jìn)行了細(xì)胞增殖和生物相容性試驗。生物質(zhì)微囊使細(xì)胞在1-7天培養(yǎng)期間快速生長(圖4)。當(dāng)生物質(zhì)殼的濃度增加時,微囊中BMSCs的DNA數(shù)量減少,表明了細(xì)胞增殖減少(圖4a)。基于機(jī)械強(qiáng)度和細(xì)胞增殖之間的平衡,選擇2%的生物質(zhì)用于以下實驗。研究發(fā)現(xiàn),隨著培養(yǎng)時間的延長,細(xì)胞開始分散,然后聚集成細(xì)胞聚集體(圖4b)。這可以歸因于微囊的生物功能化和水凝膠的化學(xué)基團(tuán)有助于細(xì)胞生長、粘附和遷移到水凝膠微囊。成骨細(xì)胞是骨組織的主要體細(xì)胞,BMSC是骨組織的主要干細(xì)胞。因此,將成骨前細(xì)胞系MC3T3-E1(圖4c)和原代干細(xì)胞BMSC(圖4d)用于體外成骨細(xì)胞和干細(xì)胞的生物相容性試驗。結(jié)果表明,培養(yǎng)3天后,前成骨細(xì)胞和干細(xì)胞數(shù)量增加,不同組(包括對照組、膠囊組和膠囊BMSC組)之間沒有明顯差異(圖4c,d)。同時,H&E染色研究發(fā)現(xiàn),心、肝、脾、肺、腎等主要臟器未見明顯異常。說明了水凝膠微囊在體內(nèi)外均具有良好的生物相容性。此外,成骨分化能力的研究以及基因表達(dá)顯示,微囊可以在體外支持BMSC生長和成骨分化。
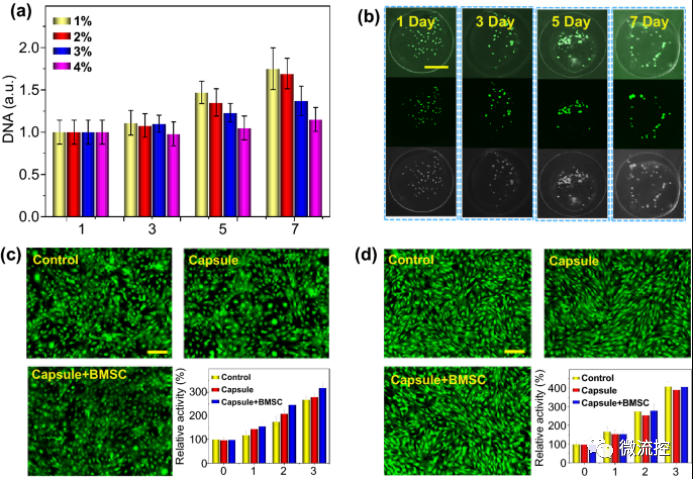
圖4 體外細(xì)胞增殖和生物相容性試驗
a)在不同濃度的生物質(zhì)微囊中觀察細(xì)胞增殖;b)分別觀察微囊培養(yǎng)1-7天后細(xì)胞的形態(tài)學(xué)變化,比例尺為100μm;c)與MC3T3-E1共培養(yǎng)3天后進(jìn)行生物相容性測試,比例尺為50μm;d)與BMSC共培養(yǎng)3天后進(jìn)行生物相容性測試,比例尺為50μm。
接著,研究人員進(jìn)一步進(jìn)行了骨修復(fù)的形態(tài)學(xué)分析。在進(jìn)行動物實驗之前,首先研究了微囊的體外干細(xì)胞釋放能力。研究發(fā)現(xiàn),在生理鹽水溶液中培養(yǎng)4周后,BMSC從微囊中完全釋放。體內(nèi)分布研究發(fā)現(xiàn),微囊具有很好的骨損傷區(qū)域的靶向性。微計算機(jī)斷層掃描(micro-CT)顯示,與未加載微囊和對照組相比,微囊-BMSC治療組顯著地促進(jìn)了骨再生(圖5a,c)。同時,H&E染色結(jié)果顯示微囊-BMSC治療具有更大的新骨體積和面積,增加骨小梁密度,并加速骨再生(圖5b,c)。此外,BMSC、微囊和微囊-BMSC組的骨密度(BMD)高于對照組(圖5e)。這些結(jié)果表明,只有BMSC和微球具有基線成骨效果,并且含有BMSC的微球具有最好的骨再生能力。微球的基本成骨作用可能歸因于其天然的生物活性和生物相容性支架,這有利于內(nèi)源性干細(xì)胞的遷移和增殖。
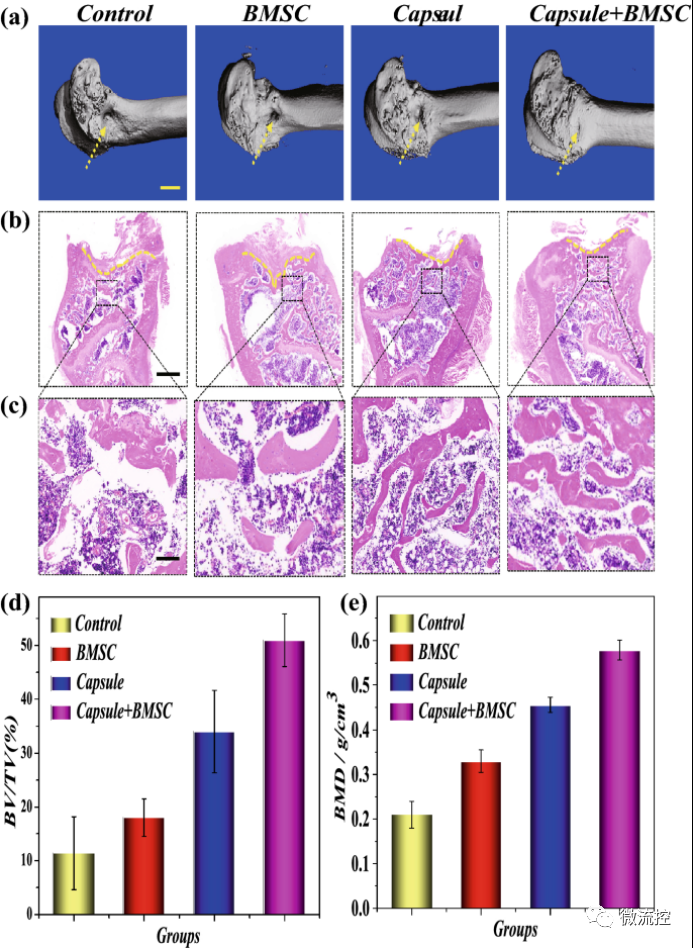
圖5 a)顯微CT重建圖像,不同組(對照組、微囊組和微囊BMSC組)的BV/TV(骨體積)/總體積和BMD;b,c)H&E染色;d,e)定量統(tǒng)計,比例尺分別為5mm(a)、1mm(b)和200μm(c)。
最后,為了進(jìn)一步描述骨再生過程,研究人員通過免疫熒光檢測了不同組中OPN和OCN的表達(dá)水平(圖6)。免疫熒光結(jié)果顯示,微囊-BMSC組中OPN(綠色)和OCN(紅色)的熒光強(qiáng)度顯著高于對照組、BMSC和微囊組,表明微囊-BMSC可以通過促進(jìn)OCN和OPN的表達(dá)有效地加速骨再生(圖6a-c)。此外,與對照組相比,微囊組和BMSC組的OPN和OCN表達(dá)明顯增強(qiáng),表明BMSC和生物質(zhì)微囊具有基線成骨效應(yīng)(圖6a-c)。這些結(jié)果表明,BMSC、微囊和微囊-BMSC可以通過增加OPN和OCN的表達(dá)促進(jìn)骨修復(fù),與micro-CT和H&E結(jié)果一致。
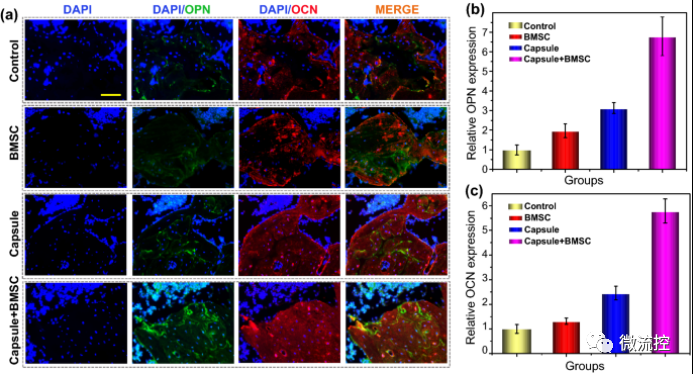
圖6 成骨蛋白在不同組中的表達(dá)
a)不同組中有代表性的OPN(骨橋蛋白)和OCN(骨鈣素)染色;b)不同組中OPN的相對表達(dá);c)OCN在不同組中的相對表達(dá),標(biāo)尺為50μm。
論文鏈接:
https://doi.org/10.1007/s40820-021-00747-8
審核編輯 :李倩
-
晶體
+關(guān)注
關(guān)注
2文章
1390瀏覽量
36295 -
微流控
+關(guān)注
關(guān)注
16文章
582瀏覽量
19879
原文標(biāo)題:利用微流控電噴霧技術(shù)制備生物質(zhì)核殼微囊,可用于骨修復(fù)
文章出處:【微信號:Micro-Fluidics,微信公眾號:微流控】歡迎添加關(guān)注!文章轉(zhuǎn)載請注明出處。
發(fā)布評論請先 登錄
微雙重驅(qū)動的新型直線電機(jī)研究
寬調(diào)速范圍低轉(zhuǎn)矩脈動的一種新型內(nèi)置式永磁同步電機(jī)的設(shè)計與分析
一種新型直流電機(jī)控制器
一種新型半導(dǎo)體光放大器設(shè)計(1)

一種新型的非晶態(tài)NbP半金屬薄膜

一種適用于DC微電網(wǎng)的低輸入電流紋波非隔離TCM雙向變流器
微流控技術(shù)的生物學(xué)應(yīng)用
金融界:江西萬年芯取得一種超高真空微腔體專利

高通量生物分析技術(shù)之微流控芯片
熒光檢測器用來檢測什么物質(zhì)
一種新型全光學(xué)智能光譜儀





















評論