循環(huán)腫瘤細(xì)胞(CTCs)存在于癌癥患者外周血中,對癌癥的早期診斷和預(yù)后評(píng)估具有十分重要的臨床應(yīng)用價(jià)值。然而,CTCs在外周血中數(shù)量極少且具有異質(zhì)性,從血液中檢測及分離CTCs相當(dāng)困難。傳統(tǒng)的CTCs分選技術(shù)包括密度梯度離心分選、免疫磁珠分選、介電泳分選等,這些方法操作步驟復(fù)雜,捕獲效率和純度低,捕獲后的細(xì)胞難以釋放且易損傷,不利于后續(xù)分析。
目前CTCs分析的金標(biāo)準(zhǔn)是美國食品和藥物管理局(FDA)批準(zhǔn)的Cell Search系統(tǒng),可檢測轉(zhuǎn)移性乳腺癌、前列腺癌和直腸癌患者血液中的CTCs。但該系統(tǒng)的分離純度極低,只有0.5%,且通過該系統(tǒng)只能對CTCs計(jì)數(shù),不能捕獲和釋放后再分析,在我國已經(jīng)停用。因此,迫切需要發(fā)展新材料、新技術(shù)以實(shí)現(xiàn)CTCs的檢測和分離,且具有高捕獲效率、高特異性及高通量。
據(jù)麥姆斯咨詢報(bào)道,近日,中國科學(xué)院微系統(tǒng)與信息技術(shù)研究所超導(dǎo)電子學(xué)實(shí)驗(yàn)室宓現(xiàn)強(qiáng)課題組將aptamer觸發(fā)的HCR反應(yīng)(apt-HCR)、魚骨型微流控芯片(HB-chip)與氨基修飾的四面體框架核酸(Tetrahedral DNA framework, TDFs)相結(jié)合,構(gòu)建了一種CTCs分選微流控系統(tǒng)(T-μFDS)。
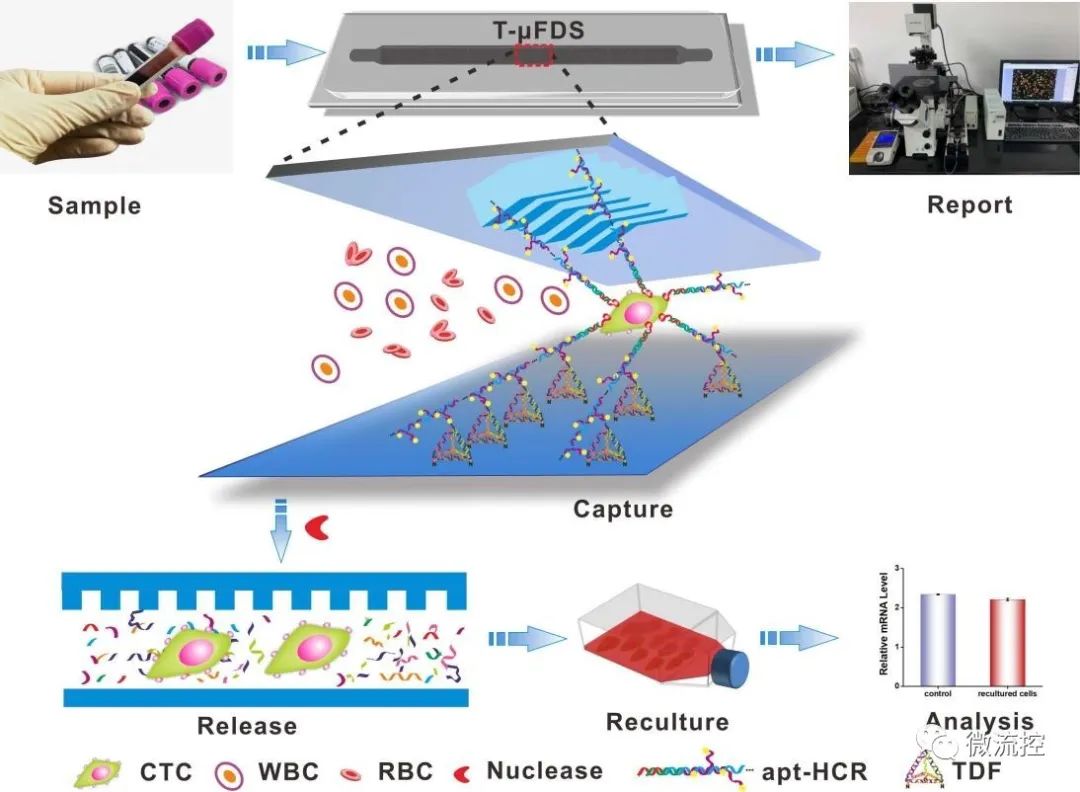
TDFs不僅可以作為三維支架以醛基-氨基共價(jià)結(jié)合的方式固定于玻璃基底上,其頂端探針還可與apt-HCR中的多分支鏈雜交,最終實(shí)現(xiàn)CTCs多價(jià)捕獲。由于TDF、HCR和aptamer均是DNA分子,可以利用核酸酶消化,實(shí)現(xiàn)CTCs無損傷釋放。當(dāng)靶細(xì)胞(MCF-7)數(shù)量為10-10?時(shí),該系統(tǒng)捕獲效率為80.0%-97.4%,捕獲純度為92.0%-96.7%,對MCF-7細(xì)胞的釋放效率為96.2%,MCF-7細(xì)胞在被捕獲前和釋放后的存活率分別為97.5%和94.6%。該系統(tǒng)具有捕獲效率高、捕獲純度高、釋放效率高和細(xì)胞活力維持能力強(qiáng)的巨大優(yōu)勢。結(jié)合微流控芯片技術(shù),該系統(tǒng)有望實(shí)現(xiàn)整體自動(dòng)檢測和分離CTCs。
相關(guān)論文“Designer Tetrahedral DNA Framework-Based Microfluidic Technology for Multivalent Capture and Release of Circulating Tumor Cells”發(fā)表于國際知名期刊Materials Today Bio(授權(quán)發(fā)明專利201910646213.4)。該論文的第一通訊單位為中科院上海微系統(tǒng)所,通訊作者為上海微系統(tǒng)所宓現(xiàn)強(qiáng)研究員。

論文鏈接:
https://doi.org/10.1016/j.mtbio.2022.100346
審核編輯 :李倩
-
芯片
+關(guān)注
關(guān)注
456文章
50950瀏覽量
424718 -
微流控
+關(guān)注
關(guān)注
16文章
535瀏覽量
18914
原文標(biāo)題:基于微流控技術(shù)的循環(huán)腫瘤細(xì)胞分選系統(tǒng)
文章出處:【微信號(hào):Micro-Fluidics,微信公眾號(hào):微流控】歡迎添加關(guān)注!文章轉(zhuǎn)載請注明出處。
發(fā)布評(píng)論請先 登錄
相關(guān)推薦
用于微液滴的連續(xù)流動(dòng)洗滌微流控系統(tǒng)
常用的微流控芯片類型
S型微流控芯片的優(yōu)勢
常見的機(jī)械分選方法有哪些
COC/COP微流控芯片開發(fā)與應(yīng)用
寬帶功率放大器基于微流控技術(shù)的細(xì)胞分選的應(yīng)用
玻璃微流控芯片前景分析
基于一種AI輔助可穿戴微流控比色傳感器系統(tǒng)
一種基于微流控限域合成的多孔納噴霧電噴針制造

介紹一種用于絕對定量的微腔式數(shù)字PCR微流控芯片
安泰ATA-7050高壓放大器在微流控細(xì)胞分選中的應(yīng)用
淺談微流控芯片技術(shù)

基于雙極性電極的微流控芯片,用于生物顆粒和細(xì)胞分選




 一種CTCs分選微流控系統(tǒng)
一種CTCs分選微流控系統(tǒng)










評(píng)論