腫瘤干細(xì)胞(CSCs)是癌癥復(fù)發(fā)、惡化和無效治療的主要原因之一。免疫檢查點(diǎn)療法是目前腫瘤治療中潛力較大的一種治療策略,如抗程序性死亡-1抗體(aPD-1)的免疫治療已經(jīng)在多種腫瘤治療中發(fā)揮抑瘤的作用。但是,整體的治療效果往往受到CSCs免疫逃避的限制。抗CSCs的治療將有助于提升癌癥的整體治療效果,改善目前臨床中免疫檢查點(diǎn)療法的局限。
基于此,廣州醫(yī)科大學(xué)謝茂彬教授團(tuán)隊(duì)研制了一種集協(xié)同免疫和氫治療于一體的可穿戴絲質(zhì)微針裝置(SMND),由雙層MN貼片(DLMNP)組成,以載aPD-1的絲素蛋白(SF)為內(nèi)基質(zhì),以載氨硼烷的介孔二氧化硅納米顆粒(AB-MSN)包覆聚己內(nèi)酯為外熱響應(yīng)涂層進(jìn)行H?釋放。結(jié)果顯示該協(xié)同治療策略可實(shí)現(xiàn)令人滿意的抗腫瘤和抗CSCs療效,同時(shí)全身毒性最小。相關(guān)工作以“A Smart Silk-Based Microneedle for Cancer Stem Cell Synergistic Immunity/Hydrogen Therapy”為題于2022年7月18日發(fā)表在Advanced Functional Materials期刊。
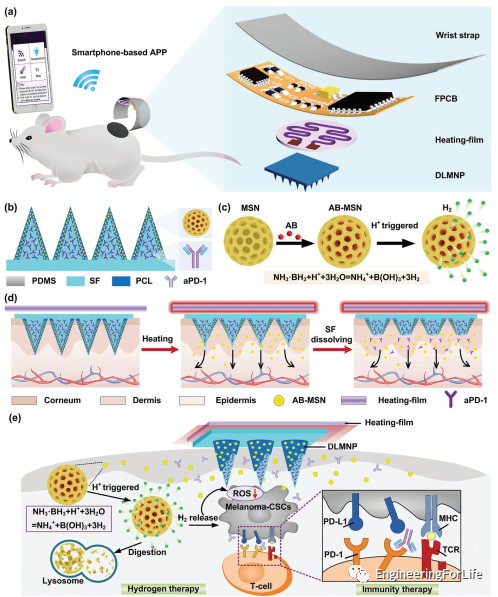
圖1 SMND制備與智能給藥原理圖。a)無線連接SMND經(jīng)皮給藥小鼠黑色素瘤模型示意圖。b)負(fù)載雙藥的DLMNP的結(jié)構(gòu)。c)AB-MSN的制備方法示意圖及酸觸發(fā)分解和H?釋放機(jī)理。d)智能手機(jī)控制SMND的智能熱響應(yīng)藥物釋放示意圖。e)SMND抗CSCs協(xié)同免疫/氫治療機(jī)制示意圖。
研究人員開發(fā)的SMND體積小巧、重量輕,由于其可彎曲性和手腕帶的靈活性,可以包裹在患者的手腕上。加熱膜與FPCB電連接,粘在DLMNP背面。FPCB尺寸為50mm × 25mm,重量較輕,只有24g。此外,SMND的加熱膜是微型的,直徑為10mm,厚度為0.5mm。采用微成型技術(shù)在PDMS母模上制備了該貼片的DLMNP。光學(xué)顯微鏡表征了DLMNP的結(jié)構(gòu)和形態(tài)。每個(gè)金字塔MN都整齊地排列成15 × 15方陣,中心距離為1500μm。每個(gè)MN的平均高度為600μm,頂端直徑為20μm,底部直徑為200μm。羅丹明6G作為模型藥物,包裹在DLMNP中。結(jié)果表明,羅丹明6G可以在MN中均勻荷載。使用定制開發(fā)的智能手機(jī)APP進(jìn)行SMND在實(shí)際應(yīng)用場(chǎng)景下的調(diào)試。首先點(diǎn)擊APP圖標(biāo)進(jìn)入APP界面。整個(gè)界面分為搜索藍(lán)牙按鈕、加熱按鈕、停止加熱按鈕三個(gè)功能按鈕,以及藍(lán)牙信息顯示窗口和實(shí)時(shí)溫度顯示窗口兩個(gè)顯示窗口。然后,點(diǎn)擊SEARCH面板,找到目標(biāo)藍(lán)牙BT16。最后,在藍(lán)牙信息顯示窗口點(diǎn)擊BT16,即可成功連接智能手機(jī)與FPCB的藍(lán)牙連接。同時(shí),F(xiàn)PCB中的紅燈會(huì)亮起來,表示連接成功。然后點(diǎn)擊HEAT面板,觸發(fā)加熱膜的加熱功能。同時(shí),可以實(shí)時(shí)顯示溫度,并伴有燈圖標(biāo)的顏色變化。一旦溫度達(dá)到50攝氏度,它就會(huì)保持這個(gè)溫度。點(diǎn)擊STOP按鈕后,溫度會(huì)逐漸下降。因此,可以通過APP指令HEAT/STOP啟動(dòng)熱膜熱驅(qū)動(dòng)和熱控制。

圖2 SMND的電子和物理結(jié)構(gòu)。a)腕帶下SMND與FPCB組裝的光學(xué)圖像。b)FPCB上詳細(xì)塊電路的光學(xué)圖像。c)與FPCB電連接的柔性加熱膜的光學(xué)圖像。d)DLMNP的數(shù)碼照片。e)羅丹明6G染色DLMNP及其平臺(tái)的數(shù)字顯微鏡圖像(f)和側(cè)視圖(g)。h)定制智能手機(jī)APP加熱控制和數(shù)據(jù)顯示的實(shí)時(shí)操作:(步驟1)點(diǎn)擊桌面圖標(biāo)進(jìn)入APP;(步驟2)點(diǎn)擊SEARCH面板查找目標(biāo)藍(lán)牙名稱;(步驟3)選擇目標(biāo)藍(lán)牙BT16進(jìn)行連接;(步驟4)點(diǎn)擊所述HEAT面板,對(duì)所述柔性電路進(jìn)行加熱控制;(步驟5)點(diǎn)擊停止面板,停止加熱。
DLMNP由SF基內(nèi)層MN和PCL基外層組成。DLMNP的表面是白色的,而不是像內(nèi)部SF MN那樣透明的。在噴涂前后,除表面外觀外,DLMNP的形狀和結(jié)構(gòu)沒有變化。在DLMNP表面觀察到多孔和顆粒形態(tài),同時(shí)內(nèi)SF MN表面相對(duì)光滑。此外,還引入了FITC標(biāo)記的PCL,并將Rhodamine 6G標(biāo)記的SF引入DLMNP制造過程,通過這兩種染料之間的發(fā)射波長(zhǎng)差異來幫助區(qū)分這兩種成分。顯然,在DLMNP的每一根針中都可以觀察到紅色和綠色的熒光,證明了整個(gè)DLMNP中兩種化合物的均勻整合。共聚焦激光掃描顯微鏡(CLSM)圖像顯示了DLMNP的雙層結(jié)構(gòu)。采用乙醇蒸氣后處理來調(diào)節(jié)SF的二級(jí)結(jié)構(gòu),以控制其溶出速率。通過FTIR和X射線衍射(XRD)揭示不同時(shí)間(0、2、4、6和8h)乙醇蒸汽處理SF MN內(nèi)部的構(gòu)象和二級(jí)結(jié)構(gòu)變化。未經(jīng)乙醇蒸汽處理的原始SF MN在1656/cm(酰胺I)、1537/cm(酰胺II)、1250/cm(酰胺III)處的紅外吸收峰相對(duì)較弱,在12.1處有一個(gè)典型的絲I晶體峰,具有典型的無規(guī)則線圈構(gòu)像和主要的非晶結(jié)構(gòu)特征,[26a,29]對(duì)應(yīng)著快速溶解的特征。然而,經(jīng)過乙醇蒸汽后處理的SF MN在1627/cm(酰胺I)、1525/cm(酰胺II)、1526/cm(酰胺II)和1230/cm(酰胺III)處出現(xiàn)了尖銳的吸收峰,以及顯著的典型絲狀I(lǐng)I晶體峰,在XRD中為20.2°、28.0°和30.9°,這是β-薄片構(gòu)像的代表。未處理的SF MN比后處理的SF MN在開始時(shí)的藥物釋放率明顯更高。在28h內(nèi),原始SF MN的累積藥物釋放量達(dá)94.1% ± 4.2%,而8h乙醇蒸汽后處理SF MN的累積釋藥量?jī)H為55.2% ± 3.3%。不同的乙醇蒸汽處理時(shí)間對(duì)SF MN后處理的釋放速率有影響。隨著乙醇蒸汽處理時(shí)間的增加,SF MN后處理藥物釋放速率減慢。力學(xué)試驗(yàn)中DLMNP的穿透力如圖所示,由于豬皮的固有阻力特性,力隨著載荷位移的增加而逐漸增大。隨著插入的進(jìn)行,可以清楚地觀察到P點(diǎn)插入力的一個(gè)小的突然下降。這表明DLMNP壓縮超過了皮膚破裂極限,導(dǎo)致皮膚穿透。因此,DLMNP的穿透力為0.58N,遠(yuǎn)小于破壞力1.78N。此外,對(duì)處理過的豬皮進(jìn)行了觀察,發(fā)現(xiàn)具有類似大小的DLMNP的陣列排列的紅色斑點(diǎn),表明DLMNP確實(shí)在皮膚上產(chǎn)生了微孔。DLMNP擁有aPD-1加載的內(nèi)矩陣和AB-MSN封裝的PCL涂層。制備了熱響應(yīng)的PCL涂層,用于控制H?的釋放。PCL的熱相變特性賦予了DLMNP的熱反應(yīng)性能,可以通過探索封裝aPD-1的釋放來反映。DLMNP加熱15min(50℃),未涂覆MN組在228h內(nèi)累積釋放aPD-1為49.0% ± 2.4%,略高于未加熱的DLMNP組(33.19% ± 1.2%)。相反,加熱組的aPD-1釋放量在初始15min內(nèi)急劇增加,表明PCL在加熱到閾溫度后發(fā)生了由固態(tài)到液態(tài)的相變。考慮到MN加熱導(dǎo)致aPD-1失活的風(fēng)險(xiǎn),研究人員測(cè)試了aPD-1從DLMNP中釋放后的生物活性。據(jù)估計(jì),釋放的aPD-1在4℃下儲(chǔ)存16天后,90%以上的aPD-1仍然具有與PD-1抗原結(jié)合的生物活性。同樣,PCL在DLMNP中的熱相變特性可以通過H?的釋放反映。只有當(dāng)溫度達(dá)到50℃(PCL的相變溫度)時(shí)才能生成H?,這進(jìn)一步說明了DLMNP的熱響應(yīng)能力。
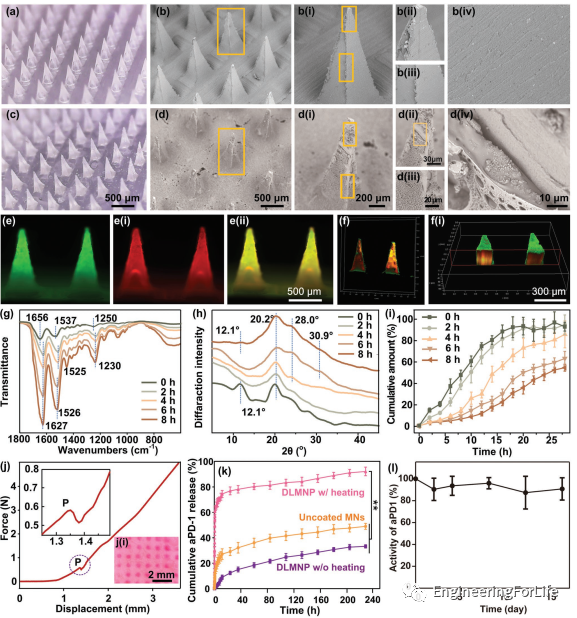
圖3 DLMNP的理化特性。a)未涂PCL的DLMNP的數(shù)字顯微鏡圖像。b)未涂PCL的DLMNP的SEM圖像:b(i)單個(gè)MN;b(ii)MN的上尖端;b(iii)MN的主體;b(iv)MN的表面。c)PCL涂層DLMNP的數(shù)字顯微鏡圖像。d)DLMNP的SEM圖像:d(i)單個(gè)MN;d(ii)MN上尖;d(iii)MN體;d(iv)MN表面。e)DLMNP的熒光圖像:外層包埋FITC(綠色),內(nèi)部MN包埋羅丹明6G(紅色);e(ii)它們的重疊部分(黃色)。f和f(i)不同視圖下DLMNP的三維共焦重建圖像。g-i)不同時(shí)間(0、2、4、6、8h)乙醇蒸氣處理DLMNP內(nèi)SF MN的理化特征:(g)SF MN的FTIR;(h)SF MN的XRD;(i)SF MN的溶解譜。j)DLMNP的機(jī)械穿透曲線和j(i)經(jīng)DLMNP處理的皮膚樣本圖片。k)隨著時(shí)間的推移,在37℃ PBS(pH=7.4)中培養(yǎng)的DLMNP體外積累aPD-1釋放。l)aPD-1從DLMNP釋放后的生物活性。
為了評(píng)價(jià)SMND的體內(nèi)抗癌和抗CSCs效率,研究人員采用B16F10-CSCs荷瘤小鼠模型模擬臨床轉(zhuǎn)移性黑色素瘤。注射aPD-1的小鼠在最初的8天內(nèi)腫瘤生長(zhǎng)延遲,而隨后腫瘤明顯復(fù)發(fā),在AB-MSN組也發(fā)現(xiàn)了類似的趨勢(shì)。DLMNP聯(lián)合AB-MSN組和DLMNP聯(lián)合aPD-1組腫瘤消退作用有限,腫瘤復(fù)發(fā)是由于CSCs的異質(zhì)性導(dǎo)致的免疫耐受所致。相反,經(jīng)aPD-1 + AB-MSN治療的DLMNP小鼠表現(xiàn)出持續(xù)的腫瘤抑制作用,一些腫瘤在治療后甚至消失。14天后,經(jīng)aPD-1 + AB-MSN治療的DLMNP小鼠的腫瘤重量(39.8 ± 21.5mg)遠(yuǎn)小于經(jīng)AB-MSN治療的DLMNP(671.6 ± 24.7mg)和經(jīng)aPD-1治療的DLMNP(601.4 ± 31.7mg)。血紅素和伊紅(H&E)染色圖像顯示,在aPD-1 + AB-MSN的DLMNP治療的動(dòng)物模型的大部分腫瘤區(qū)域出現(xiàn)廣泛的組織病理學(xué)和壞死。結(jié)果表明,免疫治療和氫治療的協(xié)同抗腫瘤作用比單一治療更有效。不同處理后未觀察到明顯的體重、減輕或其他臨床毒性跡象,這表明DLMNP聯(lián)合aPD-1 + AB-MSN治療可能是一種安全的治療策略,具有很大的臨床潛力。為了進(jìn)一步證實(shí)DLMNP在腫瘤部位的持續(xù)釋放aPD-1,研究人員在不同時(shí)間點(diǎn)收集治療過的腫瘤進(jìn)行免疫染色。aPD-1組在給藥日(第0天)腫瘤部位出現(xiàn)較強(qiáng)的抗體信號(hào)。DLMNP傳遞的aPD-1在3天內(nèi)產(chǎn)生連續(xù)信號(hào),具有持續(xù)免疫治療的潛力,并極大地避免了重復(fù)穿刺以保持足夠的藥物濃度。
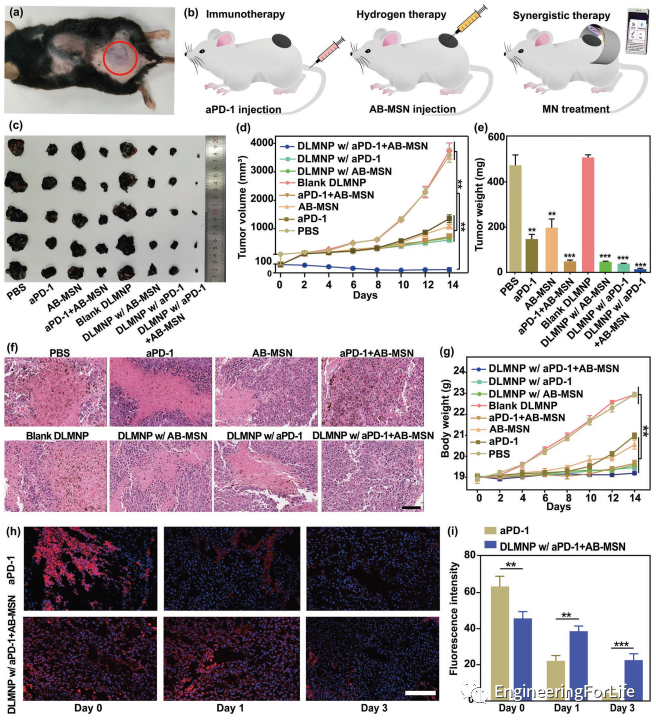
圖4 SMND的體內(nèi)協(xié)同抗癌效率。a)小鼠背側(cè)及相關(guān)皮膚(紅圈內(nèi)區(qū)域)經(jīng)皮注射SMND的DLMNP。b)對(duì)B16F10-CSCs小鼠模型進(jìn)行不同處理的示意圖。c)小鼠治療后腫瘤的代表性照片。d)腫瘤生長(zhǎng)曲線和e)B16-CSCs荷瘤小鼠在治療14天后的腫瘤重量。f)治療14d后切除腫瘤代表性H&E染色圖像。g)B16 CSCs荷瘤小鼠治療14天內(nèi)體重。h)不同時(shí)間點(diǎn)aPD-1處理腫瘤和aPD-1 + AB-MSN處理DLMNP的免疫熒光染色(綠色:aPD-1;藍(lán)色:細(xì)胞核)。i)熒光圖像分析的平均熒光強(qiáng)度。
綜上所述,研究人員開發(fā)了一種可穿戴的蠶絲基微針裝置(SMND),用于智能給藥,并評(píng)估了其協(xié)同免疫和氫治療黑色素瘤CSCs的效果。SMND的雙層MN貼片(DLMNP)不僅可以實(shí)現(xiàn)熱響應(yīng)H?釋放,還可以實(shí)現(xiàn)aPD-1的持續(xù)傳遞,用于免疫治療。這種協(xié)同CSCs治療策略是雙重保險(xiǎn)。首先,H?的熱響應(yīng)釋放阻止了腫瘤細(xì)胞的增殖和遷移。此外,其較強(qiáng)的穿透能力可以消除腫瘤內(nèi)部的CSCs,抑制CSCs的進(jìn)一步分化。其次,aPD-1的持續(xù)釋放阻斷腫瘤免疫逃逸。氫處理后存活的腫瘤細(xì)胞進(jìn)一步被T細(xì)胞捕獲,從而有效避免腫瘤轉(zhuǎn)移和復(fù)發(fā)。最后,患者可以在家通過智能手機(jī)通過SMND的智能電子元件管理給藥過程,避免了醫(yī)護(hù)人員的護(hù)理需求。在B16F10-CSCs小鼠黑色素瘤模型中,協(xié)同治療實(shí)現(xiàn)了令人滿意的抗CSCs效果,同時(shí)全身毒性和副作用最小。
論文鏈接:
https://doi.org/10.1002/adfm.202206406
審核編輯 :李倩
-
貼片
+關(guān)注
關(guān)注
10文章
914瀏覽量
37647 -
微針技術(shù)
+關(guān)注
關(guān)注
2文章
74瀏覽量
8865 -
可穿戴
+關(guān)注
關(guān)注
4文章
772瀏覽量
86101
原文標(biāo)題:用于癌癥干細(xì)胞協(xié)同免疫/氫治療的智能蠶絲微針
文章出處:【微信號(hào):Micro-Fluidics,微信公眾號(hào):微流控】歡迎添加關(guān)注!文章轉(zhuǎn)載請(qǐng)注明出處。
發(fā)布評(píng)論請(qǐng)先 登錄
研究人員開發(fā)出基于NVIDIA技術(shù)的AI模型用于檢測(cè)瘧疾
ATA-2041高壓放大器在超聲微針陣列系統(tǒng)模塊中的應(yīng)用
TRIZ理論解鎖可穿戴設(shè)備新體驗(yàn)!

加州理工學(xué)院:研究一種無創(chuàng)監(jiān)測(cè)女性激素的可穿戴生物傳感器
研究人員利用激光束開創(chuàng)量子計(jì)算新局面

半侵入式"可穿戴診所"——微針技術(shù)的創(chuàng)新應(yīng)用
愛普生開發(fā)了一種烤箱控制的晶體振蕩器,其功耗比傳統(tǒng)OCXOs1低56%

一種新型的硅基亞波長(zhǎng)光柵耦合器設(shè)計(jì)

柔軟可拉伸的新型3D打印材料可改善可穿戴傳感應(yīng)用
研究人員提出一種電磁微鏡驅(qū)動(dòng)系統(tǒng)
研究人員制造可將短波紅外光的頻率“上轉(zhuǎn)換”到可見光頻率范圍裝置
基于一種AI輔助可穿戴微流控比色傳感器系統(tǒng)
#參考設(shè)計(jì)#可穿戴心電圖設(shè)計(jì)方案




















評(píng)論