01
研究背景
將生物質分子(一種可用且豐富的可再生有機碳源)轉化為有價值的有機化學品是減少化學工業碳排放的有效方法。在各種生物質分子中,由C6 糖水解產生的5-羥甲基糠醛 (HMF) 可以被催化還原制備2,5-二羥甲基呋喃 (DHMF),它是生產聚醚、聚氨酯和聚酰胺的重要前驅體。目前,它是由HMF在高壓和高溫下加氫制備的。因此,需要開發在溫和條件下不使用H2將HMF氫化為DHMF的可持續方法。最近的進展表明,電化學驅動是替代加氫過程的一種可持續方式。對于HMF加氫生成DHMF,它可以通過直接電還原途徑進行,其中羰基參與電極處的電子轉移,或者通過表面吸附 H(表示為 H*)進行電催化加氫 (ECH)。然而,HMF加氫活性通常比析氫反應 (HER) 低,導致DHMF的法拉第效率 (FE) 降低。為了克服這個問題,HMF氫化最好在具有高HER過電位的電極上進行,例如Cu和Ag。之前的大多數報告都是基于對低濃度HMF(通常為 20 mM)的研究。高濃度的HMF(》100 mM)通常會導致FE和DHMF的選擇性降低,這是由于嚴重的HMF二聚化。近年來,由位于主體金屬基體中的外來金屬的孤立原子組成的單原子合金(SAA)催化劑引起了較大的關注。除了最大限度地利用單原子的特點外,SAA還表現出獨特的雙金屬協同效應。
02
成果簡介
清華大學段昊泓教授制備的Ru1Cu單原子合金在用于HMF電化學還原中表現出比銅合金更出色的性能,在-0.3 V(vs. RHE)下DHMF的產率為0.47 mmol cm-2h-1,FE為85.6 %。Ru1Cu單原子合金也可以在高濃度下發生HMF二聚反應,DHMF的FE在高濃度(100 mM)時基本保持不變。該工作“Electrocatalytic Hydrogenation of 5-Hydroxymethylfurfural Promoted by a Ru1Cu Single-Atom Alloy Catalyst“為題發表在《Angewandte Chemie International Edition》上。
03
研究亮點
1. 單原子Ru在促進水解離中起著關鍵作用,增加了H*的表面覆蓋率,減少了HMF的羰基覆蓋率;
2. 通過電催化加氫(ECH) 機制獲得了DHMF。
04
圖文導讀
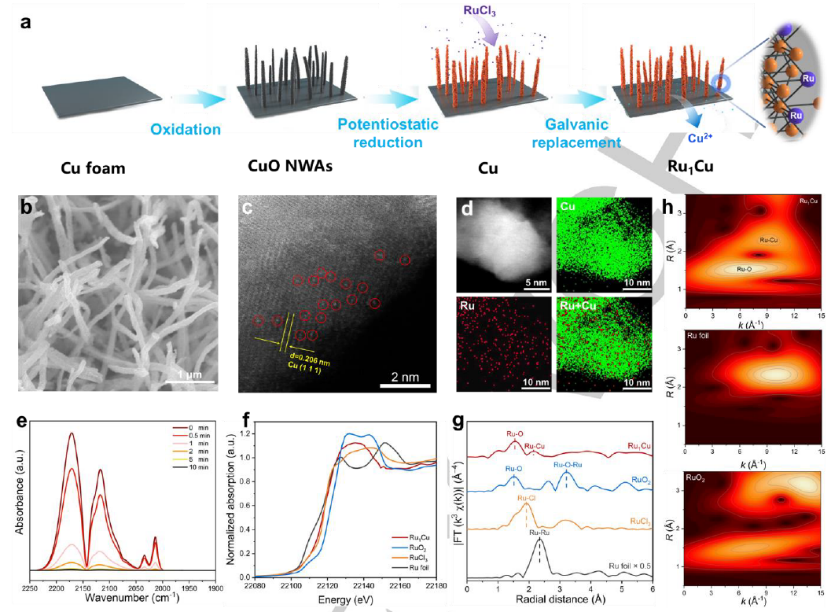
圖 1. (a) Ru1Cu SAA合成示意圖。Ru1Cu SAA的 (b) SEM。(c) RHAADF-STEM,其中紅色圓圈顯示單分散的Ru原子。(d) STEM-EDS映射。(e) 在室溫下用He吹掃的Ru1Cu SAA的CO-DRIFTS光譜。(f) Ru K-edge的XANES 光譜。(g) Ru K-edge的傅里葉變換EXAFS光譜和 (h) Ru箔、RuO2和Ru1Cu SAA的小波變換EXAFS光譜。
合成過程如圖1a 所示。通過在堿性條件下用 (NH4)2S2O8對Cu泡沫進行簡單的化學氧化,然后在空氣中煅燒來制造CuO納米線陣列 (NWA)。通過在電化學系統中在陰極電位下還原母體CuO納米結構,獲得了Cu NWA。然后,通過電流置換法將單原子Ru引入Cu NWAs中,獲得Ru1Cu SAA。SEM(圖 1b)顯示了Ru1Cu的納米線陣列形態,這表明原始的Cu結構被保留。如圖1c所示,HAADF-STEM與EDS相結合顯示了Ru原子在 Cu NWA 中的孤立分散,沒有觀察到Ru簇或納米顆粒。EDS-mapping(圖 1d)證實了 Ru 物種在整個Cu NWA中的存在和均勻分布。通過CO-DRIFTS證實了Ru 在Ru1Cu SAA中的分離(圖 1e)。圖 1f 顯示了Ru1Cu的Ru K邊的X射線吸收近邊光譜 (XANES)。Ru1Cu的吸附邊緣位于Ru箔和RuO2之間,靠近RuCl3,在擴展的 X 射線吸收精細結構光譜(EXAFS,圖 1g)中,1.50 ? 處的Ru1Cu的第一層歸因于Ru-O,2.17 ?歸因于Ru-Cu。圖 1h 中的小波變換 (WT) 進一步證實了 Ru-Cu 散射的存在。Ru-Cu鍵(2.17 ?,9.1 ?-1)存在于Ru1Cu中,明顯不同于Ru箔和RuO2,表明形成了分散在銅納米線上的原子級釕原子。
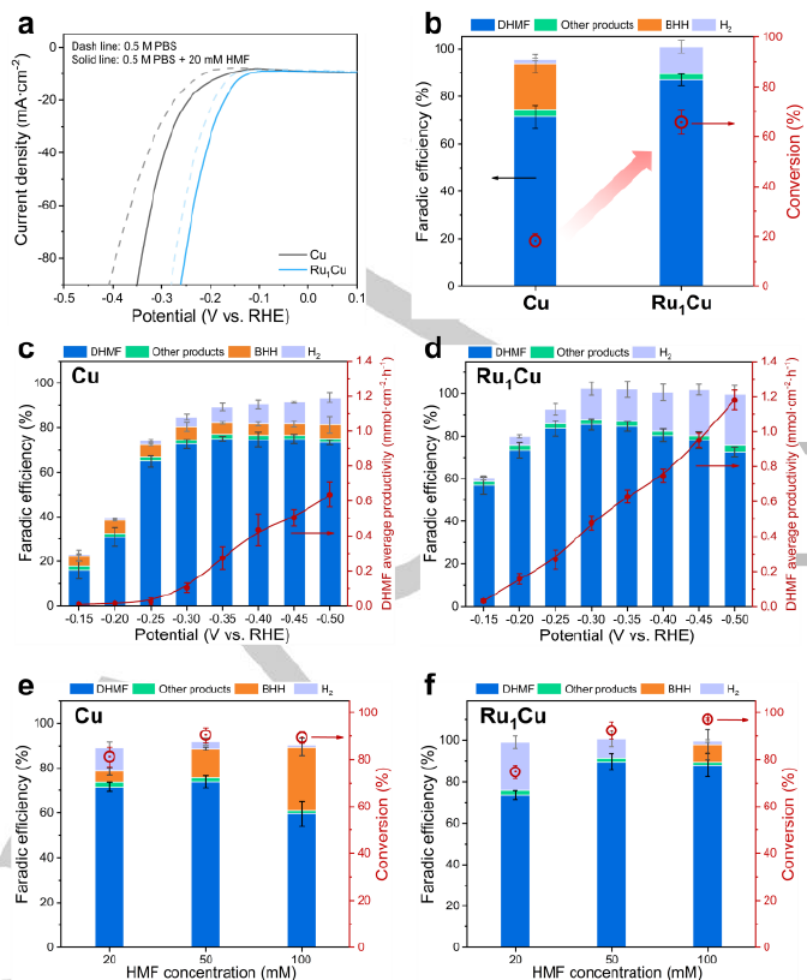
圖 2.Ru1Cu SAA 和Cu的電化學性能。(a) 含和不含20 mM HMF的0.5 M PBS中Cu和Ru1Cu的LSV曲線。(b) Cu和Ru1Cu的產物分布及相應轉化率。DHMF 在 (c) Cu 和 (d) Ru1Cu上的產物分布和生產率。不同濃度的HMF 下,HMF在 (e) Cu 和 (f) Ru1Cu上的產物分布和相應轉化率。
圖2a顯示,添加20 mM HMF后,Ru1Cu SAA和Cu均表現出增強的電流密度,表明HMF的電化學還原比HER更有利。圖2b顯示,Ru1Cu SAA 比Cu表現出更高的轉化率和DHMF的更高FE。如圖 2c-d所示,在不同的電位下,與Cu相比,Ru1Cu SAA顯示出更高的DHMF生產率和FE。Cu在HMF 濃度增加時顯示DHMF的FE降低(圖 2e),這主要是由于BHH的形成。相比之下,Ru1C在高HMF濃度下顯示抑制HMF二聚化(圖2f),導致DHMF 的FE更高。
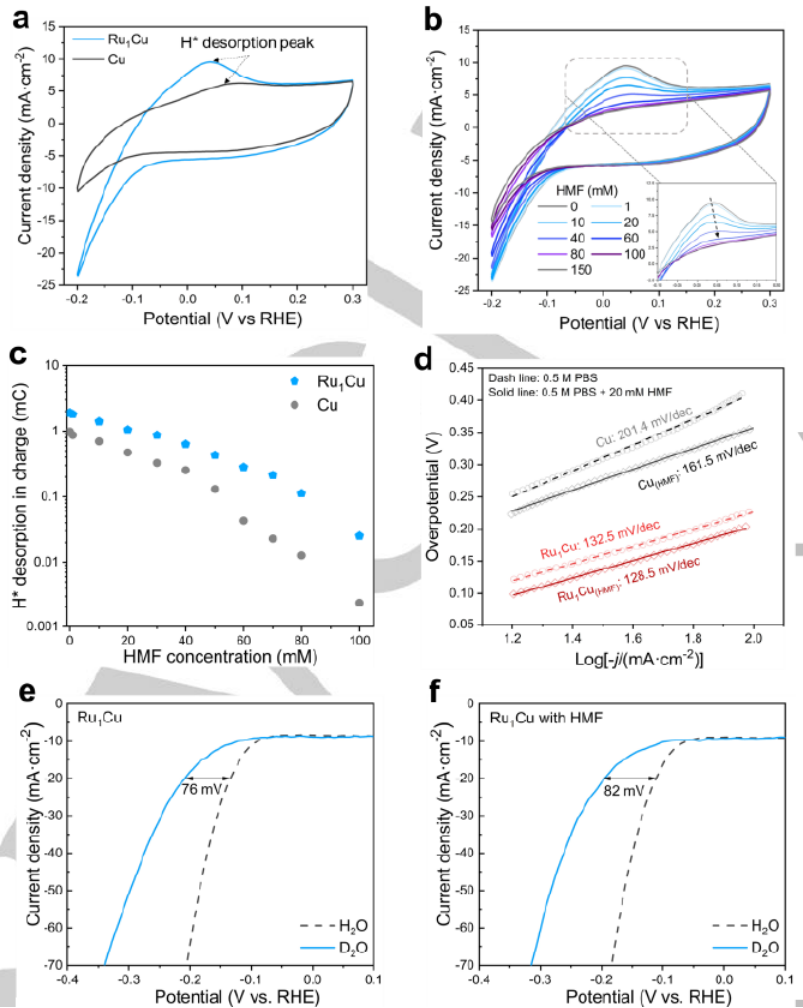
圖 3. (a) Cu和Ru1Cu在 0.5 M PBS中的CV曲線,掃描速率為 100 mV·s-1。(b) 添加不同濃度HMF的Ru1Cu的CV曲線,插圖顯示放大的H*解吸峰。(c) 不同HMF濃度下 Cu和Ru1Cu上的H*解吸電荷。(d) 在HMF存在和不存在的情況下,HER在Cu和 Ru1Cu上的Tafel圖。(e-f) 在不添加和添加20 mM HMF的情況下,在pH 7.0或pD 7.0電解液中Ru1Cu的LSV曲線。
純電解液中的循環伏安圖(CV)在Cu和Ru1Cu的陽極掃描中顯示 0.09 V 和 0.03 V的峰值,分別歸因于 H* 解吸(圖 3a)。H*解吸峰明顯大于Ru1Cu,表明電極上存在更多的H*。之后,隨著 HMF 的加入,兩個樣品的 H* 解吸峰變得更小并被完全抑制(圖 3b)。通過對H*解吸峰的面積進行積分,然后計算不同HMF濃度下的相應電荷(圖 3c),Ru1Cu顯示出更高的H*解吸電荷量,從而反映了更高的H*覆蓋范圍。通過Tafel圖評估HER和電化學還原的動力學(圖 3d)。Cu和Ru1Cu的HER的 Tafel 斜率分別為 201.4 和 132.5 mV dec-1,這表明Volmer步是兩種樣品的速率決定步。隨著 HMF 的加入,這兩個樣品的 Tafel斜率表現不同。與 HER (201.4 mV dec-1) 相比,在 HMF存在下,Cu的Tafel斜率降低,這意味著HMF的電化學還原在動力學上比HER優于Cu,并且 RDS也相應變化。與HER(132.5 mV dec-1)相比,Ru1Cu在HMF存在下表現出相似的Tafel斜率,這表明在Ru1Cu上電化學過程的 RDS 受引入HMF的影響較小,即 RDS可能仍然是HMF電化學還原中的Volmer步驟。在LSV中,HER 和電化學還原反應都揭示了動力學同位素效應 (KIE)(圖 3e)。對于 HER,在 Cu上觀察到明顯的陰極位移,表明氘釋放 (DER) 的動力學比HER更緩慢。然而,與Ru1Cu相比,陰極位移不太顯著(圖 3e),這意味著單原子Ru在促進水分解中起著至關重要的作用,可能是通過促進產生H*的 Volmer 步驟。對于 HMF的電化學還原,在Ru1Cu上觀察到類似的KIE陰極位移程度(圖 3e,f),表明電化學還原的 RDS 保持為 Volmer 步驟,這與HER的幾乎相同的 Tafel 斜率值和HMF的電化學還原一致(圖 3d)。因此,推斷HMF在Ru1Cu上的電化學還原可能遵循ECH機制,其中H*通過Volmer步驟產生,用于隨后的HMF加氫。對于通過ECH過程進行HMF還原,即H*生成后HMF加氫,它將遵循 Langmuir-Hinshelwood (L-H) 機制,表明HMF和H2O之間存在競爭吸附。因此,可以預期在更高的 HMF 濃度下會出現負反應順序。相比之下,對于HMF的電還原,它將遵循 Eley-Rideal (E-R) 機制,這表明HMF和H2O之間存在非競爭性吸附,這在較高的HMF 濃度下由零反應級揭示。相比之下,Cu 顯示0.2級,接近零級。
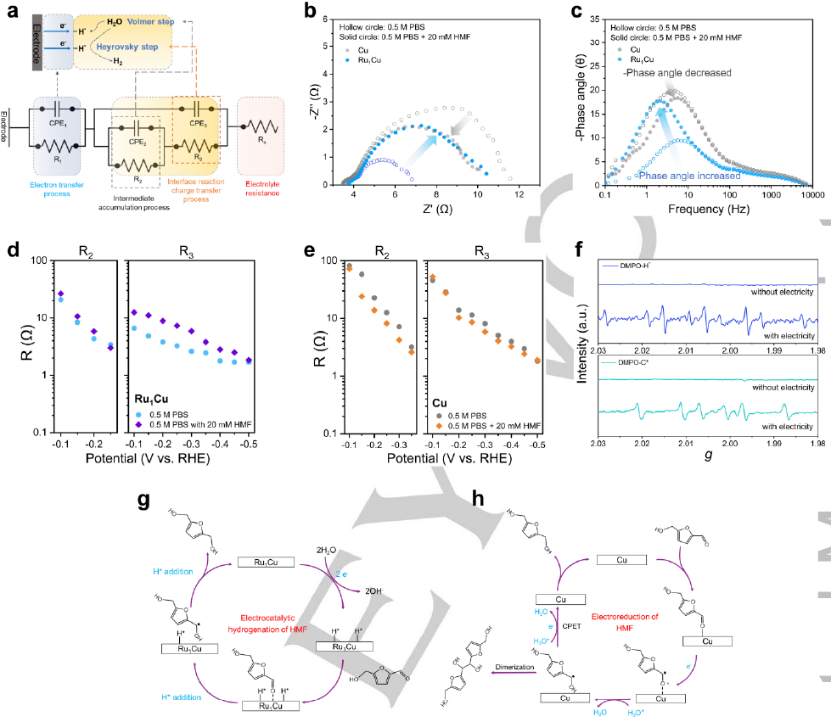
圖4. (a) 電化學阻抗譜擬合中使用的等效電路模型和所提出的Cu和Ru1Cu的HER機理示意圖。在-0.3V(vs. RHE)下Cu和Ru1Cu上(b) 奈奎斯特圖和 (c) HER 波特圖。在存在和不存在HMF的情況下,在從-0.1 V到-0.5 V的電位窗口下 (d) Ru1Cu 和 (e) Cu中間積累的等效電阻 (R2) 和界面反應電荷轉移過程電阻 (R3) 的相關性。(f)Ru1Cu上碳和氫自由基的準原位EPR譜圖。HMF在 (g) Ru1Cu和 (h) Cu上的電化學還原機理。
引入HMF來評估電化學還原行為。在相同的施加電位下,隨著 HMF 的加入,Cu 上中低頻的半圓(圖 4a,b)和相位度(圖 4c)下降,但在Ru1Cu上觀察到相反的趨勢,表明隨著 HMF 的加入,Ru1Cu和Cu上的電荷轉移過程以不同的方式發生了變化。比較了不同電位下有或沒有HMF的中間積累過程 (R2) 和界面反應電荷轉移過程 (R3) 的等效電阻(圖 4d-e)。對于Ru1Cu,R2(圖 4d,左)沒有明顯變化,因為Volmer步驟是HER和ECH在Ru1Cu上的常見步驟。而 R3(圖 4d,右)在從-0.1 V到-0.45 V的電位窗口下隨著HMF的添加而增加,這意味著在HMF存在下,Heyrovsky步驟在動力學上是不利的。至于Cu,R2(圖4e,左)隨著HMF的添加而降低,這表明HMF的電還原更傾向于通過CPET工藝而不是Volmer步驟進行。R3(圖4e,右)僅略微降低,這可以通過CPET在HMF的電化學還原和HER中的Heyrovsky步驟顯示出比較電阻的相似動力學來初步解釋。圖4f顯示在純電解質中觀察到H自由基超過Ru1Cu,這意味著水可以被還原為H自由基。當隨后引入HMF時,碳自由基被檢測為六重體。基于上述組合電化學技術,提出在Cu中制備單原子Ru改變了HMF的電化學還原機制。在Ru1Cu 上,水在單原子Ru上被活化,伴隨著電子轉移和解離成H*物種,然后是兩個H* 物種通過ECH機制與HMF的羰基反應生成DHMF(圖 4g)。而 Cu 通過電還原機制進行,其中HMF的羰基接受來自電極的電子并通過CPET工藝與鄰近的質子相結合。生成的自由基中間體通過另一個CPET過程進一步轉化為DHMF,或者可能通過與另一個自由基的C-C偶聯發生二聚化(圖 4h)。
05
總結與展望
作者合成了一種Ru1Cu單原子合金,它對HMF的電化學還原比Cu表現出更好的性能,實現了更高的DHMF生產率(0.47 mmol·cm-2·h-1)和 FE(85.6%)。在高HMF濃度(100 mM)下DHMF的FE為87.5%。通過使用各種電化學技術表征的動力學結果表明,Ru1Cu和Cu對應物的電化學還原機制不同。單原子Ru促進水的離解產生H*物質,這些物質通過ECH機制與HMF有效反應生成DHMF,而Cu遵循CPET工藝。這項工作為實現生物質升級的高效電催化加氫提供了一種新的策略。
06
文獻鏈接
Electrocatalytic Hydrogenation of 5-Hydroxymethylfurfural Promoted by a Ru1Cu Single-Atom Alloy Catalyst (Angew. Chem. Int. Ed.2022, DOI: 10.1002/anie.202209849)
文獻鏈接:
https://doi.org/10.1002/anie.202209849
審核編輯 :李倩
-
電化學
+關注
關注
1文章
329瀏覽量
20856 -
光譜
+關注
關注
4文章
872瀏覽量
35785
原文標題:段昊泓Angew:Ru1Cu單原子合金促進HMF電催化加氫
文章出處:【微信號:清新電源,微信公眾號:清新電源】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
Adv. Mater.:界面水調控促進超低過電位下硝酸根還原產氨

加氫站氫氣監測自動告警物聯網解決方案
什么是原子層刻蝕

Phase Lab鋁基數據庫,賦能7xxx系鋁合金開發設計
Cu-Cu Hybrid Bonding技術在先進3D集成中的應用

實時原位監測光電催化過程中反應物濃度與熱效應的微光纖傳感器技術
中國科大在納米級空間分辨紅外成像及催化研究中取得新進展


EthernetiP轉modbusTCP網關在加氫催化中的應用

EthernetiP轉modbusTCP網關在加氫催化中的應用




















評論