近年來,組織工程領域迅速發展,為胰島細胞移植提供了可靠的解決方案。借助細胞封裝技術植入的胰島與機體形成免疫隔離屏障,允許葡萄糖、氧氣、營養物質、代謝廢物和信號分子通過微囊雙向擴散,同時阻止免疫細胞、免疫活性物質等對移植胰島細胞的攻擊。
據麥姆斯咨詢報道,東南大學附屬中大醫院內分泌科主任李玲教授與國內外知名學者深度合作,醫工融通,于近期在Chemical Engineering Journal和NPG Asia Materials期刊發表兩項最新研究,通過微流控技術和醫學工程方法構建載胰島β細胞聚集體的微載體(PMC-β)及多孔胰島β細胞微膠囊(β-Mi),展示了胰島“類器官”移植后能逃避免疫攻擊,并持續釋放胰島素以重建葡萄糖穩態。研究工作得到國家重點研發計劃干細胞研究與器官修復項目以及江蘇省重點研發計劃臨床前沿技術等項目支持,李玲教授的研究生李靜波、劉小鈺分別為兩篇文章的第一作者。
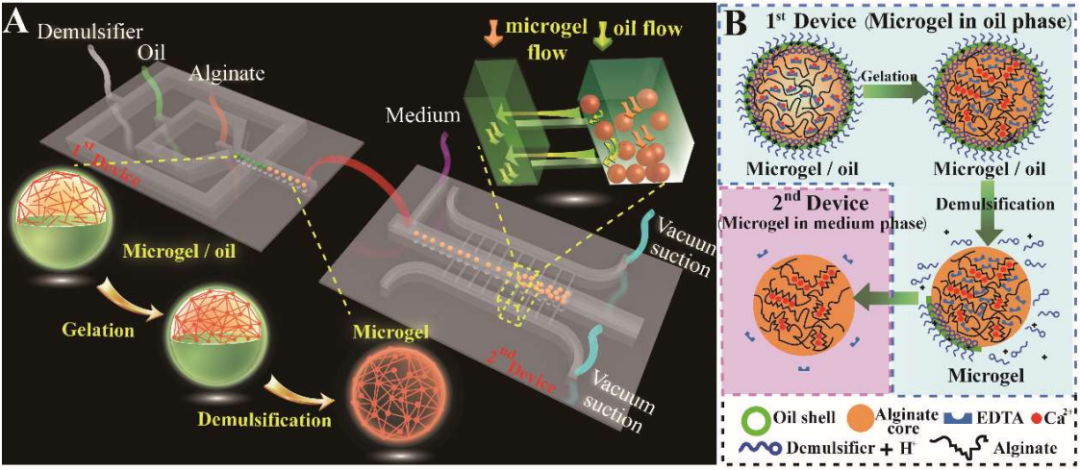
在具體的研究過程中,研究人員基于微流控和細胞3D培養技術設計的PMC-β和β-Mi能夠在體外模擬體內微環境,對胰島細胞進行3D培養,且均具有良好的生物相容性,其結構可允許小分子物質自由進出,在保證物質交換效率的同時可抵御免疫細胞的攻擊。另外,PMC-β和β-Mi可以延長移植胰島細胞在體存活時間,并持續釋放胰島素,將二者移植于糖尿病小鼠網膜,可快速重塑葡萄糖穩態,有望為糖尿病患者胰島移植提供新策略。
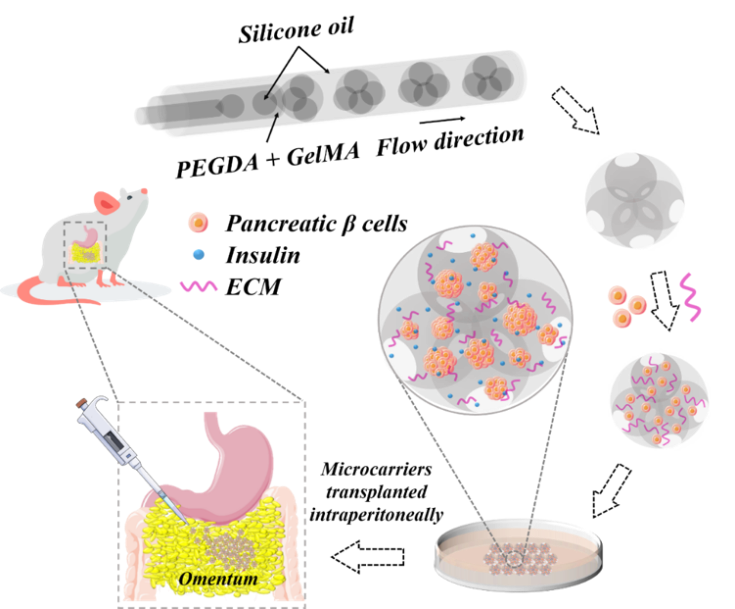
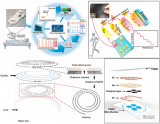
圖1 基于微流控雙乳液滴模板系統制作可控的多孔微球,填充細胞外基質及胰島β細胞,形成3D胰島β細胞聚集體的微載體(PMC-β),并將其移植于糖尿病小鼠網膜處,評價其胰島素分泌功能及恢復葡萄糖穩態的潛力。
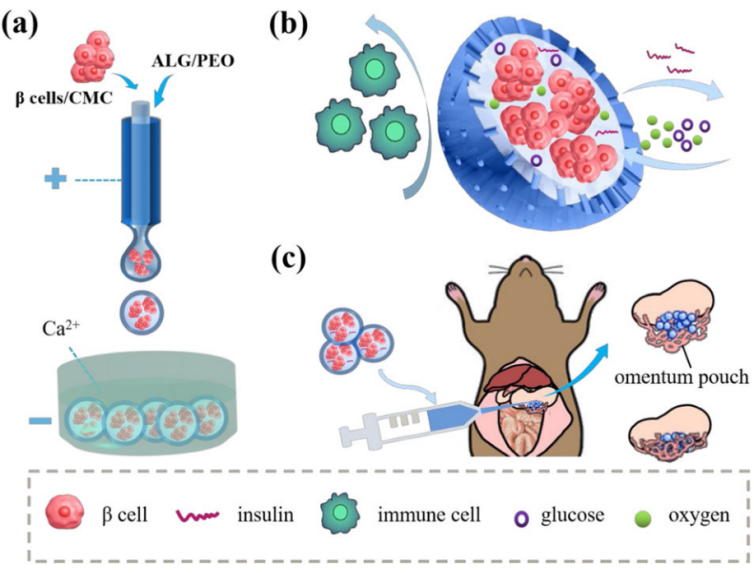
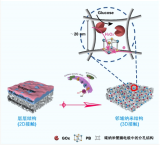
圖2 微流控電噴霧系統制備核殼結構多孔胰島β細胞微膠囊(β-Mi),能隔離免疫細胞,進行氧氣和營養物質的交換,并響應葡萄糖變化釋放胰島素。將其移植于糖尿病小鼠網膜,評價β-Mi的生物相容性、胰島素分泌功能及對血糖水平的影響。
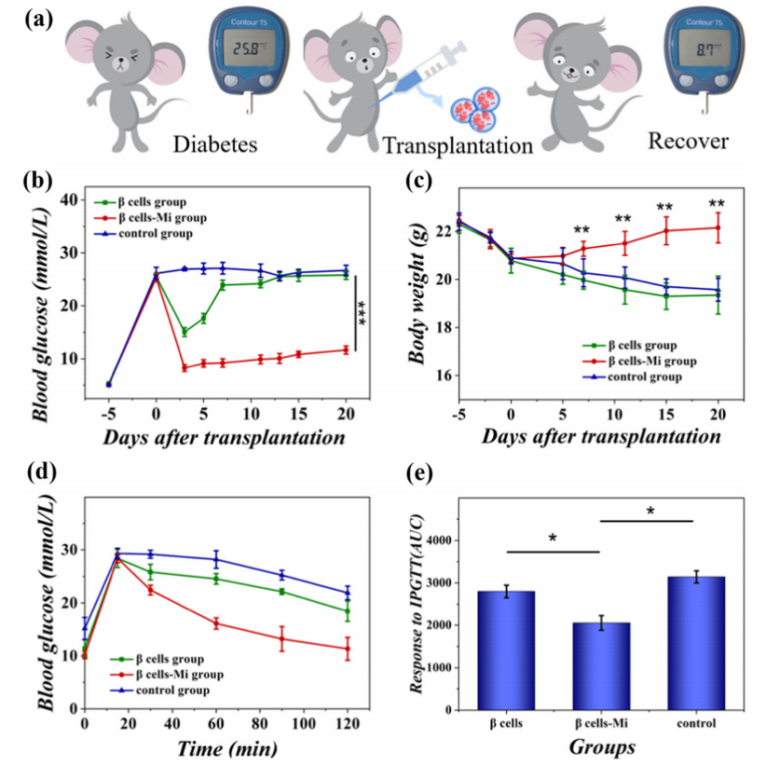
圖3 多孔胰島β細胞微膠囊(β-Mi)在糖尿病小鼠網膜移植后恢復了血糖控制。相比于對照組及單純胰島β細胞移植組,胰島β細胞微膠囊(β-Mi)移植組小鼠血糖降低至正常范圍,且體重逐漸升高至患病前水平,IPGTT結果顯示其維持葡萄糖穩態的能力優于其他兩組。
總體而言,該研究以“醫工交叉融合”的理念,集成臨床醫學、生物醫學工程和基礎醫學多學科優勢,基于微流控系統和高壓靜電噴霧技術,實現胰島細胞的3D培養,獲得具有近生理結構與功能特點的胰島細胞微載體和微膠囊,為治療糖尿病提供新策略,引領前沿技術助推醫療模式變革浪潮,實現未來生命科學領域的關鍵理念性與技術性突破。
-
3D
+關注
關注
9文章
2875瀏覽量
107486 -
微流控
+關注
關注
16文章
525瀏覽量
18885 -
高壓靜電
+關注
關注
0文章
3瀏覽量
6354
原文標題:基于微流控和3D細胞培養技術構建的胰島類器官,用于葡萄糖穩態重塑
文章出處:【微信號:Micro-Fluidics,微信公眾號:微流控】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
淚液葡萄糖傳感器有望讓可穿戴無創血糖監測儀成為現實
使用PSoC 3進行葡萄糖測量
如何校準葡萄糖濃度的電壓?
新型葡萄糖氧化酶電極與毛細管電泳的聯用
微型葡萄糖微傳感器的研制及其應用
MAX9913在三電極電化學葡萄糖儀中的應用電路

葡萄糖藥液質量檢測的視覺成像方案研究




 基于微流控和細胞3D培養技術設計的PMC-β和β-M可快速重塑葡萄糖穩態
基于微流控和細胞3D培養技術設計的PMC-β和β-M可快速重塑葡萄糖穩態










評論