一、背景介紹
目前鋰離子電池中使用的商用碳酸鹽電解質會與鋰發生劇烈反應,產生不均勻且易碎的固體電解質界面 (SEI)。因此,循環過程中的體積變化會導致 SEI 破裂,從而導致鋰枝晶的生長以及“死鋰”的形成,最終導致電池失效并限制鋰金屬電池(LMBs)的實際應用。
為了克服上述缺點,研究人員正在從多個方向解決這些問題,包括構建人工 SEI、隔膜改性、和調整電解質成分。其中,電解液添加劑由于在價格和實際使用可行性方面具有明顯的優勢,越來越受到人們的關注。氟代碳酸亞乙酯 (FEC) 作為碳酸鹽電解質中的添加劑或助溶劑,已被證明是增強 LMB 性能的最有效成分之一。在其他碳酸鹽溶劑中,FEC 可以 優先分解以在 SEI 中進一步生成無機 LiF。許多研究證實,無機化合物有利于促進鋰沿 SEI/Li 界面的橫向擴散,抑制枝晶生長。然而,最近的研究表明,FEC 的溶劑化數應≥1 至 保證形成可靠的 SEI。因此,迫切需要開發適用于碳酸鹽電解質的新型添加劑,以獲得均勻且堅固的 SEI,從而提高高壓 LMB 的性能。硝酸鋰(LiNO3)作為添加劑已被用于醚基電解質中,可有效調節電解質的溶劑化鞘層并形成含氮化物的 SEI,并顯著改變沉積形態并提高鋰的循環穩定性。然而醚基電解質的氧化穩定性較差,這極大地限制了其在高壓電池(≥4.3 V)中的應用。因此,將 LiNO3 引入碳酸鹽電解質被認為是提高 LMB 性能的捷徑。盡管如此,LiNO3 在
碳酸鹽電解質中的溶解度非常低(<10-5 g mL-1),這在很大程度上限制了它在傳統碳酸鹽電解質(例如以 EC 為中心的電解質)中的應用。因此克服低溶解度的問題成為這類改性的一大挑戰。一種策略是溶解度介導的 LiNO3緩釋, 但 LiNO3 的濃度遠低于醚基電解質中的濃度。另一種方法是使用具有高 Gutmann 供體數的溶劑 (GBL, SL, TPPO, TMU 或具有路易斯酸位點的載體鹽 (CuF2, Sn(OTf)2 ,)。它
可以顯著提高碳酸鹽電解質中 LiNO3 的濃度。然而,具有高 Gutmann 供體數的溶劑很容易與金屬鋰發生反應,這對電池性能不利,并減弱了 LiNO3 的效果。此外,高價金屬陽離子(Cu2+、Sn2+)有可能沉積在鋰金屬負極和隔膜上,導致短路風險。除了上述缺點外,部分工作中使用的電解質是基于FEC作為共溶劑,而不是傳統的碳酸鹽電解質,這必然會增加成本。因此,探索合適的 LiNO3 增溶劑以增加 LiNO3 在常規碳酸鹽電解質中的溶解度對于開發高壓 LMB 具有重要意義。 二、正文部分
1、成果簡介

鋰金屬陽極與高壓陰極相結合對于實現高能量存儲至關重要。然而,源自碳酸鹽電解質的以有機物為主的固體電解質界面(SEI)在循環過程中會發生連續的開裂/重整,導致鋰枝晶嚴重生長,阻礙了其實際應用。在此,中南大學陳根、袁小明團隊報道了一種極易溶解的三氟乙酸吡啶離子液體鹽,用于在商業碳酸鹽電解質中在鋰上構建富含無機物的 SEI。由于靜電相互作用,吡啶鎓陽離子 (Py+) 可以附著在帶負電的 Li 表面上,然后分解成 Li+ 導電的含氮組分。此外,得益于羰基(C雙鍵O)和Li+的強配位,三氟乙酸根陰離子(TFA-)可以促進硝酸鋰(LiNO3)在碳酸鹽電解質中的溶解,從而調節Li+溶劑化殼層。實驗和理論證明了包含大量陰離子的不同溶劑化殼的形成,這有利于快速去溶劑化動力學。此外,添加劑的綜合作用促進了添加劑衍生的 LiF-Li3N 增強的富無機 SEI 的形成,顯著降低了 Li+ 擴散能壘并促進了致密的塊狀鋰沉積。在設計的電解質中產生了薄而致密的陰極電解質界面 (CEI) 層,并抑制了過渡金屬的溶解。因此,實現了 Li||NCM523 電池優異的循環和倍率性能,證實了增強的穩定性。
2、研究亮點
1)三氟乙酸吡啶(PyF)的離子液體鹽被創新地用作碳酸鹽電解質添加劑。
2)陽離子調節Li的沉積,陰離子促進不溶性LiNO3的溶解。
3)包含豐富陰離子的不同溶劑化殼有利于Li+的快速去溶劑化。
4)富含無機物的 SEI 顯著降低了 Li+ 擴散能壘并實現了緊湊的鋰沉積。
3、圖文導讀
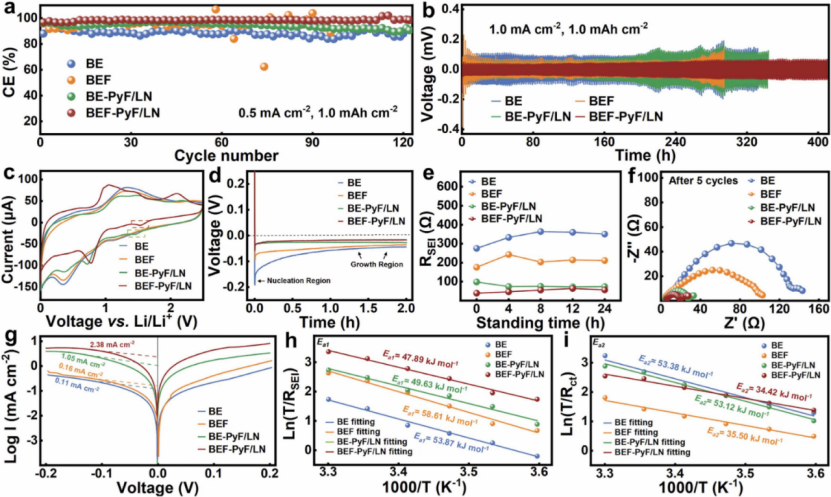
圖 1 不同電解質中的電化學性能。 (a) 在電流密度為 0.5?mA?cm-2 和固定容量為 1.0 mAh cm-2 的情況下,Cu 工作電極在不同電解質中的鍍鋰/脫鋰庫侖效率。 (b) 在 1.0?mA?cm-2、1.0 mAh cm-2 下,對稱 Li||Li 電池在不同電解質中的循環性能。 (c) Li||Cu 半電池在 0-2.2?V 電壓范圍內,掃描速率為 0.5?mV?s-1 的 CV 曲線。 (d) 在不同電解液中鍍鋰時的過電位差。 (e) Li||Li 對稱電池的 SEI 阻抗演變作為電解質在各種電解質中浸泡時間的函數。 (f) Li||Li 對稱電池在 1.0?mA?cm-2 和 1.0mAh cm-2 循環 5 次后的 EIS 曲線。 (g) 對稱鋰電池在不同電解質中的Tafel圖。 (h, i) Nyquist圖計算得到的 RSEI 和 Rct 的活化能。
圖 1a 顯示了不同電解質中的平均 庫倫效率(CE) 值。 BE、BEF (5% FEC)、BE-PyF/LN (0.02 M PyF/0.1 M LiNO3) 和 BEF-PyF/LN (5% FEC-0.02 M PyF/0.1 M LiNO3) 的 CE 分別為 88.8%、94.6分別為 %、95.4% 和 98.5%。在將LiNO3和FEC共同引入BE后,兩者的聯合相互作用顯著提高了平均CE,表明形成了穩定的SEI。根據以往的文獻,NO3? 的陰極分解電位高于碳酸鹽電解質組分。如圖 1c 所示,~1.5 V vs Li/Li+ 的明顯峰可歸因于 NO3? 的還原。NO3? 的還原在 SEI 形成過程中起決定性作用,促進含有 Li3N 和其他氮化物的 SEI 的形成。由于氮化物具有高 Li+ 電導率,與 BE(192 mV)和 BEF(96 mV)相比,BE-PyF/LN(57 mV)中的成核過電位普遍降低(圖 1d,圖 S3) .在 BEF-PyF/LN 中,成核過電位 (57 mV) 與 BE-PyF/LN 相比雖然基本沒有變化,但與其他電解質相比,BEF-PyF/LN (18 mV) 的生長過電位已是最低。根據均勻形核的經典方程,過電位越低,晶粒尺寸越大。增加晶粒尺寸有利于維持體電子導電連接并減輕在鍍/脫鋰過程中“死鋰”的形成,從而有效地提高鋰的 CE。
使用 Li||Li 對稱電池進一步驗證了 SEI 在不同電解質中的穩定性。如圖 1b 所示,BE、BEF、BE-PyF/LN 和 BEF-PyF/LN 的循環壽命為 330?h、295?h、345?h 和超過 400?h。在 BE 中添加 FEC 或 LiNO3 后,大的過電勢和短的壽命表明單個添加劑不足以保持長期穩定的循環,而 BEF-PyF/LN 在 1.0 時提供了超過 400?h 的出色循環性能mA?cm-2 和 1.0 mAh cm-2,以及在 200?h 時與 BE (107?mV)、BEF (67?mV) 和 BE-PyF/LN (95?mV) 相比的最低過電位 49?mV。優異的循環穩定性證實了最佳 SEI 的形成,這有助于抑制鋰和電解質之間的副反應,從而減少產物和“死鋰”的積累。電化學阻抗譜(EIS)用于分析界面阻抗演變。高頻下的半圓可歸因于通過 SEI (RSEI) 的 Li+ 遷移阻力。可以看出,RSEI值在前8?h期間一直在上升,表明鋰金屬與BE中的碳酸鹽電解質反應形成多孔SEI,BE中的RSEI在24?h后達到最高值,約為350?Ω(圖1e)。雖然 FEC 添加劑可以將 RSEI 降低到 BE 的 60%,但它仍然保持相對較高的值(約 210?Ω)。相反,含有 LiNO3 添加劑的 BE-PyF/LN 中的 RSEI 急劇下降至 BE 的 21%(約 75?Ω),這得益于 SEI 中無機氮化物如 Li3N 和 LiNxOy 的增加,這已被證明是極好的 Li+ 導體,從而降低了 Li+ 遷移勢壘。在 LiNO3 和 FEC 的共同作用下,BEF-PyF/LN 的電阻最低(約 56?Ω)。此外,Li||Li 對稱電池在 0.5?mA?cm-2 和 1.0mAh cm-2 的各種電解質中循環 5 次后的 EIS 結果與上述結果一致(圖 1f)。
Tafel 圖用于探索電化學反應動力學(圖 1g)。在 BE 和 BEF-PyF/LN 中,交換電流密度 (i0) 從 0.11?mA?cm-2 顯著增加至 2.38?mA?cm-2,表明 BEF-PyF/ LN中 Li/電解質界面處的 Li+-轉移動力學更快。Li+ 電鍍過程中需要克服通過 SEI (Ea1) 和 Li+ 去溶劑化能壘 (Ea2) 的 Li+ 傳輸阻力,這兩個活化能可以通過根據 Arrhenius 方程擬合與溫度相關的 EIS 曲線來獲得。圖 1h 顯示在 BEF-PyF/LN 中形成的 SEI 表現出出色的 Li+ 電導率,與 BE(53.87?kJ?mol-1)相比,Ea1(47.89?kJ?mol-1)大大降低,這可歸因于大量的無機成分和晶界在 SEI 中提供了豐富的 Li+ 傳輸路徑。與BE中的Li+去溶劑化能(Ea2)(53.38?kJ?mol-1)相比,BEF-PyF/LN顯示出顯著降低(34.42?kJ?mol-1)(圖1i)。這證明了添加劑的加入調節了Li+內溶劑化鞘的環境,顯著增強了Li+的去溶劑化動力學。
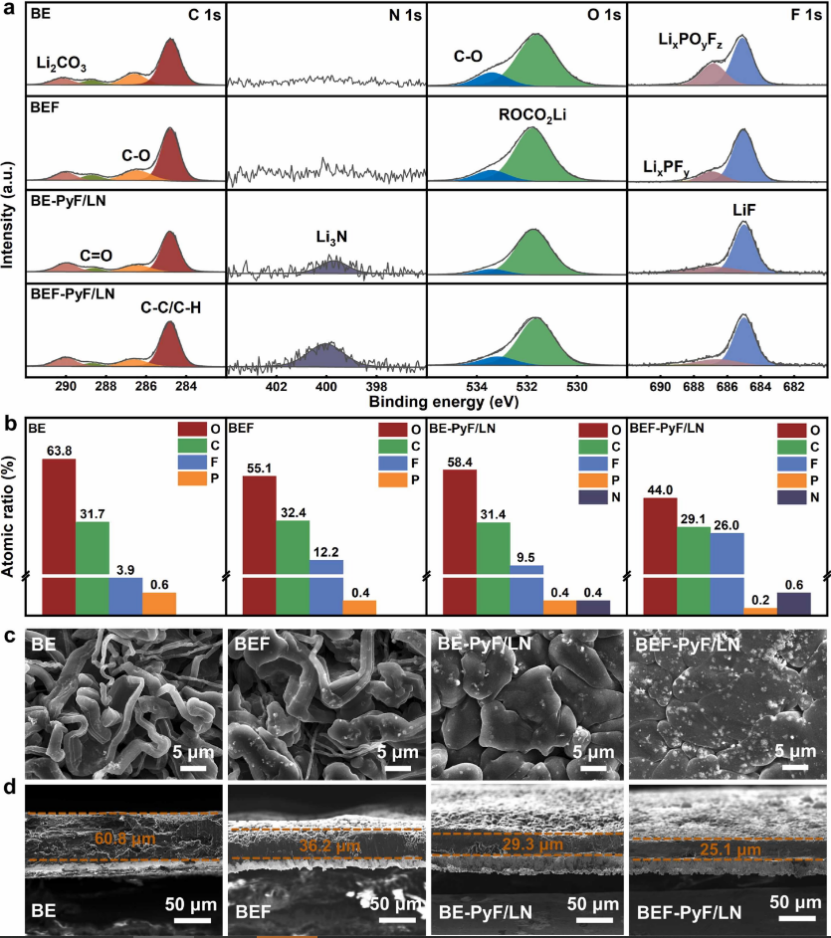
圖2 SEI 成分和沉積形態表征。 (a) SEI在不同電解液中鋰金屬上的XPS C 1?s、N 1?s、O 1?s和F 1?s光譜。 (b) 在不同電解液中,Cu 基板上電沉積的 Li 的表面元素原子比。 BE、BEF、BE-PyF/LN 和 BEF-PyF/LN中Cu 箔上電沉積的 Li 的 SEM 圖像 的 (c) 俯視圖和 (d) 截面圖。
X 射線光電子能譜 (XPS) 用于檢查 SEI 的化學成分,然后進一步研究成分與沉積形態之間的內在關系。如圖 2a 所示,在 F 1?s 光譜中,LiF 峰(685.1?eV)存在于所有電解質中,這可歸因于 LiPF6、FEC 和 TFA- 的分解。 LiF 是一種優良的電子絕緣體,因為它的帶隙很大,因此可以有效地促進鋰在 SEI/Li 界面而不是 SEI 內部的成核。此外,LiF 得益于其高界面能和高楊氏模量,在抑制枝晶生長和促進鋰均勻沉積方面發揮著重要作用。 EDS元素作圖結果表明,BEF-PyF/LN中的F元素含量遠超其他電解液,證明BEF-PyF/LN中形成的SEI中存在大量LiF(圖2b,圖S11)。從 N 1?s 譜可以看出,BE-PyF/LN 和 BEF-PyF/LN 在 399.8?eV 處出現了一個明顯的峰,指的是通過還原 LiNO3 或吡啶鎓陽離子產生的高導電性 Li3N,而在BE和BEF中生成的SEI中沒有捕獲到明顯的N 1?s 信號。 Li3N 表現出優異的 Li+ 電導率 (10-3 S cm-1) 和低化學活性,這有助于快速離子傳輸、降低 SEI 阻抗并加速反應動力學。因此,富含 Li3N 的 SEI 誘導了平面緊湊的 Li 沉積,阻礙了枝晶的形成并提高了 CE。對于 C 1?s 光譜,所有電解質在 284.8、286.5、288.7 和 290.1?eV 處顯示四個不同的峰,分別歸屬于 C-C/C-H、C-O、C雙鍵 O 和 Li2CO3,對應于溶劑分子的分解。這些有機成分充當 SEI 的連接器,以對抗循環過程中的體積變化,但它們很容易被枝晶刺穿。在 BEF-PyF/LN 中 C 元素的比例顯著降低(圖 2b),這表明在添加 LiNO3 和 FEC 后無機成分的增加和源自溶劑分子的有機成分的減少。 O 1?s 光譜也證明了同樣的觀點。因此,在 BEF-PyF/LN 中構建了一種富含無機物(LiF 和 Li3N)的增強型 SEI,由于其高離子電導率、高疏鋰性和高楊氏模量,可有效控制沉積形態、抑制枝晶形成并改善循環性能。
SEI 被認為是決定沉積形態的關鍵因素。如圖 2c、d 所示。在BE中觀察到具有高曲折度的針狀樹枝狀沉積物。這種枝晶生長會引發劇烈的副反應,導致大量“死鋰”的形成,進而導致電池失效。 在 BEF 中也獲得了具有較粗晶粒的類似形態。與此形成鮮明對比的是,在 BE-PyF/LN 和 BEF-PyF/LN 中產生了無枝晶、厚實且致密的鋰沉積形態,并具有最小的曲折度,這有助于減少“死鋰”的數量并促進高鋰 CE。由于 FEC 和 LiNO3 的共同作用,可以在 BEF-PyF/LN 中形成更致密的沉積形態。橫截面圖還表明,BE 電解液中沉積的鋰表現為松散堆積的結構,形成了約 60.8?μm 厚的鋰沉積層(圖 2d),是理論值的四倍(~15.0?μm)。相比之下,BEF-PyF/LN 中的鋰沉積更致密,鋰晶粒尺寸更大。在富含無機物的保護層下,致密堆積的塊狀鋰沉積物的厚度約為 25.1?μm,進一步表明 BEF-PyF/LN 中的富含無機物(LiF 和 Li3N)SEI 可以有效抑制鋰金屬的副反應和溶劑。綜上所述,由BEF-PyF/LN衍生的富含無機物的SEI可以有效促進致密光滑形貌的形成,減少相間面積,抑制枝晶生長,提高CE和循環穩定性。
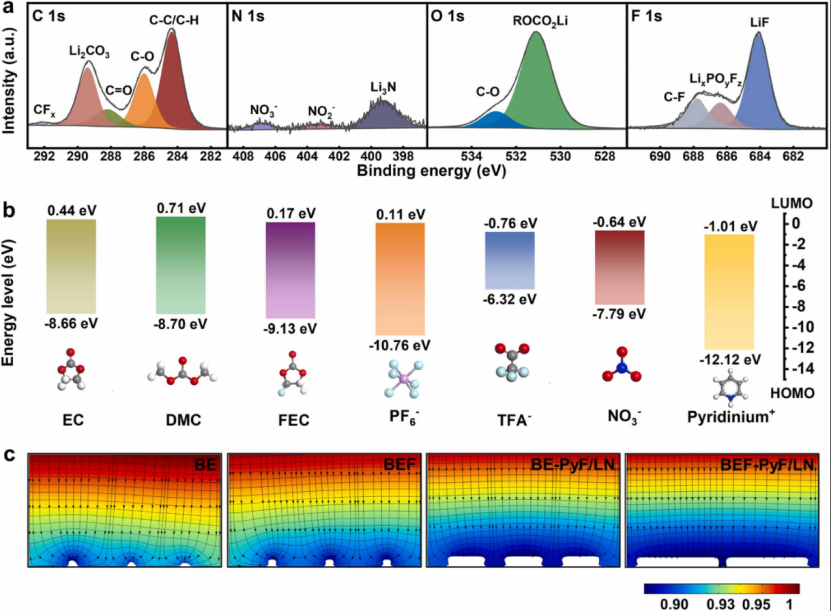
圖3 圖3. (a) BE-PyF中鋰金屬SEI的XPS C 1?s、N 1?s、O 1?s和F 1?s光譜。 (b) 通過 DFT 計算的溶劑和添加劑的分子軌道能量。 (c) COMSOL Multiphysics 5.6 模擬不同電解質中鋰沉積形態的有限元分析,電流密度為 0.5?mA?cm-2,持續 20?min。
吡啶鎓陽離子(pyridinium cation)由于靜電相互作用可以均勻分布在帶負電的鋰金屬表面上并優先還原。為了更清楚地了解吡啶鎓陽離子的分解產物,使用XPS分析在 BE-PyF 中形成的 SEI 的組成(僅向 BE 添加三氟乙酸吡啶鎓)(圖 3a)。N 1?s 光譜在 399.8?eV、403.4?eV 和 407.1?eV 處出現三個峰,分別對應于 Li3N、NO2- 和 NO3-,表明吡啶鎓陽離子的分解。無機氮化物的存在增強了離子電導率,這有助于致密的鋰沉積。此外,與 BE 相比,C 1?s 光譜在 292.2?eV 處顯示了一個額外的 CFx 峰,證明了 TFA- 在陽極表面的分解。 F 1?s 光譜中額外的 C-F 峰在 687.8?eV 與也印證了上述結果。密度泛函理論(DFT)計算用于分析溶劑和添加劑分子的分子軌道能量(圖3b)。顯然,添加劑分子表現出比溶劑分子(EC和DMC)低得多的LUMO能量值,表明添加劑分子更容易被還原形成富含無機物的SEI。此外,物理場模擬闡明了不同SEI成分與Li沉積行為之間的關系(圖3c,圖S13),BE和BEF中形成的天然SEI由多種有機物和少量無機物組成,包括不均勻性、低離子電導率等特性。因此,Li+優先沉積在襯底上離子電導率較高的某些區域,然后Li+會在具有較強電場的突起尖端積累,導致枝晶的形成和生長。對于 BE-PyF/LN,具有 Li3N 的高離子導電 SEI 調節了 Li+ 通量分布,從而促進了塊狀鋰的沉積,從而有效地抑制了枝晶的產生。此外,模擬結果表明,由于BEF-PyF/LN中SEI中無機成分的增加,可以實現更緊湊的鋰沉積。總體而言,模擬結果與 SEM 獲得的沉積形態完全一致。體積大且致密的鋰沉積可以抑制鋰金屬與電解質之間的劇烈反應,減少“死鋰”的數量,促進高 CE。
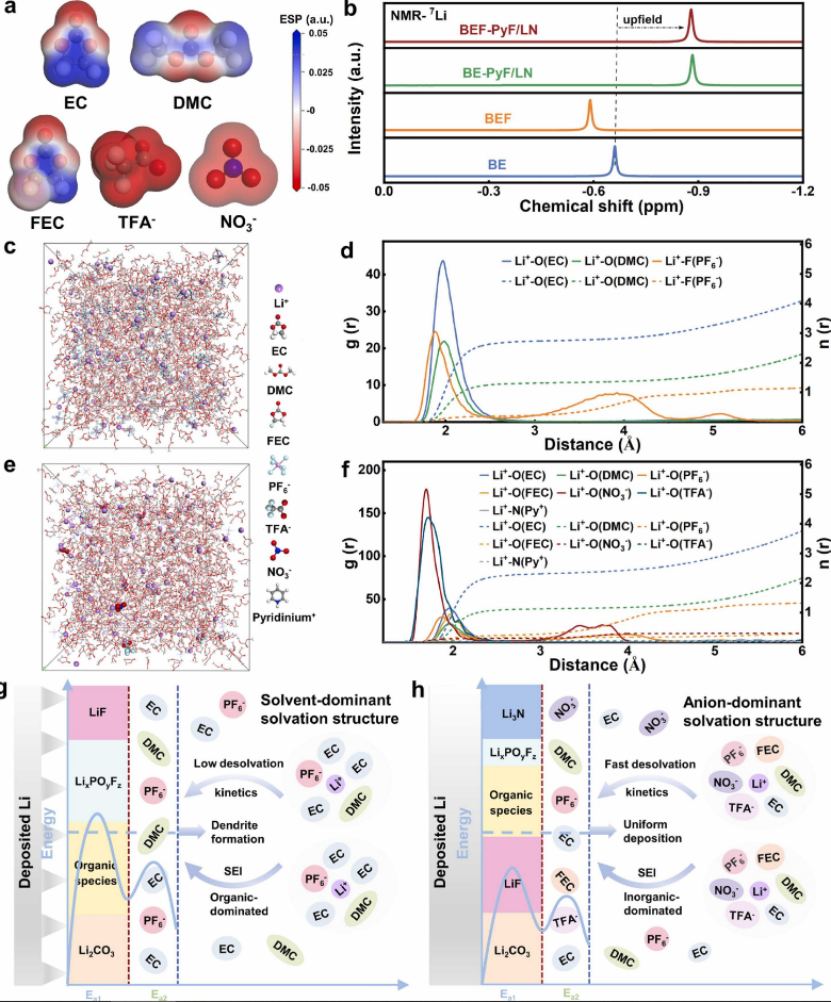
圖4 不同電解質中Li+溶劑化結構的表征。 (a) EC、DMC、FEC、TFA- 和 NO3- 的靜電勢 (ESP)。 (b) 不同電解質的 7Li NMR 光譜。 (c) BE 和 (e) BEF-PyF/LN 的快照通過 MD 模擬在 298?K 獲得。計算徑向分布函數 (g(r), 實線) 和配位數 (n(r), 虛線) d) BE 和 (f) BEF-PyF/LN。 (g) BE 和 (h) BEF-PyF/LN 中的溶劑化結構和作用機制示意圖。
靜電勢(ESP)計算表明,與溶劑相比,TFA- 具有最低的 ESP(圖 4a),這意味著 TFA- 與 Li 的親和力更強,這有助于 LiNO3 的溶解。另外,根據上述結果,可以推測TFA-和NO3-更有可能進入Li+的第一溶劑化殼層。核磁共振(NMR)進一步證實了溶劑化環境的變化。首先,當將 FEC 添加到 BE 中時,7Li 峰略微向下移動(圖 4b),這表明由于 Li+ 和 FEC 之間的相互作用強度較低,Li+ 離子上的核外電子云密度較低(即, -1.79?eV vs -2.08?eV(Li+-EC)(圖 S14)。相反,添加 LiNO3 后 7Li 峰顯著上移,證明了 Li+ 離子周圍的電子云被屏蔽,這表明BE-PyF/LN和 BEF-PyF/LN中劇烈的給電子陰離子(TFA-、NO3-)進入了中的 Li+ 溶劑化殼層。此外,所有在 BE-PyF/LN 和 BEF-PyF/LN 中的 13C NMR 峰都顯示出明顯的高場位移(圖 S15),證實了溶劑與 Li+ 之間相互作用的減少。結合13C NMR分析可以推斷,添加添加劑后,陰離子可以取代Li+周圍的部分溶劑分子。這種富含陰離子的溶劑化結構有利于鋰離子的去溶劑化,因為陰離子很容易被界面電場從溶劑化結構中排出。 進一步進行分子動力學(MD)模擬以了解富含陰離子的溶劑化結構的形成。圖 4c、e 顯示了模擬的 BE 和 BEF-PyF/LN 的快照,后者顯示了模擬框中 NO3- 的均勻分布,表明 LiNO3 在電解液中溶解良好。徑向分布函數 (g(r)) 和配位數 (n(r)) 表明 EC 和 DMC 占據 BE 中第一個溶劑化殼的主要成分,配位數為 2.67 和 1.28(圖 4d),碳酸鹽電解質的分解構建了富含有機層的 SEI。當 FEC 和 LiNO3 同時加入 BE 時,一方面 EC 和 DMC 的配位數降低到 2.12 和 1.02,另一方面 NO3? 的配位數略有增加到 0.15(圖 4f),證明添加 FEC 有利于 NO3- 進入 Li+ 第一溶劑化殼。根據以上分析,三氟乙酸吡啶鎓(PyF)可以作為一種高效的增溶劑,促進LiNO3在商用碳酸鹽電解液中的溶解,從而使Li+的第一個溶劑化殼結合了多個陰離子。 BE和BEF-PyF/LN中典型溶劑化結構和作用機理示意圖如圖4g、h所示。這種獨特的富含陰離子的溶劑化結構加速了鋰離子的脫溶動力學,并且可以優先還原以形成陰離子衍生的、富含無機物的 SEI,這有助于優化鋰的沉積行為并改善 LMBs 的循環性能。
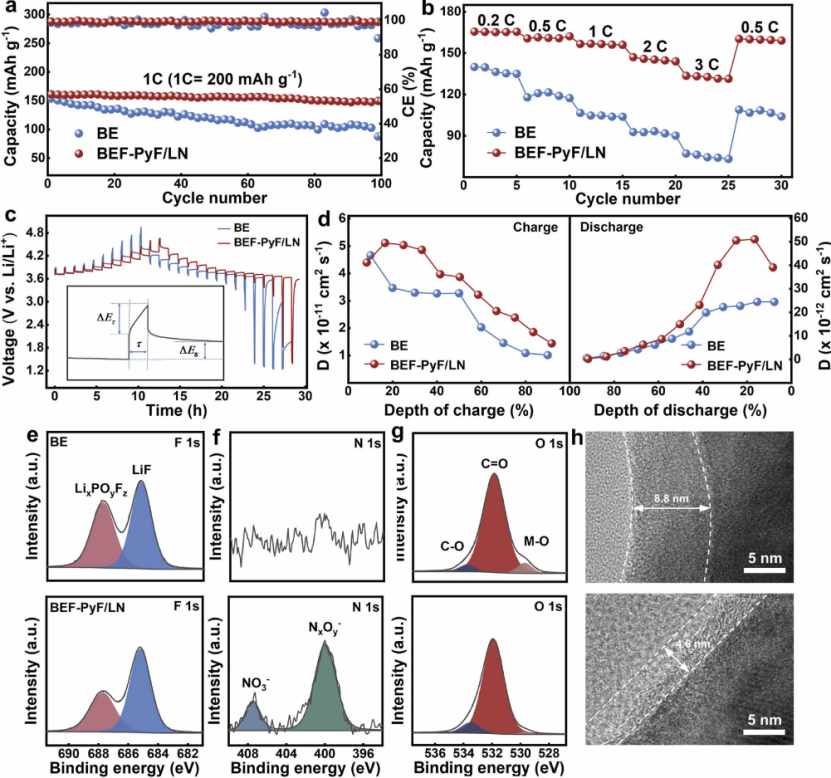
圖5 Li||NCM523電池的電化學性能。 (a) Li||NCM523 電池在 1?C 下在不同電解質中循環的放電容量和 CE。 (b) 具有不同電解質的 Li||NCM523 電池的倍率性能 (c) 50 次循環后進行的 GITT 測量的充電和放電曲線。 插圖:GITT 示意圖。 (d) 在不同電解液中循環后電極的鋰離子擴散系數。 (e-g) BE(上)和 BEF-PyF/LN(下)在 1?C 下循環 50 次后形成的 CEI 的 XPS 光譜。(h)在 BE(上)和 BEF-PyF/LN 中形成的 CEI 的 HRTEM 圖像 (底部)在 1?C 下 50 次循環后。
富鎳化合物因其更大的容量而被認為是潛在的正極材料。因此,進一步評估了 BEF-PyF/LN 在高壓 Li||NCM523 (2.4 mAh cm-2) 全電池中的兼容性。正如預期的那樣,使用 BEF-PyF/LN 的 Li||NCM523 全電池可提供 162.0 mAh g-1 的更高初始放電比容量,并表現出更好的循環穩定性,在 100 次循環后保持 92.9% 的容量保持率,出色的 CE 為 99.3% (圖 5a)。而具有 BE 的電池在 100 次循環后僅保持 56.9% 的容量保持率,總體 CE 為 98.2%。此外,進一步評估了 Li||NCM523 電池在 BE 和 BEF-PyF/LN 中的倍率性能(圖 5b)。具有 BEF-PyF/LN 的電池在 0.2、0.5、1、2 和 3?C 下分別顯示出 165.6、161.4、156.8、147.1 和 133.5 mAh g-1 的優異放電容量。顯然,BEF-PyF/LN 中的 Li||NCM523 全電池顯示出令人印象深刻的倍率性能。特別是在 3?C 高倍率下,使用 BEF-PyF/LN 的 Li||NCM523 全電池的放電容量接近 BE(74.2 mAh g-1)的 1.8 倍。最佳的倍率性能可歸因于電化學離子交換過程中鋰離子在正極材料中的優異擴散動力學。進行恒電流間歇滴定技術 (GITT) 以證明 BEF-PyF/LN 中卓越的鋰離子擴散率。如圖 5c 中的充電和放電曲線所示,在 BE 中觀察到的極化比在 BEF-PyF/LN 中更嚴重。基于充放電曲線計算的 Li+ (D) 的擴散系數如圖 5d 所示。 BEF-PyF/LN 中較高的擴散系數 (D) 反映了優異的擴散動力學,這可能歸因于高質量的陰極電解質界面 (CEI) 層的產生。進行透射電子顯微鏡(TEM)和XPS以闡明CEI層的化學成分和結構。在 F 1?s 光譜中,可以清楚地檢測到更高強度的 LiF(685.1?eV)(圖 5e),我們還可以從 BEF-PyF/LN 中的 N 1?s 光譜中發現快速鋰離子導電導體 LiNxOy 的存在圖 5f。 BEF-PyF/LN 中富含無機物的 CEI 層顯著促進了界面離子擴散行為。值得注意的是,與 BE 中的強 M-O 信號峰不同,在 BEF-PyF/LN 中僅檢測到輕微的 M-O 信號(圖 5g),證明富含無機物的 CEI 層可以阻礙溶劑和陰極的惡性反應,從而抑制溶解過渡金屬。此外,高分辨率透射電鏡(HRTEM)圖像顯示 BEF-PyF/LN 中的 CEI 層比 BE 中的更薄且更致密(圖 5h)。 BEF-PyF/LN中較致密的CEI層遭受的破壞/重建較少,可以有效地保護陰極。綜上所述,BEF-PyF/LN中除了建立優秀的SEI外,還構建了高品質的CEI,以提升高壓電池的性能。
4、總結與展望
文章報道了一種添加劑三氟乙酸吡啶鹽離子液體鹽,用于在商業碳酸鹽電解質中的鋰上構建富含無機物的 SEI 層,以克服枝晶生長的障礙。在這種情況下,由于靜電相互作用,Py+ 可以聚集在 Li 的表面上,并優先還原以形成調節 Li 沉積的含氮化物界面。得益于 TFA- 和 Li+ 之間的強配位,痕量 TFA- 可以促進 LiNO3 在碳酸鹽電解質中的溶解,形成包含大量陰離子的獨特溶劑化殼,如 MD 模擬和 NMR 分析所示,從而降低了 Li+ 去溶劑化能壘。此外,添加劑的綜合作用促進了 LiF-Li3N 增強型 SEI 的形成,這增加了界面能并降低了 Li+ 擴散能壘,有助于更快的離子擴散動力學和無枝晶的致密體沉積形態的形成。此外,在 BEF-PyF/LN 中構建了高質量的 CEI 層,以充分保護陰極。因此,Li||LiFePO4 (2.0 mAh cm-2) 電池在 1?C (1?C = 170 mAh g-1) 下循環 500 次后仍保持高容量保持率 (83.4%)。采用 BEF-PyF/LN 電解質的 Li||NCM523 (2.4 mAh cm-2) 全電池在 100 次循環后表現出令人印象深刻的 92.9% 容量保持率,在 1?C (1?C = 200 mAh g-1) 下的平均 CE 為 99.3% 和良好的速率性能。這項工作為開發高壓LMBs提供了一種簡單、可行且經濟的電解質添加劑策略。
審核編輯:郭婷
-
鋰離子電池
+關注
關注
85文章
3242瀏覽量
77750 -
電解質
+關注
關注
6文章
814瀏覽量
20073
原文標題:Nano Energy:如何讓鋰離子又快又密沉積?碳酸酯+離子液體雙劍合璧
文章出處:【微信號:清新電源,微信公眾號:清新電源】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
如何提高中繼器的傳輸穩定性
高穩定性富鋰錳基正極材料

定量識別摻雜位點:解鎖富鋰正極材料的高性能與穩定性
鉀離子輔助的多陰離子材料—鈉離子電池長循環穩定性的新機制

聚陰離子錨定策略提升高電壓LiCoO2的反應動力學性能于EES中探究

鳳凰動力舵輪驅動輪的穩定性如何影響AGV的運行效率和穩定性

運放穩定性的判斷原理的補償原理?
探索帶電鋰離子通道對金屬鋰負極枝晶生長的抑制作用

如何提高旋轉花鍵運行穩定性?





 如何讓鋰離子改變沉積形態并提高鋰的循環穩定性
如何讓鋰離子改變沉積形態并提高鋰的循環穩定性












評論