01、導讀
鋰金屬負極由于具有高理論比容量而有望取代商業石墨負極,然而高反應性鋰金屬負極和電解質之間不可避免地會發生不可逆反應,嚴重縮短電池的壽命。微觀層面上,鋰金屬負極表面結構(晶面)會對反應過程產生影響,此外,大量的晶界(GBs)也暴露于電解質中。一般來說,GBs比晶面具有更高的反應性,所以不可逆反應優先發生在GBs處,然后沿著GBs擴散到內部,即晶間反應。因此,在微觀層面上了解電解質在負極表面和晶界的反應過程迫在眉睫,優化GBs成為抑制晶間反應的新策略。
02、成果簡介
鑒于GBs處的Li比晶面處的Li具有更高的能量,所以鋰金屬負極和電解質之間的反應優先發生在GBs處(圖1A)。為抑制晶間反應,清華大學張強與北京理工大學張學強合作,提出構建鋁(Al)基雜原子集中晶界(Al-HCGB;圖1B)策略,其中Al原子集中在GBs處而不形成可檢測相。在Al-HCGB,電子從Li原子轉移到Al原子并增加Li和電解質之間的反應電阻,抑制了晶間反應并減緩了活性Li的損失和電解質的消耗。相關工作以Inhibiting intercrystalline reactions of anode with electrolytes for long-cycling lithium batteries為題發表在ScienceAdvances上。
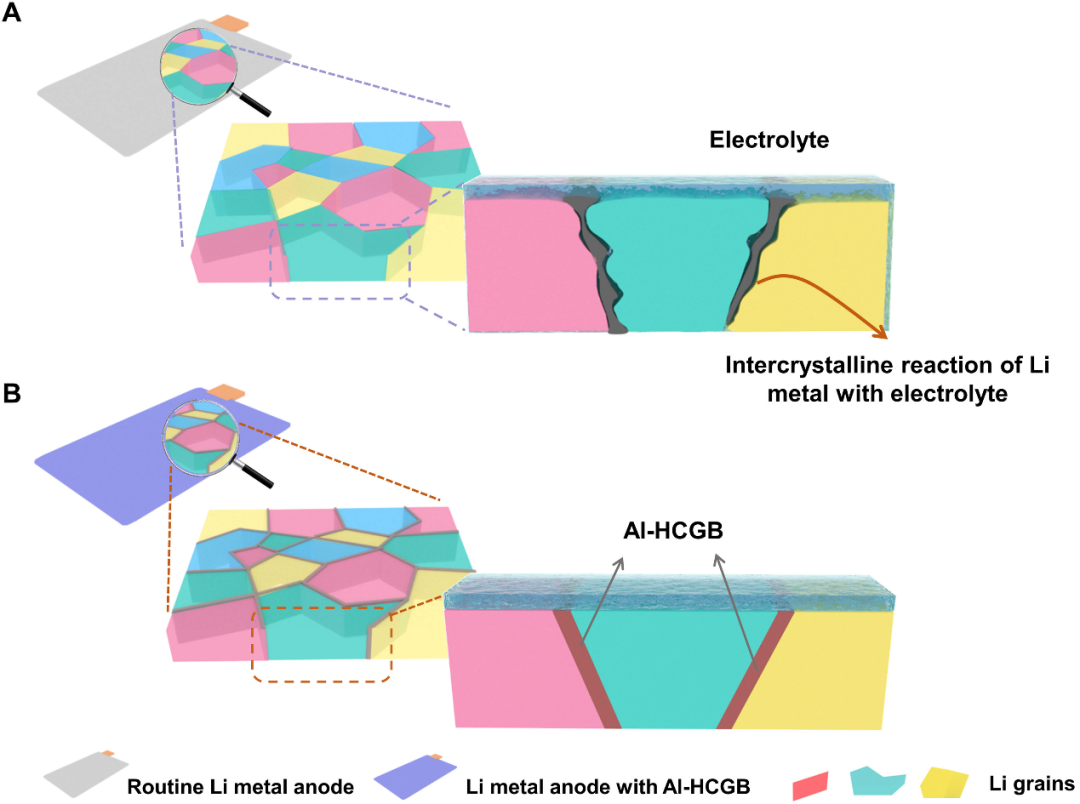
圖1.鋰金屬與電解質的晶間反應過程示意圖。(A)常規鋰金屬和(B)Al-HCGB鋰金屬。@AAAS
03、關鍵創新
(1)提出了鋰金屬負極與電解質的反應優先發生在晶界處,即晶間反應;
(2)提出了一種鋁基雜原子集中晶界(Al-HCGB),在Al-HCGB中,電子從鋰轉移到鋁原子,抑制了鋰金屬與電解質之間的晶間反應。
04、核心內容解讀
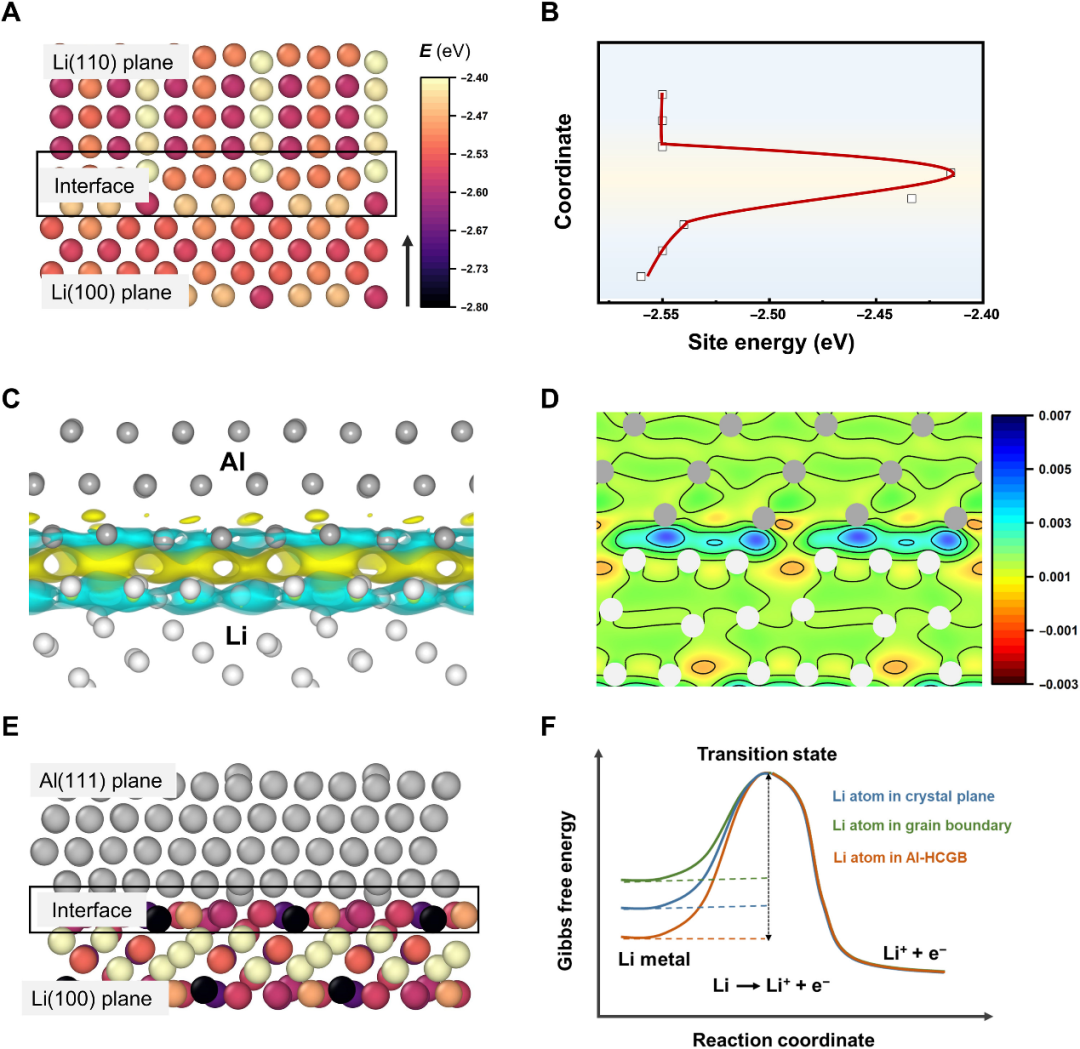
圖2.Al-HCGB抑制晶間反應的機理。(A)Li(110)、Li(100)及其界面中鋰原子的位能(Esite)。(B)Esite沿(A)中箭頭方向演變]。(C)Li和Al界面處的變形電荷密度分布。(D)(C)的相應二維(2D)截面。(E)Li(100)平面中Li原子的位點能量以及Li和Al金屬之間的界面。(F)反應Li - e-= Li+在晶面、GBs和Al-HCGB的吉布斯自由能變化。@AAAS
通過第一性原理計算了Li原子在各個晶面以及GBs處的位能(Esite),發現Li(100)和Li(110)晶面之間相近的平均Esite(誤差在0.02 eV內),表明Li在兩個晶面上的反應性相似(圖2A,B)。然而,在Li(100)和Li(110)晶面之間的GBs處Li原子的平均Esite顯著高于晶面(-2.41 vs. -2.55eV),這意味著GBs處的Li表現出更高的反應性。因此,Li與電解質之間的反應傾向于從GBs開始,然后沿著GBs擴散,即晶間反應。
當Al雜原子與Li原子接觸時,由于Al原子的電負性強于Li原子,電子從Li轉移到Al原子,這通過變形電荷密度分析得到證實(圖2C,D)。電荷轉移降低了Li原子周圍的電子密度,從而降低了Li的反應性。因此,將Al原子引入GBs時,GBs處Li原子的平均Esite從-2.41下降到-2.60 eV(圖2E)。另外隨著Esite的減少,Li - e-= Li+反應的能壘增加(圖2F)。故與常規GBs相比,Al-HCGB可以抑制Li與電解質的晶間反應,從而降低活性Li的損失和電解質的消耗。
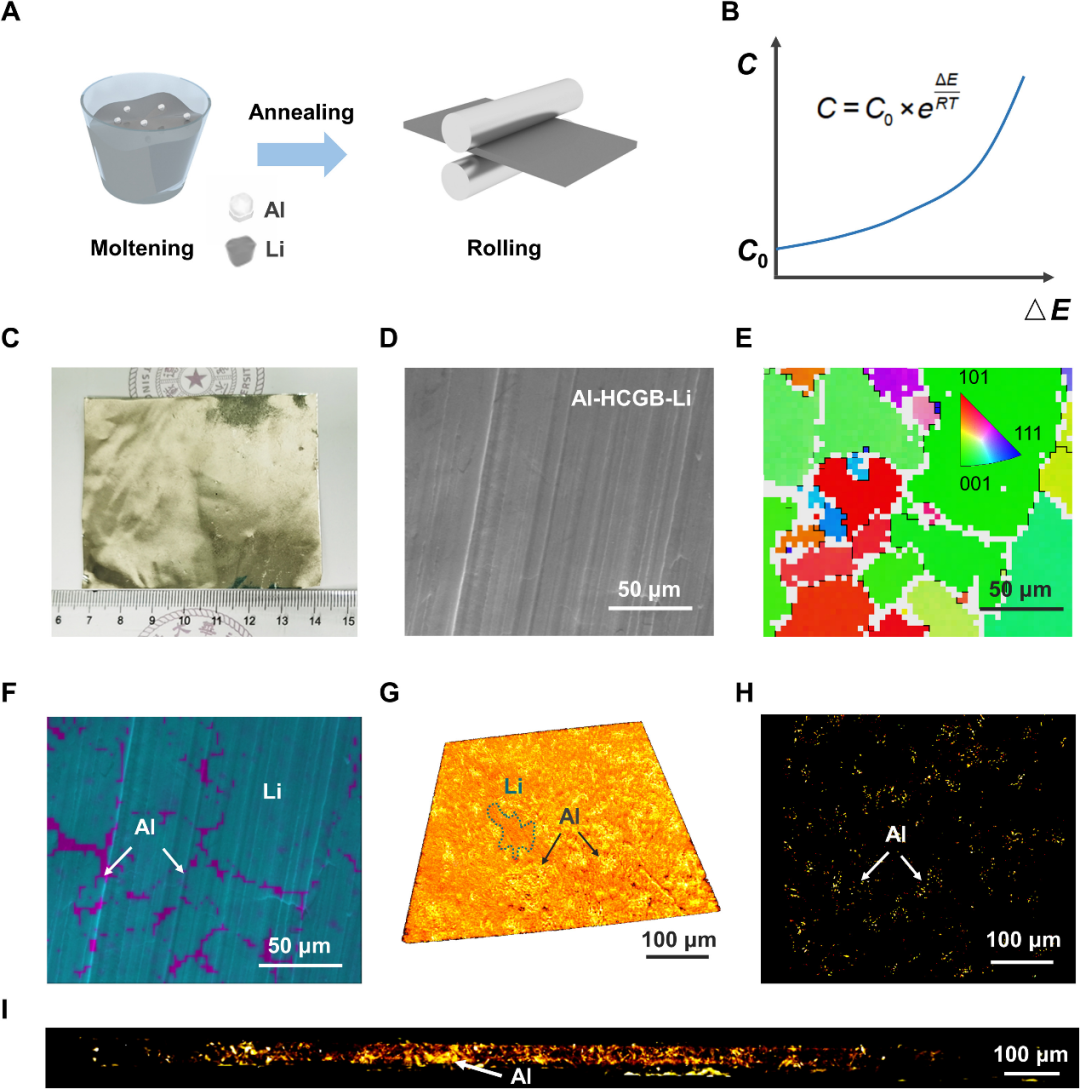
圖3. Al-HCGB的構建。(A)Al-HCGB-Li的制備過程。(B)GBs處Al原子濃度與畸變能的關系。(C)Al-HCGB-Li箔的光學圖像。(D)Al-HCGB-Li的SEM圖像。(E)EBSD映射和Al-HCGB-Li的反極圖著色圖。(F)Al-HCGB-Li中Al元素的EDS映射。(G)XRM在Al-HCGB-Li內的Al分布。(H)(G)的橫向和(I)縱向剖視圖。@AAAS
采用熔融法構建Al基雜原子集中晶界(圖3A)。在退火過程中,Al原子會自發地集中在GBs處,使金屬整體的畸變能最小化,這被稱為GBs偏析(圖3B)。采用掃描電子顯微鏡-電子反向散射衍射-能量色散光譜(SEM-EBSD-EDS)和三維X射線顯微鏡(3D XRM)探究Al-HCGB-Li表面和內部Al的分布,發現Al原子在表面和內部都富集在GBs處(圖3D-I)。
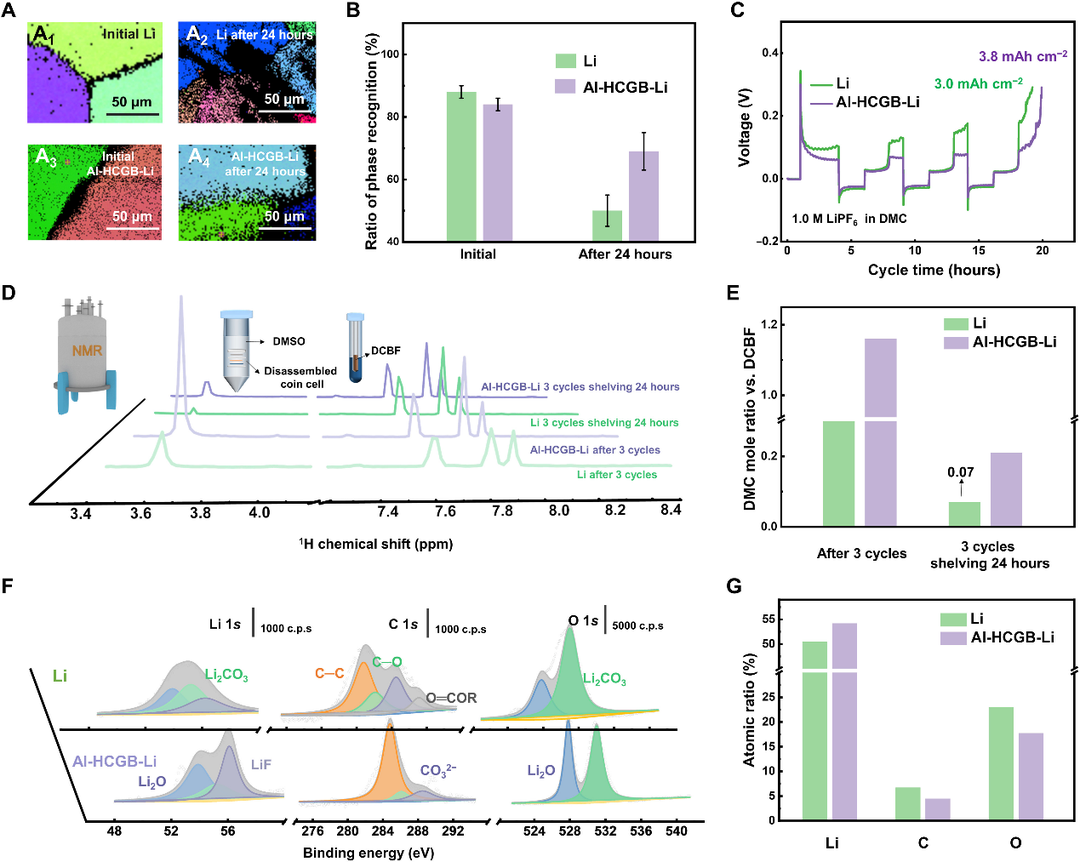
圖4.通過Al-HCGB抑制晶間反應。(A)(A1和A2)常規Li和(A3和A4)Al-HCGB-Li箔在(A1和A3)初始狀態和(A2和A4)浸泡24小時后的EBSD映射。(B)(A)中可識別相的比例。(C)常規Li和Al-HCGB-Li在3個循環后的脫鋰容量。(D)常規Li和Al-HCGB-Li金屬的電池循環3次并擱置24小時后,電解液的1H-NMR光譜。(E)根據(D)計算的DMC的摩爾比。(F)SEI在常規Li和Al-HCGB-Li負極上的XPS光譜。(G)常規Li和Al-HCGB-Li表面上Li、C和O的原子比。@AAAS
通過將Al-HCGB-Li和常規Li浸泡在腐蝕性電解質中以評估Al-HCGB對抑制Li與電解質的晶間反應的影響。從EBSD映射發現Al-HCGB-Li的金屬Li在電解質中浸泡之后,金屬Li相的比例明顯高于常規Li,說明其與電解質的晶間反應程度更低(圖4A,B)。另外沉積剝離實驗也顯示出Al-HCGB-Li中活性Li的消耗含量更低(圖4C)。對上述電池進行拆解做核磁分析,結果表明Al-HCGB-Li中DMC溶劑的消耗量為常規Li的三分之一(圖4D-G)。由于Li金屬與Al-HCGB誘導的電解質的晶間反應得到緩解,活性Li和電解質的消耗速率顯著降低。從XPS中分析可知,在普通的金屬Li表面,其C和O的含量較高,說明電解質分解的較多,進一步證明了Al-HCGB非均相晶界可以減緩電解質與金屬Li的反應。
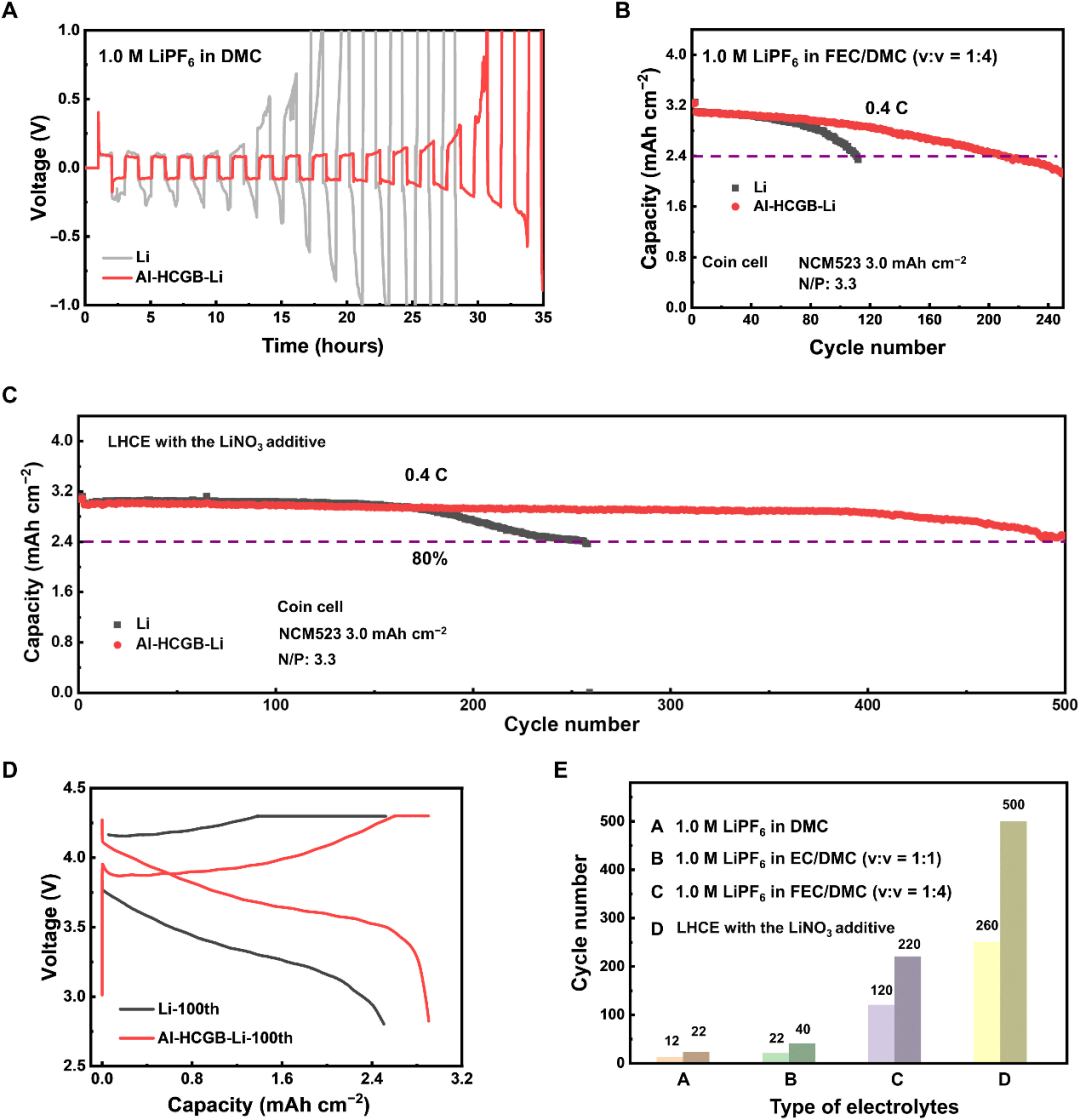
圖5. Al-HCGB-Li在實際鋰金屬電池中的穩定性。(A)常規Li|Li和Al-HCGB-Li|Al-HCGB-Li電池電壓曲線。Li|NCM523在(B)常規電解液和(C)具有LiNO3添加劑的LHCE的電解質中的循環性能。(D)扣式電池在含FEC的電解質中第100次循環時相應的電壓曲線。(E)不同電解質體系下扣式電池循環性能匯總。@AAAS
采用Li|Li對稱電池探究Al-HCGB-Li與常規Li在DMC基電解質中的穩定性,發現與常規Li相比,Al-HCGB-Li電池的電壓滯后更低,周期更長(圖5A)。此外,在不同的電解質體系中Al-HCGB-Li也表現出比常規Li更好的穩定性(圖5B,E)。匹配高載量的三元正極(LiNi0.5Co0.2Mn0.3O2, 3.0 mAh cm?2)且在N/P為3.3的情況下,使用Al-HCGB改性Li負極的扣式電池的循環長達500圈(圖5C)。
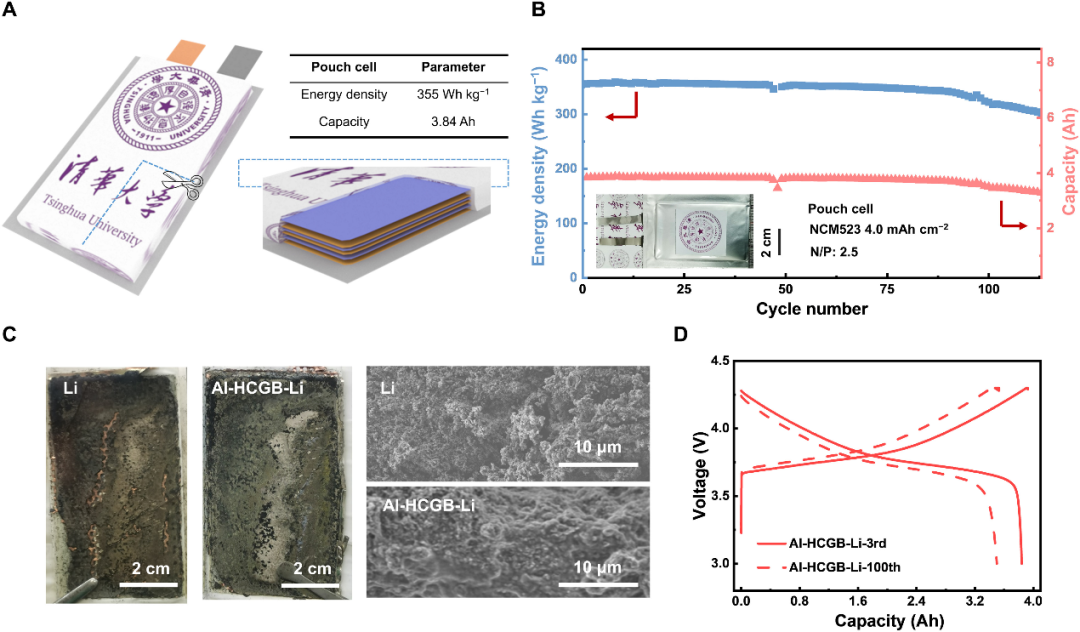
圖6.含Al-HCGB-Li軟包電池。(A)基于所有組件質量的355Wh kg-1軟包電池方案。(B)具有Al-HCGB-Li的3.84-Ah軟包電池在1.0M LiPF6,FEC/DMC電解質中的循環性能。(C)100次循環后軟包電池中常規Li和Al-HCGB-Li在剝離狀態下的照片和SEM圖像。(D)具有Al-HCGB-Li負極的軟包電池在第3次和第100次循環時的電壓容量曲線。@AAAS
基于Al-HCGB-Li的355 Wh kg-1金屬鋰軟包電池在113次循環后容量保持率達86%(圖6A,B)。對循環后的電池進行拆解分析,發現常規Li的表面在100個循環后被大塊死Li覆蓋,并且粉碎的死Li一部分從Cu集流體上剝落(圖6C)。相比之下,Al-HCGB-Li的形態相對平坦致密,從Al-HCGB-Li的表面可以觀察到活性Li的存在,表明Al-HCGB-Li仍然可以參與隨后的循環。
05、成果啟示
本文探究了鋰金屬負極GBs對電解質與鋰金屬晶間反應的影響。通過所設計的Al基雜原子集中晶界Al-HCGB,發現Al集中在鋰金屬表面的GBs處,可用于抑制晶間反應,減緩活性鋰的損失和電解質的消耗。這項工作為研究表面微觀結構對陽極/電解質界面反應的影響提供了新的認識,并提出了一種有效且通用的策略來抑制晶間反應。
審核編輯:郭婷
-
電解質
+關注
關注
6文章
821瀏覽量
20815 -
電荷
+關注
關注
1文章
653瀏覽量
36798
原文標題:張強&張學強Science子刊:晶界設計抑制鋰金屬與電解質晶間反應
文章出處:【微信號:清新電源,微信公眾號:清新電源】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
超聲波焊接有利于解決固態電池的枝晶問題
清華大學:自由空間對硫化物固態電解質表面及內部裂紋處鋰沉積行為的影響
陳軍院士團隊最新Angew,聚合物電解質新突破

鎂合金犧牲陽極與電解質接觸不良的原因

一種薄型層狀固態電解質的設計策略
半互穿網絡電解質用于高電壓鋰金屬電池
詳解電解電容
離子液體添加劑用于高壓無負極鋰金屬電池

通過電荷分離型共價有機框架實現對鋰金屬電池固態電解質界面的精準調控
胡先羅教授在AEM發表研究:探索寬溫電解質設計新路徑

全固態鋰金屬電池的鋰陽極夾層設計




















評論