01、導讀
鋰氧電池(LOB)的理論能量密度高達3500 wh·kg-1,被認為是下一代儲能系統強有力的競爭者。作為一種開放式電池系統,LOB在實際應用面臨著諸多棘手問題:氧還原反應/析氧反應 (ORR/OER) 緩慢,可逆性較差,超氧化物(如Li2O2)導致副反應的發生,鋰負極容易被腐蝕。
究其根本,“罪魁禍首”是Li2O2在正極表面的不均勻沉積。它的沉積堵塞了正極孔結構,阻礙了電子和Li+快速、均勻傳輸,在ORR過程中很難完全分解,使得反應動力學和電化學性能顯著下降。
為了解決這一問題,有的研究者采用氧化還原調控劑,同時提高正負極反應動力學,導致了更多副反應的發生,使問題復雜化。
02、成果背景
為了簡便有效的解決LOB中Li2O2帶來的諸多問題,松山湖材料實驗室王欣、廈門大學/嘉庚創新實驗室喬羽、廈門大學孫世剛團隊合成了一種多功能的電解液添加劑,聚(2,2,2-三氟甲基丙烯酸乙酯,PTFEMA),只需加入0.02wt%,LOB的長期循環性能就可提高8倍。PTFEMA與Li+發生了溶劑化,使其在正負極上的通量更均勻,實現了Li2O2在正極表面的均勻沉積,并且在OER過程中可以完全分解,PTFEMA還能保護鋰負極免受O2、超氧化物及其副產品穿梭帶來的腐蝕。這一研究成果為解決LOB中Li2O2問題提供了一種簡便有效的方法。相關工作以“Enhancing the Reaction Kinetics and Reversibility of Li–O2Batteries by Multifunctional Polymer Additive”為題發表在AdvancedEnergy Materials上。
03、關鍵創新
研究者設計了一種多功能的電解液添加劑PTFEMA,通過與Li+的溶劑化效應,使Li+在電極上的流動更均勻,解決了Li2O2給LOB帶來的不利影響,只需加入0.02wt%,電池的循環穩定性就提高了8倍。
04、核心內容解讀
1、穩定的PTFEMA
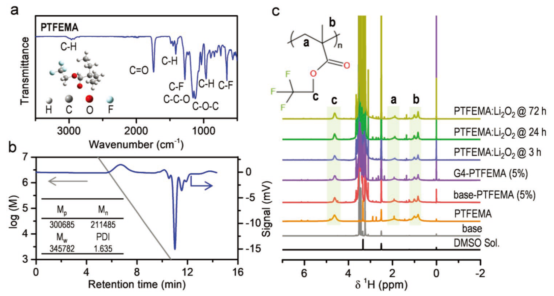
圖1.PTFEMA的表結構征。(a)紅外光譜;(b)GPC譜圖;(c)1H-NMR和對Li2O2的穩定性。@Wiley
研究者通過自由基聚合,在二甲基甲酰胺中進行了甲基丙烯酸三氟乙酯的聚合,得到了PTFEMA,利用FTIR和1H-NMR對其結構進行了表征。
圖1a中,3000-2850和1745 cm-1為C-H和C=O吸收峰,1280、654和740 cm-1是-CF3伸縮、彎曲和搖擺振動特征峰。凝膠滲透色譜(GPC)表明,PTFEMA的重均分子量(Mw)為3.4×105g·mol-1,數均分子量(Mn)為2.1×105g·mol-1,多分散性指數(PDI)為1.6 (圖1b)。在1H-NMR中,4.8-4.3、2.2-1.3和1.3-0.7ppm的化學位移表示O-CH2、-CH2和-CH3(圖1c)。他們又在PTFEMA的溶液中加入5 wt%的Li2O2,結果其特征峰沒有變化,表明PTFEMA分子穩定性好,沒有遭受Li2O2的親核進攻。
2、PTFEMA的神奇功效
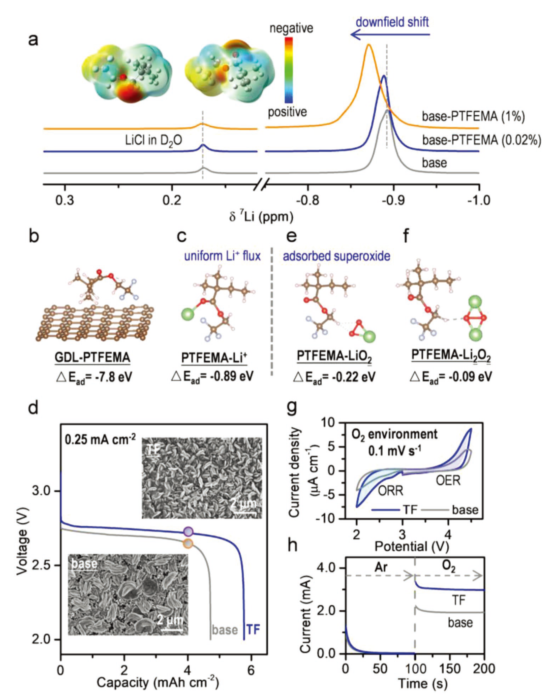
圖2.在有/無PTFEMA的LOB電池中的ORR性能。(a)含PTFEMA(0.02和1wt%)電解質的7Li-NMR譜圖;(b)正極氣體擴散層(GDL)-PTFEMA和(c)PTFEMA-Li+絡合物的優化結構和吸附能;(d)LOB有(藍色)/無(灰色)PTFEMA情況下的全放電曲線(截止電壓2.0 V,電流密度0.25 mA·cm-2);(e)PTFEMA-LiO2和(f)PTFEMA-Li2O2絡合物的優化結構和吸附能;(g)在O2氣氛,0.1 mV·s-1的掃描速率下,有/無PTFEMA的循環伏安曲線;(h)從Ar到O2氣氛,在2.2 V(VsLi+/Li)下有/無PTFEMA的恒定切換電位實驗。@Wiley
為了確定PTFEMA中原子的電荷密度分布,研究者用密度泛函理論(DFT)計算了它的表面靜電勢(ESP),發現負電荷幾乎集中在PTFEMA的C=O官能團的O原子上,其次是C-O基團的O原子和C-F基團的F原子上,這有利于缺電子Li+的配位(圖2a)。隨后,他們又計算了PTFEMA與Li+之間的相互作用,發現正極氣體擴散層(GDL)-PTFEMA的吸附能(?Ead)為?7.8 eV,表現出強吸附作用。溶解在電解液中的PTFEMA可以均勻吸附在GDL上,分子中的負電荷中心吸引了Li+,促進了Li+的均勻分布(圖2b)。
4.0mAh·cm-2的固定容量下,作者又利用SEM研究了放電LOB中Li2O2的形貌,發現有PTFEMA的電池中,Li2O2顆粒均勻分布在GDL表面。在沒有PTFEMA的情況下,Li2O2顆粒聚集在正極側,即PTFEMA的存在促進了Li2O2的均勻分布。放電電壓平臺的差異進一步表明,PTFEMA促進了ORR反應動力學(圖2d)。
計算表明,PTFEMA-Li2O2絡合物的吸附能遠小于PTFEMA-Li+或PTFEMA-LiO2,這意味著Li2O2可以很容易從絡合物中解吸,并參與OER過程(圖2f)。在O2氣氛下,循環伏安(CV)曲線中的ORR電流密度和氣氛切換時i-t曲線的電流相應增加,均進一步證實了PTFEMA加速了ORR過程動力學(圖2g)。
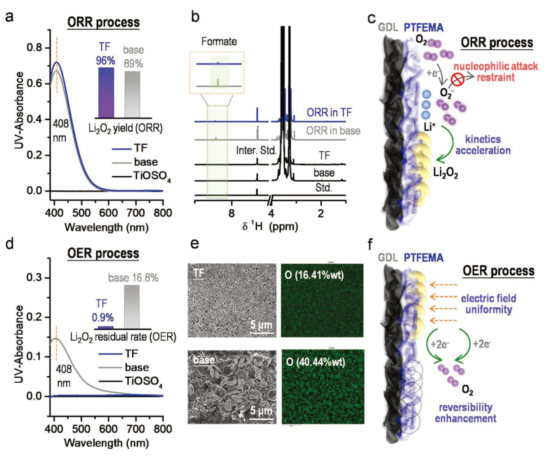
圖3.ORR/OER過程中有無PTFEMA的LOB充電性能比較。(a)采用TiOSO4-UV-vis滴定法分析Li2O2濃度(電流密度為0.1 mA·cm-2,放電容量為1.4mAh);(b)從放電正極和隔膜中D2O提取物的1H-NMR譜圖,固定放電容量為1.4mAh,電流密度0.1 mA·cm-2;(c)有PTFEMA的LOB中ORR過程示意圖;(d)OER過程中正極和隔膜的UV-vis滴定吸收光譜(電流密度為0.1 mA·cm-2,充電容量為1.4mAh);(e)用SEM和EDS表征有/無PTFEMA的GDL;(f)含PTFEMA的LOB中OER過程示意圖。@Wiley
研究者采用TiOSO4-UV-vis化學滴定法分析了Li2O2的濃度,發現在PTFEMA的存在下,Li2O2的生成量達到了理論量的96%,遠高于沒有PTFEMA的89%(圖3a),1H-NMR和19F-NMR也證實了這一結論(圖3b),這是由于PTFEMA促進了Li2O2的生成(圖3c),在充電過程中Li2O2接近完全分解,殘留率僅有0.9%,表明PTFEMA的加入提高了LOB的可逆性,而在無PTFEMA的情況下,殘留率高達16.8%(圖3d),這在SEM圖中清晰可見(圖3e)。
3、電化學性能
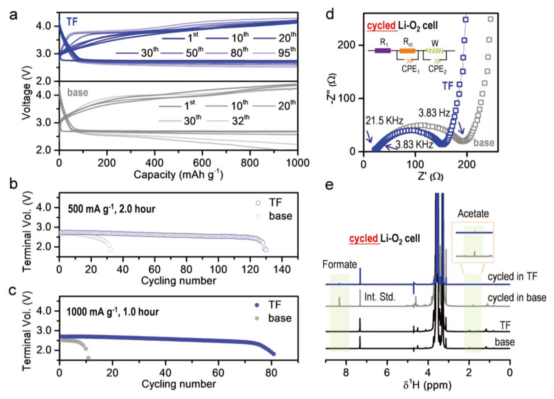
圖4.LOB的電化學性能。(a)容量為1000mAh·g-1(電流密度為500 mA·g-1)的LOB在有(藍色)無(灰色)PTFEMA下的恒流放電-充電曲線;在(b)500和(c)1000 mA·g-1的電流密度下,有無PTFEMA的LOB循環曲線,截止電壓2.0-5.0V;(d)循環20次后,LOB的交流阻抗譜和(e)1H-NMR譜圖,電流密度:0.25mA·cm-2,固定容量0.5mAh·cm-2,截止電壓2.0V-5.0V。@Wiley
研究者發現在PTFEMA存在下,在500 mA·g-1電流密度下,LOB循環次數超過120次,在沒有PTFEMA時,循環30次電池就失效了(圖4b)。在1000 mA·g-1的大電流密度下,加入PTFEMA后,電池循環性能提高了8倍(圖4c)。
20次循環后,含有PTFEMA電解液的電荷轉移阻抗值為136Ω,低于不含PTFEMA的165Ω,也說明PTFEMA的加入,加速了電荷轉移,增強了電化學動力學(圖4d)。他們利用NMR分析了循環后的正極和隔膜,發現加入PTFEMA后,Li2O2誘導羧酸鹽和LiF的生成反應均被抑制(圖4e)。而且,PTFEMA的加入顯著抑制了Li2O2的親核進攻副反應,緩解了產物穿梭對負極的腐蝕。
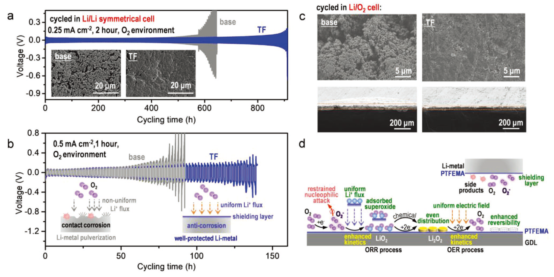
圖5.鋰金屬在氧氣中的循環穩定性和PTFEMA存在下LOB的工作機理。在(a)0.25 (2h)和(b)0.5 mA·cm-2(1h),氧氣環境,有無PTFEMA情況下,Li/Li對稱電池的恒流循環性能;(c)在LOB中鋰金屬的前視和側視圖(0.25 mA·cm-2,2 h,截止電壓2.0~5.0V);(d)PTFEMA存在下LOB的ORR/OER過程示意圖。@Wiley
在O2環境下,在0.25和0.5 mA·cm-2電流密度下,PTFEMA的存在提高了Li/Li對稱電池的循環性能,這是由于PTFEMA的存在抑制了鋰金屬表面枝晶和裂紋的產生(圖5a-b)。在負極側,由于Li+和PTFEMA的溶劑化作用,PTFEMA促進了Li+的均勻分布,循環20次后,加入PTFEMA的電池,沒有發生負極粉化和副產物的積累現象(圖2c)。
05、成果啟示
研究者合成了一種LOB電解液添加劑PTFEMA,簡便高效的解決了Li2O2導致的電極反應緩慢、可逆性差、負極易被腐蝕等問題。PTFEMA與Li+的溶劑化,提高了Li+傳輸的均勻性,Li2O2被PTFEMA分子錨定,阻止了它的親核進攻副反應,促進了它的轉化和ORR反應動力學。在1000 mA·g-1的電流密度下,加入PTFEMA后,LOB循環性能提高了8倍。
審核編輯:郭婷
-
電解液
+關注
關注
10文章
862瀏覽量
23535 -
電池
+關注
關注
84文章
11094瀏覽量
135303
原文標題:AEM:0.02wt%電解液添加劑,一舉解決鋰氧電池循環穩定性難題
文章出處:【微信號:清新電源,微信公眾號:清新電源】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
攻克鋰電池研發痛點-電解液浸潤量化表征
電解液自動再平衡技術突破!全釩液流電池長期儲能效率提升至 84.66%
超聲波焊接有利于解決固態電池的枝晶問題
調控磷酸酯基阻燃電解液離子-偶極相互作用實現鈉離子軟包電池安全穩定運行
朗凱威鋰電池組生產廠家全面解析:圓柱鋰電池和軟包鋰電池哪個壽命長?
水系電解液寬電壓窗口設計助力超長壽命水系鈉離子電池
高穩定性富鋰錳基正極材料

一種新型的鈉金屬電池負極穩定化策略
鈣鈦礦太陽能電池穩定性測試的最大功率點跟蹤(MPPT)
























評論