原發(fā)結(jié)直腸癌根治性切除術(shù)后的患者在幾年后復(fù)發(fā)轉(zhuǎn)移,轉(zhuǎn)移的CRC病理分期不一,其中會(huì)有40%的III期CRC患者,尋找預(yù)防CRC復(fù)發(fā)的療法仍然迫在眉睫。
為了探究復(fù)發(fā)CRC的細(xì)胞來(lái)源,本文研究者首先在單細(xì)胞水平分析了預(yù)后不良CRC患者的轉(zhuǎn)錄組特征,共確定了2530個(gè)預(yù)測(cè)復(fù)發(fā)的基因,然后在兩個(gè)單細(xì)胞轉(zhuǎn)錄組數(shù)據(jù)中發(fā)現(xiàn)這些預(yù)后不良基因在CAF、內(nèi)皮和髓系細(xì)胞高表達(dá),在腫瘤上皮細(xì)胞中有99個(gè)復(fù)發(fā)相關(guān)基因(EpiHR)上調(diào),并且在腫瘤微環(huán)境中的高風(fēng)險(xiǎn)基因和上皮細(xì)胞中的EpiHR是兩個(gè)獨(dú)立的風(fēng)險(xiǎn)因素,結(jié)合在單細(xì)胞結(jié)果中基于EpiHR定義了高復(fù)發(fā)細(xì)胞,在這些細(xì)胞中缺氧相關(guān)基因、細(xì)胞粘附以及細(xì)胞外基質(zhì)、肌動(dòng)蛋白和調(diào)節(jié)細(xì)胞遷移相關(guān)基因顯著富集,但這群細(xì)胞和LGR5+干細(xì)胞樣腫瘤細(xì)胞群并不是同一群細(xì)胞。
接著作者將AKTP小鼠腫瘤類(lèi)器官打入小鼠盲腸構(gòu)建了類(lèi)人轉(zhuǎn)移型CRC模型,然后對(duì)轉(zhuǎn)移細(xì)胞進(jìn)行分析,在肝臟中發(fā)現(xiàn)的大轉(zhuǎn)移灶細(xì)胞群特征和原位CRC非常相似,微轉(zhuǎn)移灶確富集了大量高增值水平的HRC細(xì)胞,小轉(zhuǎn)移灶中主要包含LGR5+干細(xì)胞樣細(xì)胞,基于cell rank細(xì)胞軌跡算法發(fā)現(xiàn)HRC細(xì)胞是AKTP CRC轉(zhuǎn)移的源頭,并在HRC發(fā)現(xiàn)了顯著高表達(dá)基因EMP1,接著作者對(duì)這個(gè)基因的功能進(jìn)行驗(yàn)證,發(fā)現(xiàn)EMP1-TOM-high的細(xì)胞處于侵襲部位的前沿以及腫瘤出芽部位,并且EMP1+HRC細(xì)胞驅(qū)動(dòng)轉(zhuǎn)移復(fù)發(fā),但是其在轉(zhuǎn)移定植完成后就不是必需的,HRC細(xì)胞剔除后轉(zhuǎn)移數(shù)量顯著減少。
如果在切除原位腫瘤之前給與PD-1和CTLA-4抗體治療,不會(huì)降低腫瘤的生長(zhǎng)速度,但是卻能在腫瘤切除后減少轉(zhuǎn)移復(fù)發(fā)。主要是由于在腫瘤切除前給與治療可以增加原位腫瘤中CD8+T細(xì)胞數(shù)量,減少HRC細(xì)胞免疫逃逸。而在肝臟這些轉(zhuǎn)移器官中,在轉(zhuǎn)移初期還未形成成熟的腫瘤微環(huán)境來(lái)激活抗腫瘤免疫反應(yīng)。
總之本研究通過(guò)CRC類(lèi)人小鼠轉(zhuǎn)移復(fù)發(fā)模型,揭示了HRC細(xì)胞轉(zhuǎn)移定植的關(guān)鍵基因EMP1,靶向HRC的治療能夠有助于減少轉(zhuǎn)移性復(fù)發(fā)CRC。
02
單細(xì)胞測(cè)序揭示獨(dú)特的成纖維細(xì)胞祖細(xì)胞亞群通過(guò)免疫調(diào)節(jié)加速再生粘膜愈合
因纖維化而愈合的損傷會(huì)損害器官功能,增加患者發(fā)病率。口腔黏膜屏障具有很高的再生能力和最小的疤痕,但細(xì)胞機(jī)制仍然難以捉摸。
在此研究中,研究者確定了Prx1+(postnatal paired-related homeobox-1+)細(xì)胞作為一個(gè)關(guān)鍵的成纖維細(xì)胞亞群,通過(guò)促進(jìn)早期免疫反應(yīng)來(lái)加速粘膜愈合。通過(guò)小鼠移植和基因消融模型,研究者發(fā)現(xiàn)富含Prx1+細(xì)胞的口腔黏膜比缺乏Prx1+細(xì)胞的愈合更快。譜系追蹤和scRNA-seq揭示Prx1+成纖維細(xì)胞在生理和損傷條件下表現(xiàn)出祖細(xì)胞特征。
在機(jī)制上,Prx1+祖細(xì)胞通過(guò)分化為免疫調(diào)節(jié)的SCA1+成纖維細(xì)胞來(lái)加速傷口愈合,SCA1+成纖維細(xì)胞通過(guò)CCL2啟動(dòng)巨噬細(xì)胞招募,作為促傷口愈合反應(yīng)的關(guān)鍵部分。此外,與小鼠相比,人類(lèi)Prx1+成纖維細(xì)胞具有相似的基因和空間分布。
因此,研究者的數(shù)據(jù)揭示了粘膜傷口愈合的機(jī)制和特異性口腔成纖維細(xì)胞對(duì)快速先天免疫反應(yīng)和隨后炎癥的解決的直接免疫調(diào)節(jié)作用。
03
單細(xì)胞+轉(zhuǎn)錄組測(cè)序:揭示GABA信號(hào)調(diào)控神經(jīng)發(fā)生
GABA是一種能夠影響神經(jīng)發(fā)生的神經(jīng)遞質(zhì),GABA受體支持祖細(xì)胞和遷移神經(jīng)元中的非突觸信號(hào)。本研究報(bào)道了地西泮結(jié)合抑制劑(DBI)的表達(dá)水平,能夠調(diào)節(jié)GABA信號(hào)的內(nèi)多肽,調(diào)節(jié)胚胎神經(jīng)發(fā)生,影響出生后小鼠大腦中神經(jīng)元數(shù)量的長(zhǎng)期結(jié)果。
研究結(jié)果證明了DBI在胚胎小鼠大腦生發(fā)區(qū)的徑向膠質(zhì)細(xì)胞和中間祖細(xì)胞中高表達(dá),從而產(chǎn)生興奮性和抑制性細(xì)胞。DBI控制神經(jīng)發(fā)生的機(jī)制主要表現(xiàn)為在表達(dá)包含γ2亞基的GABAA受體的祖細(xì)胞上,作為GABA誘導(dǎo)的電流的負(fù)變構(gòu)調(diào)節(jié)器。
DBI的調(diào)節(jié)作用與這些細(xì)胞增殖區(qū)中GABAA受體介導(dǎo)的信號(hào)傳導(dǎo)相似,反映了DBI對(duì)胚胎神經(jīng)發(fā)生的嚴(yán)格控制。
04
GUT | 原發(fā)性和復(fù)發(fā)性肝癌的免疫微環(huán)境研究助力免疫治療
HCC患者復(fù)發(fā)根據(jù)發(fā)生時(shí)間分為兩種:真正的腫瘤復(fù)發(fā)(由原發(fā)腫瘤擴(kuò)散引起,治療后<2年,也稱(chēng)早期復(fù)發(fā))和新生癌癥(由受損的肝實(shí)質(zhì)新產(chǎn)生,治療后>2年,也稱(chēng)晚期復(fù)發(fā))。從其生物學(xué)特征區(qū)分這些類(lèi)型的復(fù)發(fā)至關(guān)重要,先前的研究表明,通過(guò)進(jìn)化軌跡和基因組異質(zhì)性來(lái)區(qū)分真正復(fù)發(fā)性和新生性HCC可能比臨床定義更可靠。
最近的一項(xiàng)研究使用單細(xì)胞RNA測(cè)序(scRNA-seq)揭示了原發(fā)腫瘤與早期復(fù)發(fā)HCC的免疫生態(tài)系統(tǒng)的差異,然而,從頭復(fù)發(fā)的HCC的TIME尚未被描述。因此,解剖兩種HCC復(fù)發(fā)的免疫生態(tài)系統(tǒng)可以為這些實(shí)體之間的免疫逃避機(jī)制的異質(zhì)性提供新的見(jiàn)解。
在本文中研究人員通過(guò)使用全外顯子組測(cè)序?qū)Τ蓪?duì)原發(fā)性和復(fù)發(fā)性HCC樣本的突變譜和進(jìn)化軌跡進(jìn)行分析,確定了從頭復(fù)發(fā)和真正復(fù)發(fā),然后對(duì)來(lái)自20例復(fù)發(fā)性HCC患者的34個(gè)樣本進(jìn)行了5'和VDJ單細(xì)胞RNA測(cè)序,細(xì)胞軌跡分析發(fā)現(xiàn)真正復(fù)發(fā)的HCC的TIME的特征是具有記憶表型和低細(xì)胞毒性的KLRB1+CD8+ T細(xì)胞的豐度增加。
而在新生復(fù)發(fā)HCC的TIME中細(xì)胞毒性和耗盡的CD8+ T細(xì)胞富集。進(jìn)一步通過(guò)轉(zhuǎn)錄組學(xué)和細(xì)胞相互作用分析發(fā)現(xiàn)在與樹(shù)突狀細(xì)胞存在互作的HCC細(xì)胞上GDF15表達(dá)升高,這可能抑制了抗原提呈,并抑制了真正復(fù)發(fā)性病變的抗腫瘤免疫。在從頭復(fù)發(fā)的HCC中,骨髓細(xì)胞與T細(xì)胞的互作介導(dǎo)的T細(xì)胞衰竭和免疫抑制。
文章還對(duì)來(lái)自?xún)蓚€(gè)驗(yàn)證隊(duì)列的樣本進(jìn)行了大量RNA測(cè)序、流式細(xì)胞術(shù)、多重免疫熒光和體外功能分析,來(lái)驗(yàn)證這一結(jié)果。
總之,這項(xiàng)研究為基于HCC復(fù)發(fā)類(lèi)型和特定時(shí)間的指導(dǎo)免疫治療提供了基因組診斷和免疫譜分析的來(lái)源。
05
結(jié)合單細(xì)胞和空間轉(zhuǎn)錄組學(xué)揭示乳腺癌早期傳播過(guò)程中的代謝演變
乳腺癌現(xiàn)在是最常診斷的惡性腫瘤,轉(zhuǎn)移仍然是乳腺癌死亡的主要原因。然而,人們對(duì)傳播過(guò)程中的動(dòng)態(tài)變化卻知之甚少。在這項(xiàng)研究中,研究者使用單細(xì)胞RNA測(cè)序(scRNA-seq)和空間轉(zhuǎn)錄組學(xué)對(duì)來(lái)自4名乳腺癌患者和成對(duì)轉(zhuǎn)移性腋窩淋巴結(jié)的65968個(gè)細(xì)胞進(jìn)行了分析。
一種具有高水平氧化磷酸化(OXPHOS)的彌散性癌細(xì)胞簇,包括細(xì)胞色素C氧化酶亞基6C和脫氫酶/還原酶2顯示上調(diào)。糖酵解和OXPHOS傳播開(kāi)始時(shí)的過(guò)渡被注意到。此外,這種獨(dú)特的細(xì)胞簇沿腫瘤前緣分布。這里的發(fā)現(xiàn)在三個(gè)不同的乳腺癌患者隊(duì)列和外部scRNA-seq數(shù)據(jù)集中得到了驗(yàn)證,其中包括8名乳腺癌患者和配對(duì)的轉(zhuǎn)移性腋窩淋巴結(jié)。
這項(xiàng)工作描述了早期播散性乳腺癌的動(dòng)態(tài)代謝演變,并揭示了乳腺癌細(xì)胞中糖酵解和OXPHOS之間的轉(zhuǎn)換作為淋巴結(jié)轉(zhuǎn)移的早期事件。
審核編輯:劉清
-
crc
+關(guān)注
關(guān)注
0文章
199瀏覽量
29477 -
HRC
+關(guān)注
關(guān)注
0文章
6瀏覽量
6352
發(fā)布評(píng)論請(qǐng)先 登錄
相關(guān)推薦
活細(xì)胞的“聚光燈”——前沿活細(xì)胞成像的案例分享

ATG-2000系列功率信號(hào)源在介電電泳細(xì)胞分選測(cè)試中的應(yīng)用

神經(jīng)元是什么?神經(jīng)元在神經(jīng)系統(tǒng)中的作用
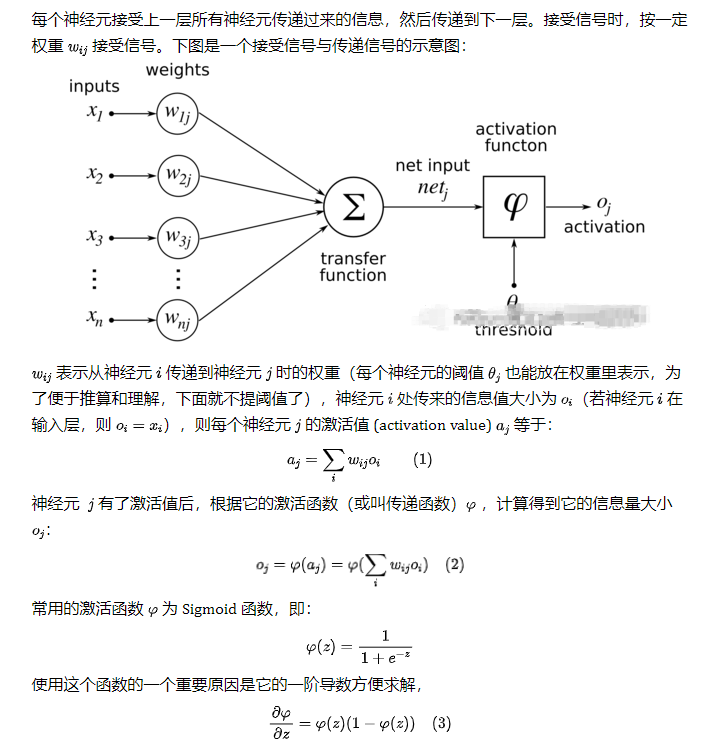
生物神經(jīng)元模型包含哪些元素
神經(jīng)元的基本結(jié)構(gòu)包括哪三部分
神經(jīng)元的分類(lèi)包括哪些
神經(jīng)元的結(jié)構(gòu)及功能是什么
神經(jīng)元的基本作用是什么信息
神經(jīng)元的信息傳遞方式是什么
利用微流控探針誘導(dǎo)的化學(xué)質(zhì)膜穿孔,實(shí)現(xiàn)單細(xì)胞胞內(nèi)蛋白質(zhì)遞送
一種用于微液滴中單細(xì)胞無(wú)標(biāo)記分析的液滴篩選(LSDS)方法
基于雙極性電極陣列的微流控芯片,可實(shí)現(xiàn)細(xì)胞可控、非接觸三維旋轉(zhuǎn)

高通量測(cè)序技術(shù)及原理介紹
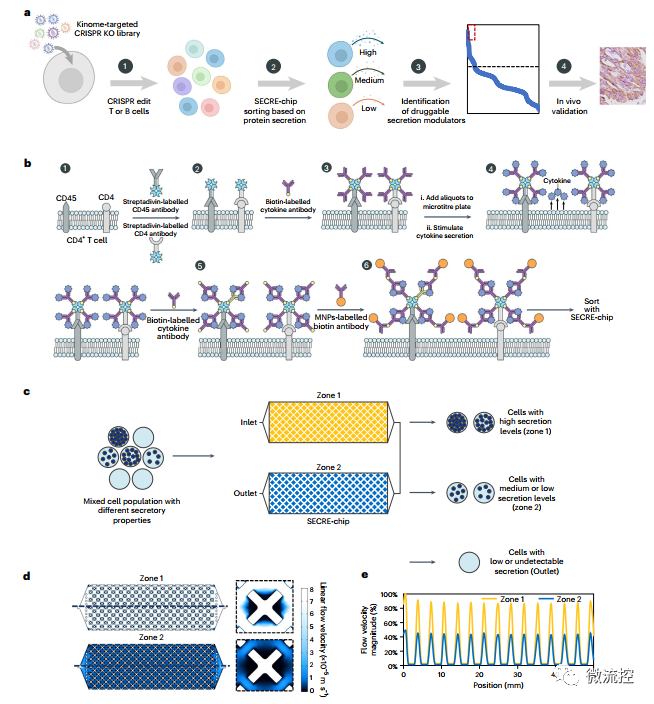
如何利用磁性微流控系統(tǒng)實(shí)現(xiàn)免疫細(xì)胞分泌行為的定量檢測(cè)呢?




 單細(xì)胞+轉(zhuǎn)錄組測(cè)序揭示GABA信號(hào)調(diào)控神經(jīng)發(fā)生
單細(xì)胞+轉(zhuǎn)錄組測(cè)序揭示GABA信號(hào)調(diào)控神經(jīng)發(fā)生










評(píng)論