癌癥的篩查、早期診斷、預后監(jiān)測等一直是科學難題。最常見的癌癥診斷方法主要是基于組織活檢,這種侵入性方法非常耗時,并且在某些患者中存在潛在風險,因此不適合用于監(jiān)測腫瘤的發(fā)展過程。
此外,組織活檢會增加癌癥轉(zhuǎn)移的可能性,并且部分腫瘤并不總是易于活檢取樣。
因此,監(jiān)測癌癥的持續(xù)發(fā)展,需要利用具有高靈敏度、特異性且低成本的“液體活檢”技術(shù)來解決。
液體活檢作為一種非侵入式的血液檢測技術(shù),能監(jiān)測腫瘤或者轉(zhuǎn)移灶釋放到血液的循環(huán)腫瘤細胞(CTC)、細胞外囊泡(EV)和蛋白標志物,是檢測腫瘤和癌癥輔助治療的突破性技術(shù)。
與傳統(tǒng)的組織活檢相比,液體活檢以速度快、樣本易獲取,損傷小等特點成為了一種新興的癌癥診斷方法,近年來備受關(guān)注。
中山大學藥學院張元慶教授團隊長期開發(fā)各類微流控芯片進行液體活檢的研究,主要針對循環(huán)腫瘤細胞和外泌體等生物標志物的檢測,通過引入一系列的DNA納米技術(shù)的信號放大策略實現(xiàn)高靈敏的靶標檢測。
許多研究表明,腫瘤來源細胞外囊泡(tEVs)生物標志物可以反映癌細胞的表型,在癌癥的診斷和治療中具有很大的潛力。
然而,tEVs表現(xiàn)出高度的異質(zhì)性,由于其低表達,快速、敏感地識別tEVs生物標志物仍然具有挑戰(zhàn)性。
熒光光譜的重疊也顯著限制了熒光探針對tEVs生物標志物的多重分析。
因此,開發(fā)一種高靈敏多表型tEVs的分析方法可以提高疾病診斷的準確率和實時監(jiān)測疾病的進展,從而為患者制定精準治療的方案,以達到最佳的臨床效果。
目前用于tEVs分析的方法大多還側(cè)重于單個生物標志物的特異性識別,忽略了tEVs的異質(zhì)性,并可能遺漏有關(guān)疾病進展的重要信息,導致其tEVs識別的準確性不足。
此外tEVs的異質(zhì)性也會阻礙tEVs的識別和信號讀出。
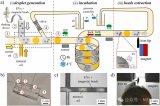
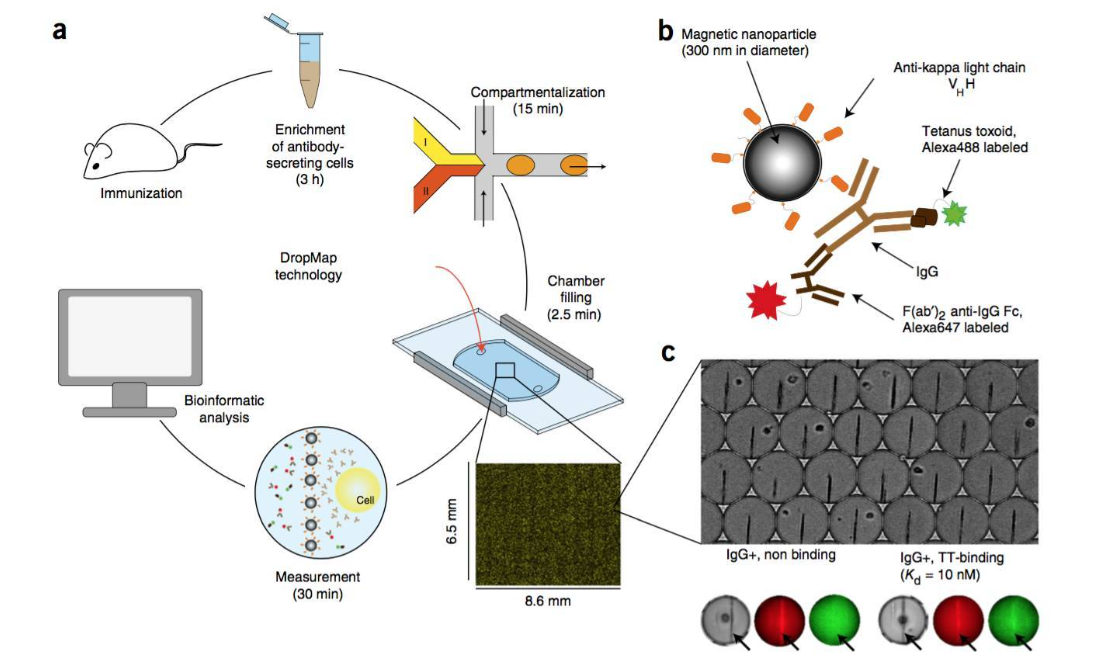
近期,張元慶教授課題組與中山大學中山醫(yī)學院吳敏昊教授課題組以及美國杜蘭大學胡曄教授課題組合作,利用微流控芯片中不同尺寸間隙的微柵欄結(jié)構(gòu)對不同尺寸的微球進行排布和分選的策略,開發(fā)了一種簡便靈活的多重tEVs表型分析方法,實現(xiàn)了高選擇性和敏感性的tEVs的原位捕獲,進而實現(xiàn)多個信號的同時讀出。
該方法使用特異性發(fā)夾探針編碼不同尺寸的微球,從而可以捕獲不同表型的tEVs。
此外,在芯片中設計了不同尺寸間隙的微柵欄結(jié)構(gòu)對微球進行排布和分選,以生成特定位置的信號,指示不同tEVs生物標志物的水平。
同時,進一步利用原位滾環(huán)擴增技術(shù)對這些微球上的tEVs生物標志物信號進行放大。
該策略允許通過熒光同時檢測多種tEVs表型,而不受光譜重疊的限制。
該研究表明,該方法能快速、高靈敏度地同時檢測6種不同的tEVs表型。
由于傳感平臺的可編程性,該方法可以快速適用于檢測不同tEVs表型的替代檢測生物標志物。
值得注意的是,臨床研究表明,該策略可能為癌癥患者的精準診斷和個性化治療提供新的思路。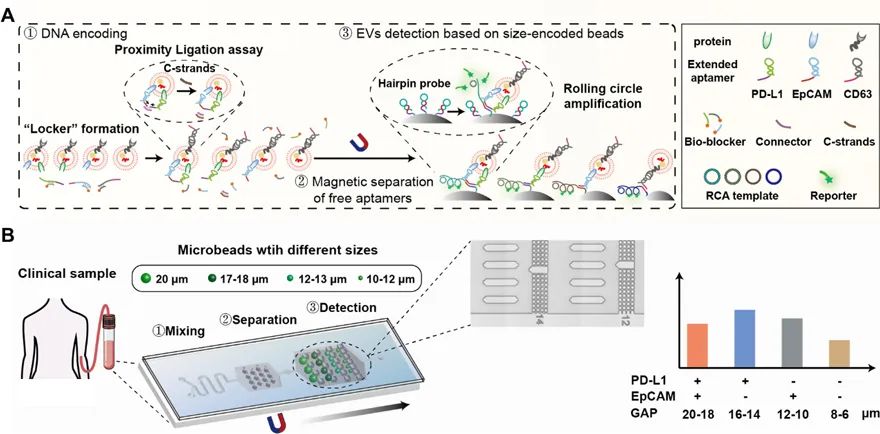
圖1 利用尺寸編碼的親和微球鑒定腫瘤來源的細胞外囊泡的表型
這項工作是基于該課題組幾個月前發(fā)表在Angew Chem Int Ed Engl.上的一個工作的延伸和發(fā)展。
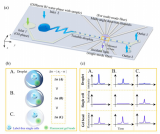
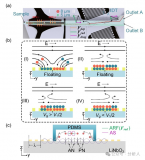
該課題組先前提出了一種基于芯片中不同尺寸間隙的微柵欄結(jié)構(gòu)對微球進行排布和分選的策略,該策略利用顏色和尺寸編碼的微球開發(fā)了一種簡便靈活的多重免疫分析方法,進行新冠肺炎血清學抗體和炎癥標志物的定量檢測(圖2)。通過將兩種不同顏色的量子點按不同比例導入到不同尺寸的聚苯乙烯微球中,構(gòu)建了基于顏色和尺寸雙重編碼的微球庫。
隨后在芯片中通過不同尺寸間隙的微柵欄結(jié)構(gòu)對微球進行排布和分選,并利用滾環(huán)擴增方法在微球的免疫復合物上偶聯(lián)有大量熒光分子的長DNA串聯(lián)體,進而對靶標分子進行信號放大,達到比常規(guī)方法更低的檢測限。
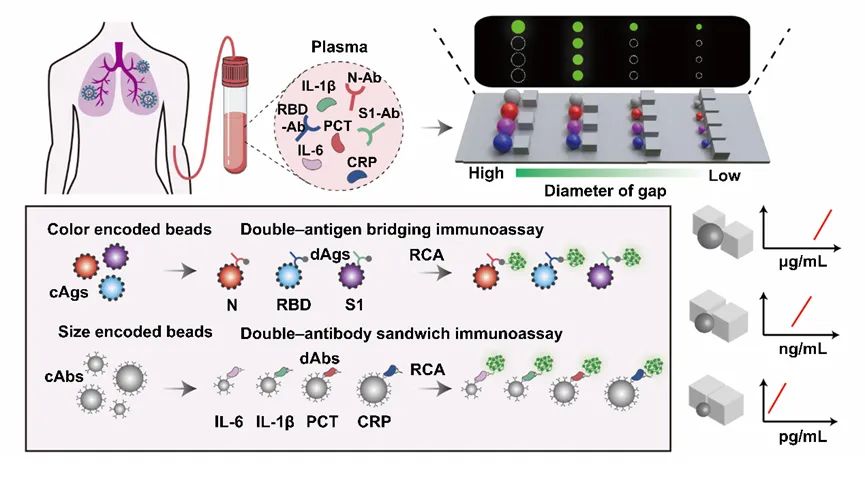
圖2 一種基于雙重編碼微球和滾環(huán)擴增的多重分析方法用于新冠血清學評估
審核編輯:劉清
-
編碼器
+關(guān)注
關(guān)注
45文章
3662瀏覽量
135010 -
微流控芯片
+關(guān)注
關(guān)注
13文章
278瀏覽量
18873
原文標題:基于微流控芯片的異質(zhì)性細胞外囊泡精準分離和定量分析
文章出處:【微信號:Micro-Fluidics,微信公眾號:微流控】歡迎添加關(guān)注!文章轉(zhuǎn)載請注明出處。
發(fā)布評論請先 登錄
相關(guān)推薦
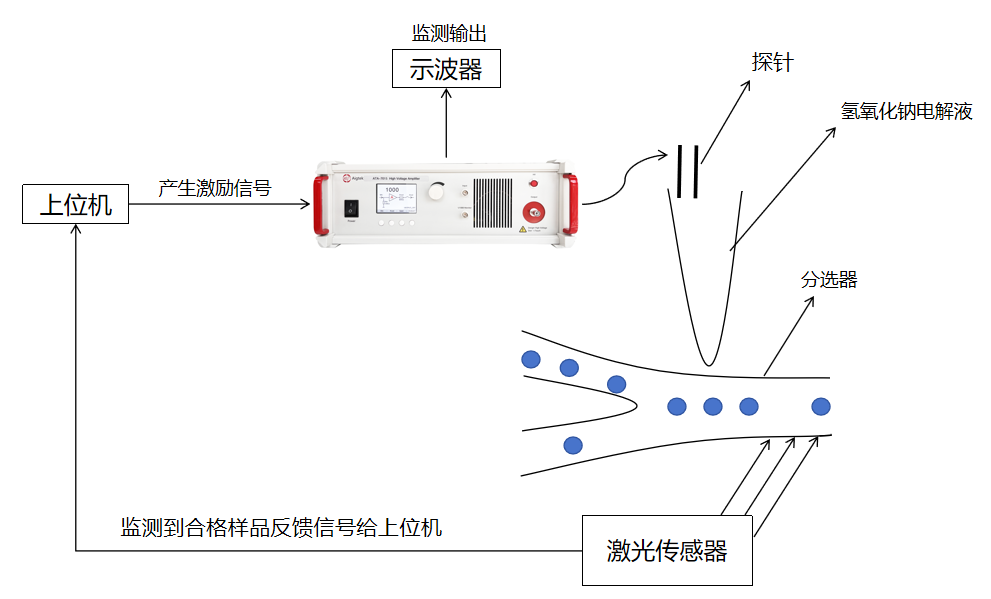
Aigtek高壓放大器在介電泳的微流控細胞分離技術(shù)中的應用
S型微流控芯片的優(yōu)勢
ATG-2000系列功率信號源在介電電泳細胞分選測試中的應用

COC/COP微流控芯片開發(fā)與應用
液滴微流控技術(shù)在癌癥研究中的應用:從單細胞分析到3D細胞培養(yǎng)
集成片上樣品富集模塊的液滴微流控器件,用于單細胞的高效率封裝
淺談微流控芯片技術(shù)





 淺析基于微流控芯片的異質(zhì)性細胞外囊泡精準分離和定量方法
淺析基于微流控芯片的異質(zhì)性細胞外囊泡精準分離和定量方法











評論