大腦內膠質細胞之間的相互作用異常會導致神經疾病,如多發性硬化癥(MS)及其自身免疫性腦脊髓炎(EAE)。表征星形膠質細胞-小膠質細胞相互作用是重要的治療靶點之一。然而,目前的方法并不能直接反映細胞互作與分子水平變化的相關性,并且難以檢測由表面或分泌因子介導瞬時的細胞互作,因此檢測方法亟需改進。
正向遺傳篩選平臺,例如基于CRISPR-Cas9系統的平臺,雖然是鑒定基因的強大工具,但無法進行高通量共培養和受擾動單細胞的篩選,限制了它們在研究細胞互作中的應用。用于研究細胞互作的正向遺傳篩選平臺需要能夠在受控微環境中建立由表面或分泌因子介導的細胞互作,同時需要能夠檢測由這些互作產生的現象,并確定這些變化是否由特定CRISPR-Cas9誘導。
近期,來自哈佛醫學院的Francisco J. Quintana團隊在Science上發表了題為“Droplet-based forward genetic screening of astrocyte–microglia cross-talk”的文章,展示了一種基于液滴微流控技術的高通量平臺“SPEAC-seq”,可以用于細胞互作的正向遺傳篩選。
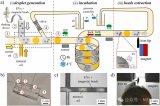
研究人員首先將兩種細胞用微流體進行共封包形成油包液滴并在試管中共培養,接著經三色光學器件和介電泳微流控分選儀篩選出成功封包細胞對的液滴,用于后續細胞互作的研究。隨后使用具有細胞滲透性的熒光染料進行多重標記,用于加樣和檢測液滴中的細胞對。圖1F顯示了優化液滴分選參數后,分離出的報告基因激活的細胞對,初步檢測到與激活的巨噬細胞配對的NF-kB標記的星形膠質細胞中,EGFP表達的上調。以上說明研究人員成功建立了基于油包液滴的共培養體系。
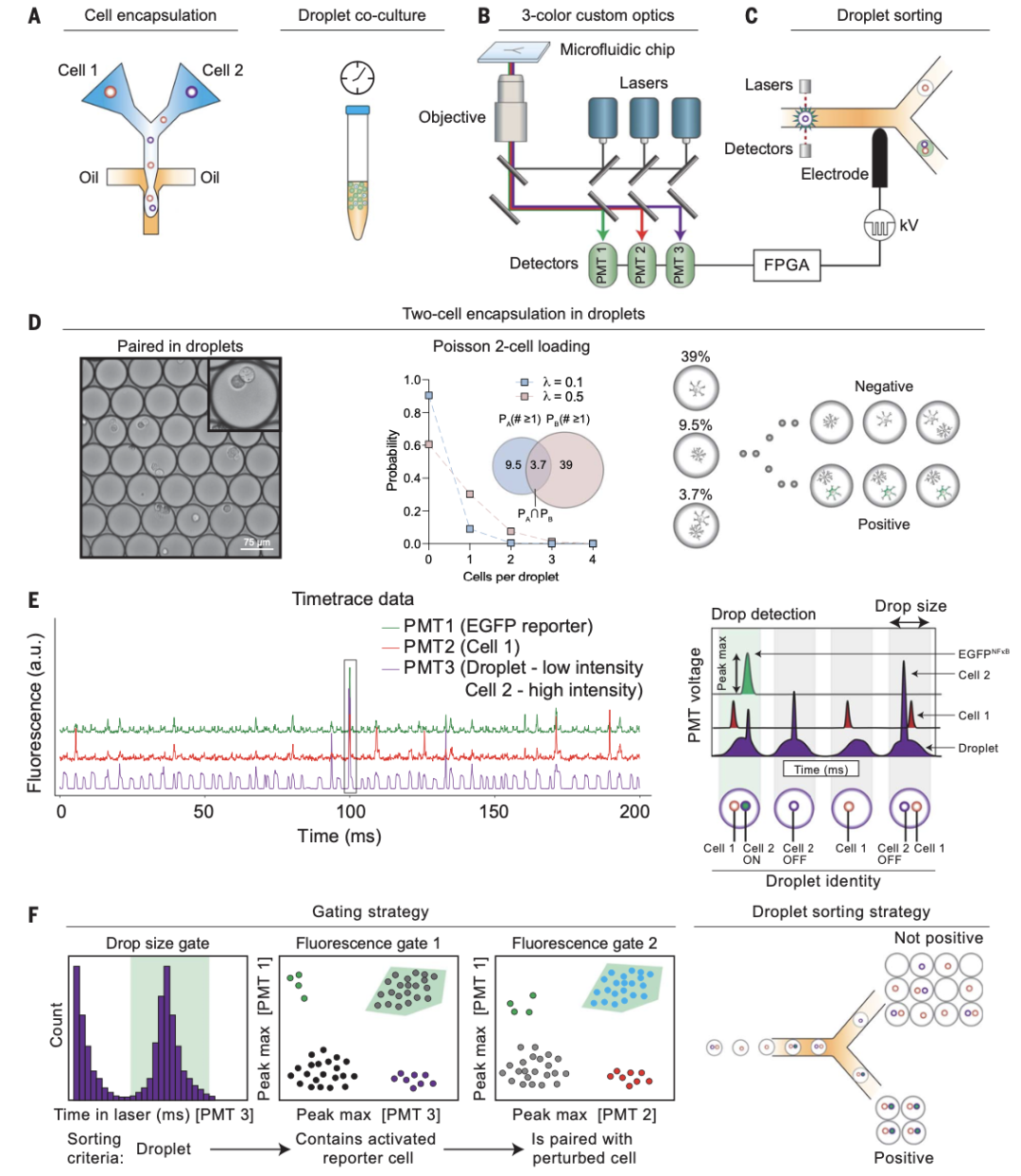
圖1 基于液滴微流控技術的細胞互作篩選平臺示意圖
接下來,研究人員將基于液滴的共培養系統與CRISPR-Cas9基因編輯技術相結合,建立了SPEAC-seq平臺,用于檢測細胞互作的正向遺傳篩選,并將其應用于鑒定參與抑制星形膠質細胞中NF-kB激活的小膠質細胞分泌的細胞因子。研究人員使用全基因組CRISPR-Cas9文庫轉導原代小鼠小膠質細胞,并使用嘌呤霉素篩選出穩定轉導的小膠質細胞,并將其與NF-kB報告的星形膠質細胞共封裝24小時,然后分選含有由小膠質細胞和EGFP+星形膠質細胞組成的活細胞對的液滴。
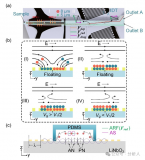
通過基因組DNA聚合酶鏈反應(PCR)擴增和深度測序從少量分選的液滴中分選出了穩定摻入小膠質細胞基因組DNA的單向導RNA(sgRNA) 序列,用于分析針小膠質細胞中負調節星形膠質細胞NF-kB因子的sgRNA,最終得到了1061個候選分子的列表。對正液滴分數的分析發現了已知的NF-kB信號轉導負調節因子,包括異生物質代謝、核受體激活和NRF2信號轉導,分選到的液滴數量和檢測到的引導RNA序列的數量高度一致。圖2G顯示了用生信分析發現了SPEAC-seq檢測到的抑制星形膠質細胞NF-kB激活的途徑。
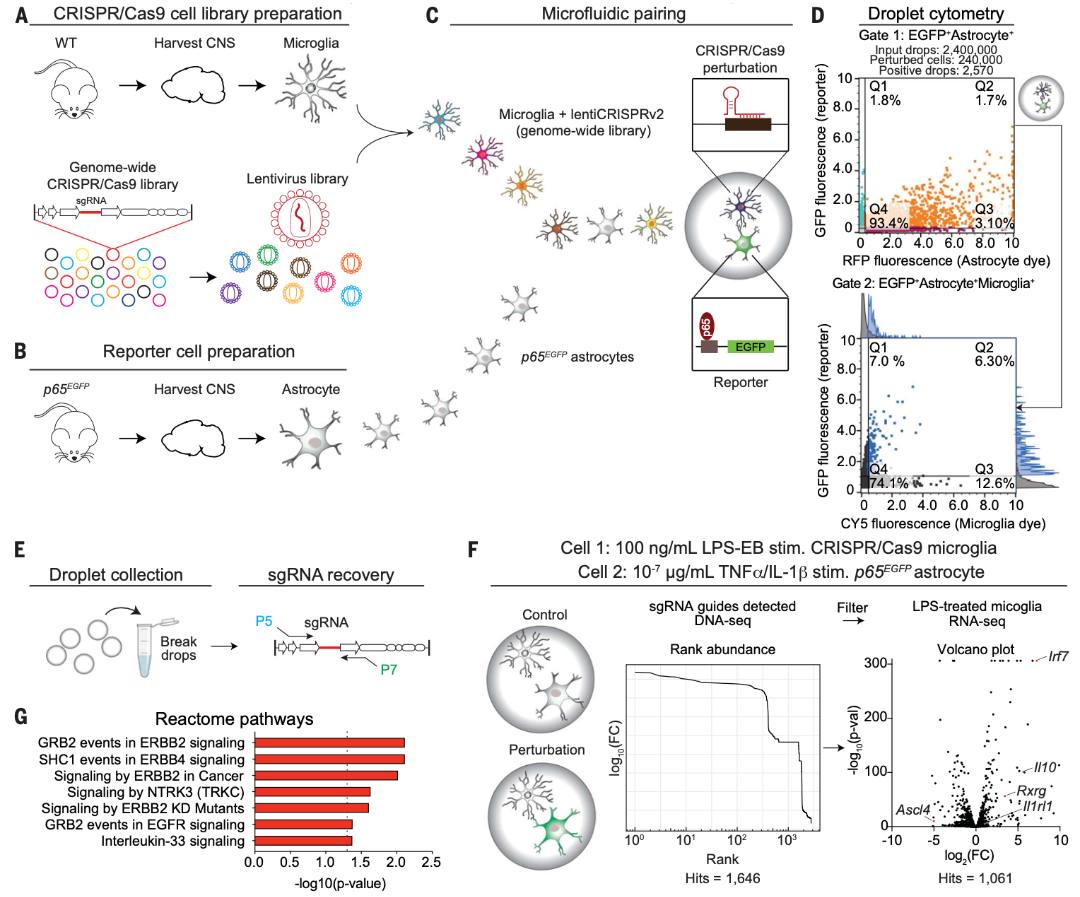
圖2 SPEAC-seq鑒定小膠質細胞中抑制星形膠質細胞促炎反應的因子
為了進一步評估SPEAC-seq發現的每個候選通路在炎癥環境下的調節作用,研究人員應用了一種細胞類型特異性的體內Perturb-seq方法。研究人員設計了慢病毒載體共表達四種sgRNA,這些sgRNA靶向星膠特異的Cas9開放閱讀框中的barcode,分別對應Egfr、Gfra2、Lag3、Oprl1這四種星膠受體。小鼠自身免疫性腦脊髓炎(EAE)造模后,用流式分選出EGFP陽性的星膠膠質細胞進行SPEAC-seq檢測。
結果顯示,表達Egfr、Gfra2、Lag3或Oprl1的sgRNA的星形膠質細胞NF-kB轉錄激活增加,Egfr靶向導致IL-1b/TNFa信號通路的激活最強,從而促進NF-kB轉導的與EAE和MS相關的星形膠質細胞反應。雙調蛋白可在中風期間導致外周和中樞神經系統的炎癥,這表明它是在對創傷和/或炎癥的反應中被誘導產生的。
確實,EAE誘導后17天檢測到小膠質細胞中Areg表達增加。與SPEAC-seq數據一致,Egfr在星形膠質細胞中的表達水平高于在小膠質細胞中的表達水平。以上結果說明了在EAE模型中,小膠質細胞分泌的AREG通過星膠EGFR受體抑制星膠的促炎反應。
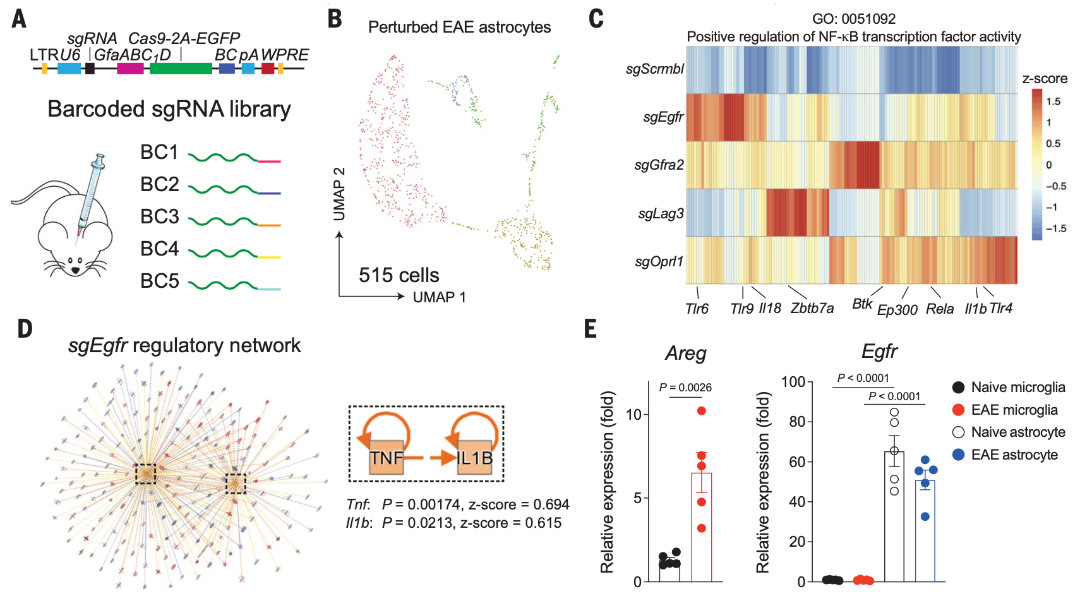
圖3 小膠質細胞分泌的AREG抑制星形膠質細胞促炎反應
最后,研究人員想探索EAE期間,什么病理因素可誘導小膠質細胞Areg的表達。已有研究表明IL-33是EAE的抑制劑,Areg表達的誘導劑。IL-33是組織損傷后細胞釋放的一種警報素。為了確定IL-33是否調節AREG介導的小膠質細胞-星形膠質細胞互作,研究人員首先重新分析了RABID-seq數據集,并確定了在EAE峰值期間與Areg+和Areg-小膠質細胞相關的小膠質細胞-星形膠質細胞相互作用,提示了EAE期間星膠分泌的IL-33信號是調節Areg+小膠質細胞的上游因子。為了驗證這種RABID-seq預測,研究人員在體外用重組IL-33刺激原代小膠質細胞,檢測到小膠質細胞Areg/AREG表達增加。這些發現表明星膠產生的IL-33誘導的小膠表達Areg,然后抑制星膠的促炎作用這樣的一個負反饋調節。
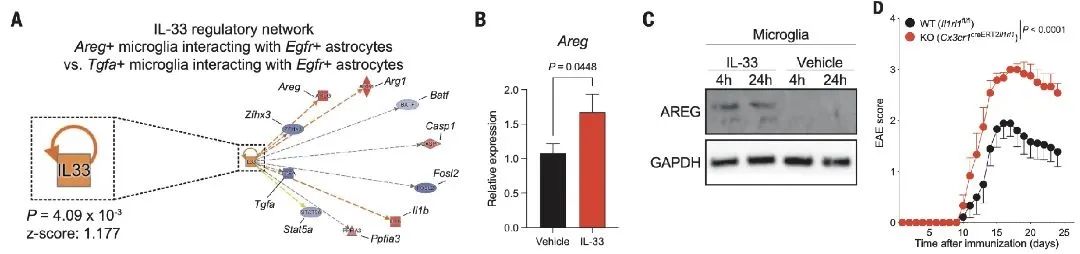
圖4 IL-33-ST2信號通路控制星形膠質細胞-小膠質細胞互作
此外,研究人員還在MS患者病變中檢測到IL33+GFAP+細胞和AREG+小膠質細胞增加,以及小膠質細胞ST2(IL-33 受體)介導的絲裂原活化蛋白激酶信號增加,以上結果表明了星膠來源的IL-33可促進ST2+小膠細胞中AREG的表達。
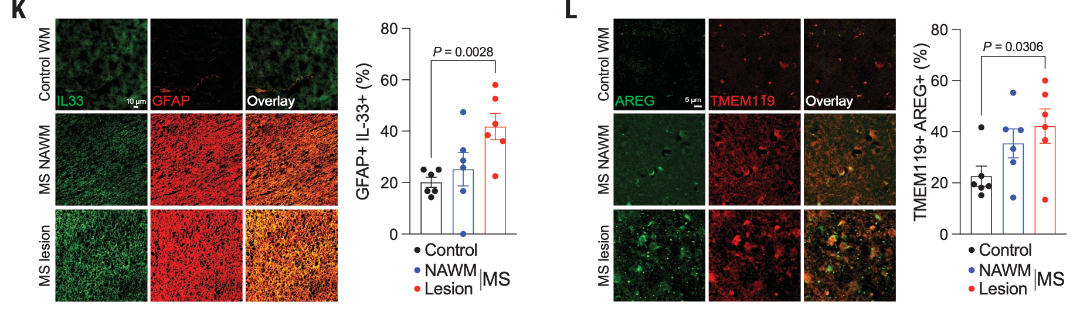
圖5 免疫染色檢測MS患者CNS樣本中的IL33+星形膠質細胞
綜上所述,該研究基于液滴微流控技術建立了可以用于檢測細胞互作的SPEAC-seq平臺,它能夠進行正向遺傳篩選以識別細胞通訊機制,并確定了一個由小膠質細胞-星形膠質細胞相互作用驅動的調節負反饋回路,該相互作用由雙調蛋白和IL33-ST2信號介導,抑制了星形膠質細胞NF-kB驅動的炎癥反應,可能是導致EAE和MS的原因之一。SPEAC-seq可以與表觀基因組或轉錄組的全基因組分析相結合,以研究它們通過細胞間相互作用的調控,或與抗體或小分子barcode文庫,用于識別細胞間通訊的治療靶點。
審核編輯:劉清
-
PCR
+關注
關注
0文章
118瀏覽量
19588 -
微流控
+關注
關注
16文章
526瀏覽量
18886
原文標題:基于液滴微流控的SPEAC-seq平臺,用于細胞互作的正向遺傳篩選
文章出處:【微信號:Micro-Fluidics,微信公眾號:微流控】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
如何進行元器件篩選?

應用于活細胞成像的一次性細胞培養芯片
使用原代腫瘤細胞進行藥物篩選的數字微流控系統
活細胞的“聚光燈”——前沿活細胞成像的案例分享

互阻和互導放大電路模型分析
互阻放大電路和互導放大電路基本特性
互阻放大電路適用于什么情況
請問能將互阻放大電路用于電流互感器的檢測,要求能檢測到1KHz的nA級別電流?
光遺傳學 – 用光控制細胞和動物

基于雙極性電極陣列的微流控芯片,可實現細胞可控、非接觸三維旋轉

mapgis屬性篩選表達式
熒光顯微鏡細胞圖像檢測實戰




 用于細胞互作正向遺傳篩選的SPEAC-seq平臺
用于細胞互作正向遺傳篩選的SPEAC-seq平臺










評論