第一作者:Gustavo M. Hobold
通訊作者:Betar M. Gallant
通訊單位:美國麻省理工學院
【研究背景】
鋰金屬負極作為當今最引人注目的替代石墨負極的候選者,在滿足鋰離子電池能量密度(>500 Wh/kg)方面發揮著重要作用,但其還未達到實現長循環壽命和庫倫效率(CE)要求。其中,低CE主要源于SEI的不穩定,一個好的SEI不僅能夠穩定和保護沉積的Li,還調節電解液和電極之間的Li+傳輸。因此,SEI對界面的輸運和動力學產生深遠的影響。然而,迄今為止Li+交換和CE之間的關系還沒有明確闡明。
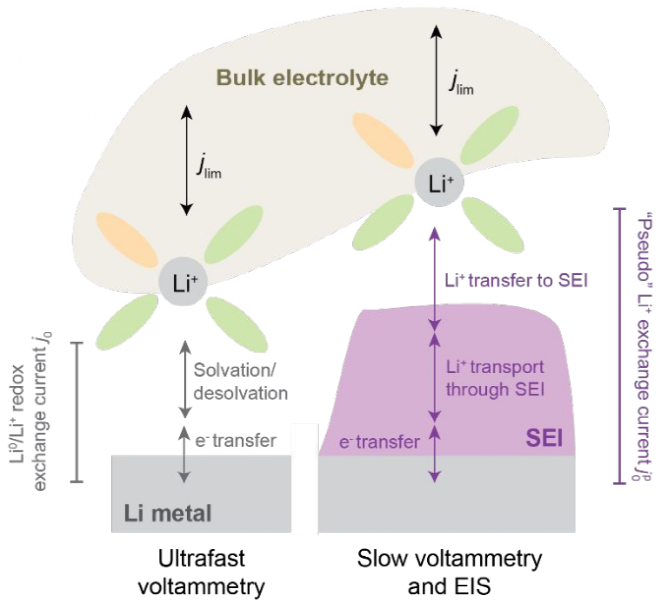
圖1. 從電解液體相到鋰金屬電極的Li0/Li+氧化還原過程的示意圖,突出SEI的重要性。
【成果簡介】
鑒于此,美國麻省理工學院Betar M. Gallant通過電化學阻抗圖譜和循環伏安法,研究了在一系列相關電解液(CE在78%~>99%范圍)下原生的SEIs上的Li+交換電流密度(j0)值。在高CE電解液的循環過程中,SEI Li+的交換增加,而對于低CE電解液,保持在低水平,結果表明CE及其在高倍率下的保持率與SEI Li+交換電流呈正相關。此外,高CE電解液特有的Li+交換電流也為第一步電沉積時對Cu電流集流體的作用和有效性提供了見解。總之,這些發現表明Li+交換電流控制著與Li沉積和循環庫倫效率相關的幾個關鍵過程,因此,它的量化可以幫助指導未來的高CE電解液設計,尤其是高倍率性能。相關研究成果以“Beneficial vs. Inhibiting Passivation by the Native Lithium Solid Electrolyte Interphase Revealed by Electrochemical Li+ Exchange”為題發表在Energy & Environmental Science上。
【核心內容】
阻抗圖譜測定Li+交換
如圖2a所示,總結了1.5 M LiAsF6(2-Me-THF)、1 M LiClO4(PC)、1M LiPF6(EC/DEC)、1M LiFSI(FEC)、1M LiPF6(EC/DMC)、2M LiFSI(FEC)和7M LiFSI(FEC)電解液的庫倫效率,分別為78%、81.9%、93.8%、95.3%、96.9%、97.5%和98.2%。然后,兩種含有添加劑的電解質:1 M LiTFSI(DOL/DME)和2 M LiFSI/1 M LiTFSI(DOL/DME)含有3 wt%的LiNO3,庫倫效率分別為為99.0%和99.3%,包括8種不同的溶劑和6種不同的鹽。如圖2b所示,在電池組裝后,在原始狀態下進行初始阻抗譜,在OCV下5小時后進行預循環,用藍色圓圈表示,建立完整的SEI,然后進行完整的沉積/剝離循環。如圖2c顯示了三種代表性電解液前五個循環中的EIS數據,對應圖2a中有顏色的柱狀圖,圖譜都是由高頻的半圓和一個低頻的尾部組成,與等效電路擬合數據吻合。隨著沉積/剝離過程會產生更小的半圓,歸因于原始表面膜的破壞和原生SEI的形成。但是經過5次循環后,不同電解質的RSEI值顯著不同(如圖2d),1.5 M LiAsF6(2-Me-THF)的RSEI值最高為512.6 Ω cm2,其次是1 M LiPF6(EC/DMC)的47.6 Ω cm2和1 M LiTFSI(DOL/DME+3 wt% LiNO3)的18.3 Ω cm2,而基于“偽”交換電流的框架內解釋測得的交換率 ,EIS從0.03、0.30到0.79 mA/cm2呈現上升的趨勢。
,EIS從0.03、0.30到0.79 mA/cm2呈現上升的趨勢。
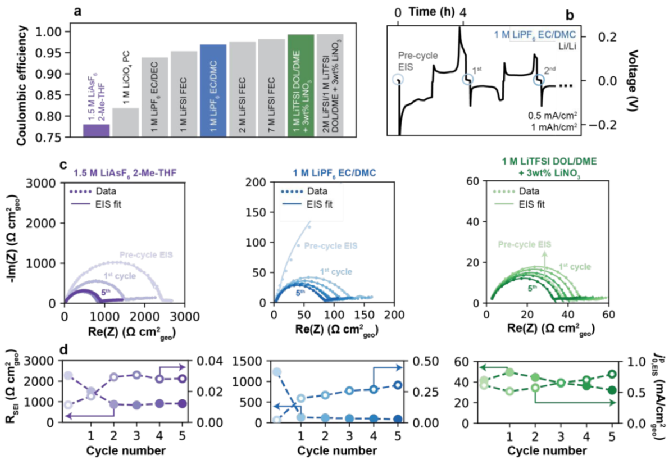
圖2. 電化學阻抗譜(EIS)法測定Li+交換。
圖3a為每種電解液在高頻區超過50圈的 ,EIS,在較長的循環中發現
,EIS,在較長的循環中發現 ,EIS的兩種類型。第一種(Ⅰ型)是比較穩定的:1.5 M LiAsF6(2-Me-THF)、1 M LiClO4(PC)、1M LiPF6(EC/DEC)、1M LiFSI(FEC)和1M LiPF6(EC/DMC);第二種(Ⅱ型)是隨著循環逐漸增加的:2M LiFSI(FEC)、7M LiFSI(FEC)、1 M LiTFSI(DOL/DME+3 wt% LiNO3)和2 M LiFSI/1 M LiTFSI(DOL/DME+3 wt% LiNO3)。
,EIS的兩種類型。第一種(Ⅰ型)是比較穩定的:1.5 M LiAsF6(2-Me-THF)、1 M LiClO4(PC)、1M LiPF6(EC/DEC)、1M LiFSI(FEC)和1M LiPF6(EC/DMC);第二種(Ⅱ型)是隨著循環逐漸增加的:2M LiFSI(FEC)、7M LiFSI(FEC)、1 M LiTFSI(DOL/DME+3 wt% LiNO3)和2 M LiFSI/1 M LiTFSI(DOL/DME+3 wt% LiNO3)。 ,EIS的變化匯總如圖3b所示,每圈的平均變化突出了2型電解質下
,EIS的變化匯總如圖3b所示,每圈的平均變化突出了2型電解質下 ,EIS的增加。
,EIS的增加。 ,EIS的變化可能有兩個來源:(1)SEI內部Li+交換速率的增加,例如化學成分的差異及其在循環中的演變,其中非活性材料的積累不會抑制總Li+的交換速率;(2)由于表面粗糙,Li+/Li0氧化還原的電化學活性區域增加。Ⅰ型電解質對應那些低CE范圍,具有多孔和高長徑比鋰沉積形態(如圖3c),即1.5 M LiAsF6(2-Me-THF, CE = 78.9%)和1 M LiPF6(EC/DEC, CE = 96.9%),而Ⅱ型電解液呈現出致密的Li沉積形態(如圖3c)。此外,對Ⅰ型和Ⅱ型電解質5次循環后的電鍍鋰電極的SEM圖像進行比較,證實了Ⅰ型電解質具有更高的表面積和更多不規則的沉積物(如圖3c)。
,EIS的變化可能有兩個來源:(1)SEI內部Li+交換速率的增加,例如化學成分的差異及其在循環中的演變,其中非活性材料的積累不會抑制總Li+的交換速率;(2)由于表面粗糙,Li+/Li0氧化還原的電化學活性區域增加。Ⅰ型電解質對應那些低CE范圍,具有多孔和高長徑比鋰沉積形態(如圖3c),即1.5 M LiAsF6(2-Me-THF, CE = 78.9%)和1 M LiPF6(EC/DEC, CE = 96.9%),而Ⅱ型電解液呈現出致密的Li沉積形態(如圖3c)。此外,對Ⅰ型和Ⅱ型電解質5次循環后的電鍍鋰電極的SEM圖像進行比較,證實了Ⅰ型電解質具有更高的表面積和更多不規則的沉積物(如圖3c)。
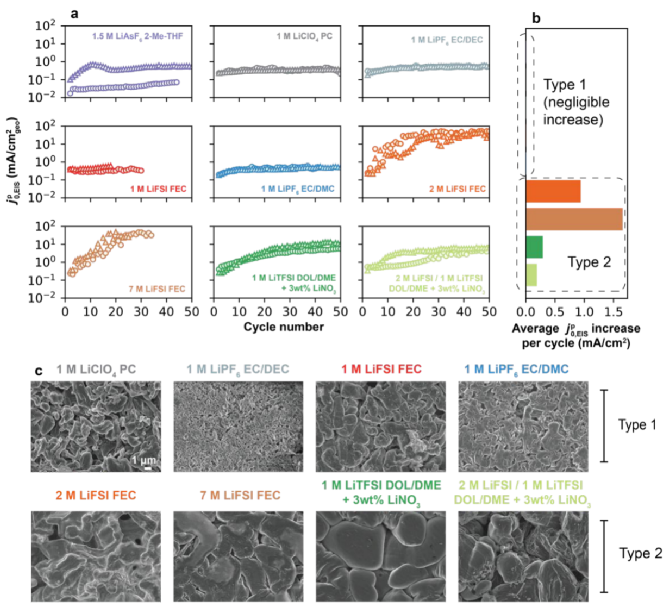
圖3. Li+在Li負極上的交換。
進一步探討高CE電解液中高頻Li+交換是否持續增加,如圖4a所示,基于DOL/DME的電解質進一步增加了大約10個額外的循環,但 ,EIS的值最終穩定在60個循環左右,如8.3 mA/cm2的2 M LiFSI/1 M LiTFSI(DOL/DME+3 wt% LiNO3)和5.7 mA/cm2的1 M LiTFSI(DOL/DME+3 wt% LiNO3)。與低CE電解液(0.39 mA/cm2的1 M LiClO4 PC)相比,這個穩定值要高得多(如圖4a)。雖然這種行為的潛在原因還不完全清楚,但一種可能的解釋如圖4b所示,在低CE電解液中,殘留的SEI有低的Li+交換值,在后續循環中,新沉積的Li的優先成核優勢不大。而在高CE的電解液中,前一循環的SEI殘留物可能在鍍鋰中保持活性,并可被積聚。如圖4c所示,即使在延長循環后,Ⅱ型電解質的Li形態仍然緊密,而Ⅰ型電解質繼續發展高多孔的Li微結構。
,EIS的值最終穩定在60個循環左右,如8.3 mA/cm2的2 M LiFSI/1 M LiTFSI(DOL/DME+3 wt% LiNO3)和5.7 mA/cm2的1 M LiTFSI(DOL/DME+3 wt% LiNO3)。與低CE電解液(0.39 mA/cm2的1 M LiClO4 PC)相比,這個穩定值要高得多(如圖4a)。雖然這種行為的潛在原因還不完全清楚,但一種可能的解釋如圖4b所示,在低CE電解液中,殘留的SEI有低的Li+交換值,在后續循環中,新沉積的Li的優先成核優勢不大。而在高CE的電解液中,前一循環的SEI殘留物可能在鍍鋰中保持活性,并可被積聚。如圖4c所示,即使在延長循環后,Ⅱ型電解質的Li形態仍然緊密,而Ⅰ型電解質繼續發展高多孔的Li微結構。
如圖4d所示,在Ⅰ型電解質中,EIS圖譜在循環過程中基本保持不變,與它們穩定的Li+交換速率一致,并保持為單個半圓。另一方面,Ⅱ型電解質表現出動態的阻抗響應,如圖4e所示,在初始循環階段,圖譜顯示為高頻的半圓和一個小的低頻末尾。在后面的循環中,內部半圓的大小顯著減小,這是Ⅱ型電解質中Li+交換增加的基礎。而低頻末尾變成一個更大、獨特的第二個半圓。如圖4f所示,低頻特征表明在循環過程中可能通過一種額外的機制阻礙Li+交換,抵消了高頻下致密SEI阻抗的下降,與電解液中通過多孔電極Li+擴散相關。
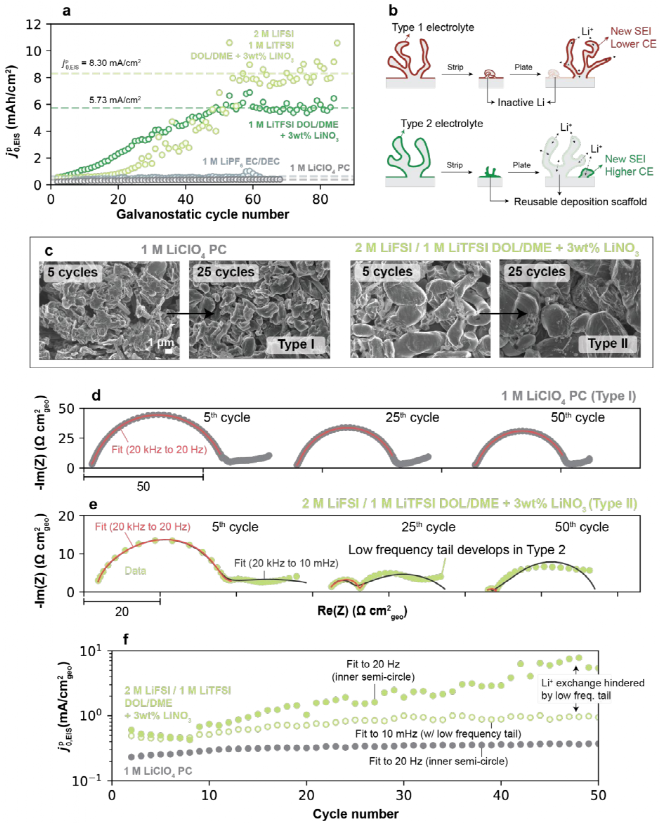
圖4. Li+交換延長了恒流循環。
循環伏安測定Li+交換
循環伏安法測量Cu/Li電池,以測量SEI在更接近初始SEI形成的條件下進行Li+交換。如圖5a為在-0.2 V到1V之間,以1 mV/s的速度對Cu/Li電池中進行了11個連續的CV循環,每次掃描結束時銅都完全溶出。在1 M LiPF6(EC/DEC)電解液樣品中,如圖5b為在原始Cu上獲得的電流-電壓曲線,顯示了典型的金屬沉積到惰性基底上的行為。在正向掃描中,鋰首先被沉積在銅上,在所有循環中都需要一個~100 mV的過電位來開始沉積鋰。在反向掃描時,Li繼續被沉積在Cu上,直到電壓超過平衡電位,之后Li從Cu中被剝離。該方法測定的初始、沉積和完全剝離Cu集電極的Li+交換如圖5c所示,1 M LiPF6(EC/DEC)中初始Cu電極的 ,CV是低的(0.02 mA/cm2),但在電極上沉積上Li后大幅增加并穩定在0.26 mA/cm2。在Li被剝離后,與原始Cu電極相比,沉積Li電極的狀態更接近于
,CV是低的(0.02 mA/cm2),但在電極上沉積上Li后大幅增加并穩定在0.26 mA/cm2。在Li被剝離后,與原始Cu電極相比,沉積Li電極的狀態更接近于 ,CV,即在第1個CV循環中最初為0.40 mA/cm2,在第11個CV循環中穩定在0.19 mA/cm2左右。綜上所述,證實了鋰沉積行為與表面條件及其來源密切相關。
,CV,即在第1個CV循環中最初為0.40 mA/cm2,在第11個CV循環中穩定在0.19 mA/cm2左右。綜上所述,證實了鋰沉積行為與表面條件及其來源密切相關。
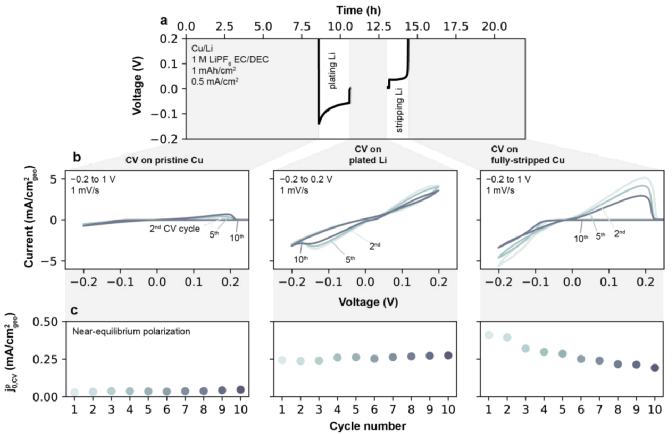
圖5. 循環伏安法及Li電鍍和剝離的 ,CV。
,CV。
在其他電解液中對鋰沉積進行了伏安分析,圖6a為三種電解液的Tafel曲線,其中j-Ew越陡,表明接近平衡的關系越高。在高過電位時表現出典型的Tafel行為,即圖6a所示的Ew-logj線性行為。如圖6b為在所有電解質中CV掃描圈數與 ,CV的函數,第一次掃描
,CV的函數,第一次掃描 ,CV值從非常低0.01 mA/cm2(1.5 M LiAsF6,2-Me-THF)到(2 M LiFSI FEC)的1.21 mA/cm2。在低CE電解質中,
,CV值從非常低0.01 mA/cm2(1.5 M LiAsF6,2-Me-THF)到(2 M LiFSI FEC)的1.21 mA/cm2。在低CE電解質中, ,CV基本不變,而在高CE中,隨著CV圈數的增加每次顯示出小幅但持續的增加。為了更系統地評價,設計用于測量的Li/Li電池中進行了額外的實驗,并在等效循環容量的相同電池中進行了測量
,CV基本不變,而在高CE中,隨著CV圈數的增加每次顯示出小幅但持續的增加。為了更系統地評價,設計用于測量的Li/Li電池中進行了額外的實驗,并在等效循環容量的相同電池中進行了測量 ,CV和
,CV和 ,EIS,在這些條件下,表現出出良好的定量對應關系(如圖6c-d)。值得注意的是,圖6a-b中的鋰沉積測試,在所有掃描結束時,在
,EIS,在這些條件下,表現出出良好的定量對應關系(如圖6c-d)。值得注意的是,圖6a-b中的鋰沉積測試,在所有掃描結束時,在 ,CV和CE之間觀察到成正相關(如圖6e-f),表明快速Li+交換是區分高與低CE電解液的一個關鍵特性。
,CV和CE之間觀察到成正相關(如圖6e-f),表明快速Li+交換是區分高與低CE電解液的一個關鍵特性。
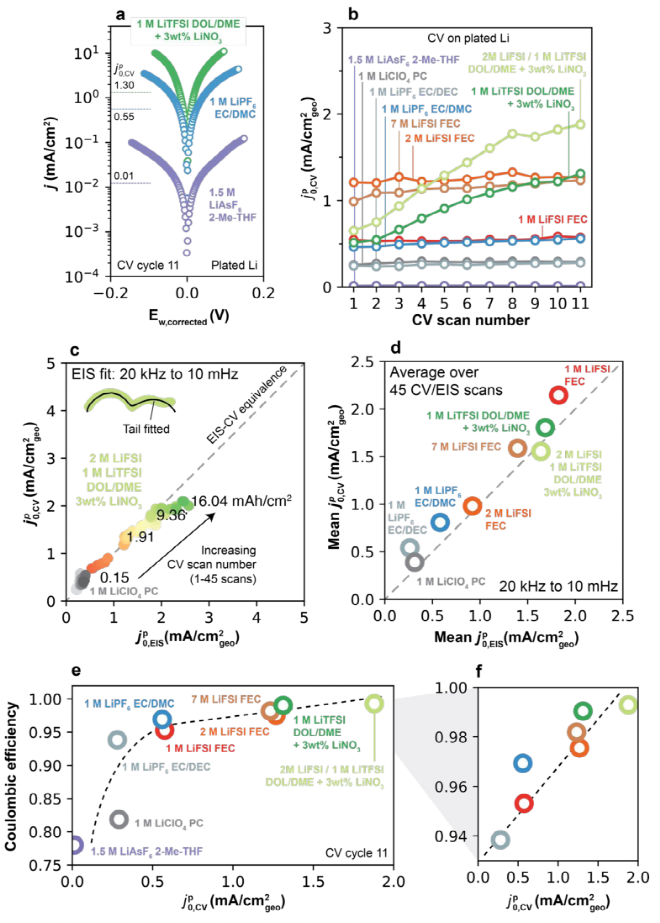
圖6. 通過伏安法在沉積鋰上捕捉Li+的交換。
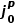 -CE關系的討論
-CE關系的討論
圖7a顯示了所有電解液下初始Cu的前11次CV掃描的 ,CV值,其表現出一定的分散且取決于電解液,但通常較低。如圖7b經過1mAh/cm2的恒電流循環,在某些電解液中觀察到Li+交換速率的明顯上升。圖7c-d進一步描述,在11次CV后總結了恒電流循環前和后的
,CV值,其表現出一定的分散且取決于電解液,但通常較低。如圖7b經過1mAh/cm2的恒電流循環,在某些電解液中觀察到Li+交換速率的明顯上升。圖7c-d進一步描述,在11次CV后總結了恒電流循環前和后的 ,CV值,首先在1 mAh/cm2沉積步驟之前,Cu沒有發現相關性(如圖7c),對比沉積后,觀察到
,CV值,首先在1 mAh/cm2沉積步驟之前,Cu沒有發現相關性(如圖7c),對比沉積后,觀察到 ,CV與CE之間存在很強的單調趨勢。這一發現表明,與Li的趨勢相似,高CE電解液也能更有效地改變Cu-電解液界面,圖7e充分總結了Cu剝后CE-
,CV與CE之間存在很強的單調趨勢。這一發現表明,與Li的趨勢相似,高CE電解液也能更有效地改變Cu-電解液界面,圖7e充分總結了Cu剝后CE- ,CV的單調關系。
,CV的單調關系。
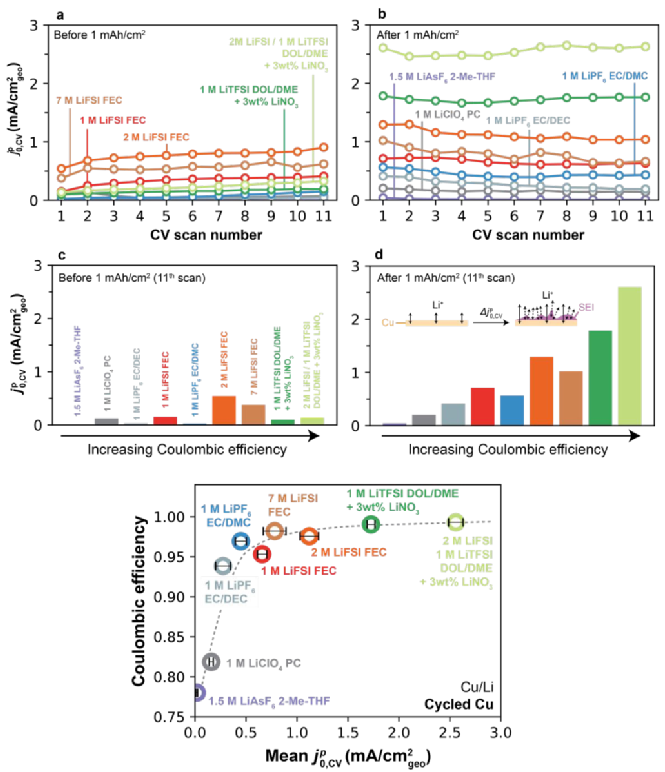
圖7. Cu形成循環對Li+交換和CE的影響。
圖8a為1 M LiPF6 EC/DEC(Ⅰ型電解液),圖8b為2 M LiFSI/1 M LiTFSI DOL/DME+3 wt% LiNO3(Ⅱ型電解液),其來自圖7a-b中CV掃描。首先觀察Ⅰ型電解液(如圖8a),隨著 ,CV循環從1到10,每圈的CE單調增加。在1 mAh/cm2恒流循環后,
,CV循環從1到10,每圈的CE單調增加。在1 mAh/cm2恒流循環后, ,CV增加到更高的值,伴隨CE的改善,在Ⅱ型電解液中觀察到類似的行為(如圖8b)。這些結果與之前關于這兩個參數的關系一致,表明在每個周期的中CE與Li+交換密切相關。
,CV增加到更高的值,伴隨CE的改善,在Ⅱ型電解液中觀察到類似的行為(如圖8b)。這些結果與之前關于這兩個參數的關系一致,表明在每個周期的中CE與Li+交換密切相關。
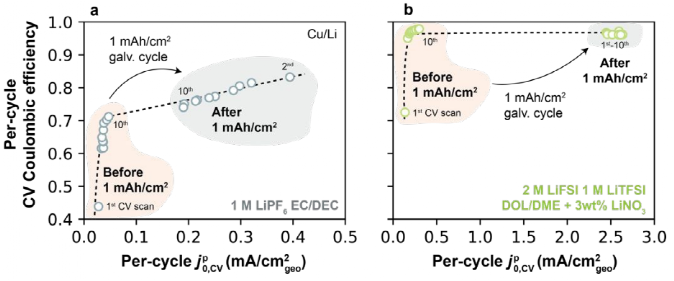
圖8. 在不同電解液下恒流充放電前后每圈的CE和 ,CV。
,CV。
對Li倍率性能的影響
研究了不同電解質中Li+交換對可獲得的速率能力的影響,如圖9所示,在Ⅰ型和Ⅱ型電解質中CE和電流密度的函數關系。Ⅰ型碳酸鹽電解質(1 M LiPF6 EC/DEC和1M LiClO4 PC)的CE隨電流密度的增加而不穩定,在高電流密度時CE值普遍下降。在1 M LiClO4 PC中最為明顯,在0.2 mA/cm2和2 mA/cm2之間CE從87.1%下降到76.9%。而Ⅱ型電解質(2 M LiFSI FEC、M LiTFSI DOL/DME+3 wt% LiNO3和2 M LiFSI/1 M LiTFSI DOL/DME+3 wt% LiNO3)的CE值隨循環電流密度的增加不發生變化。與Ⅰ型電解液相比,Ⅱ型電解液在持續循環中表現出可變的Li+交換,這一因素可能會增強其高速率良好循環的能力。
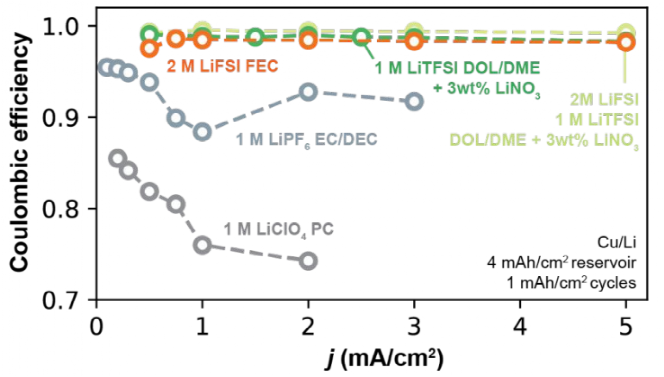
圖9. 不同電解液在不同電流密度下的CE。
【結論展望】
本文利用EIS和CV兩種電化學技術,研究在低CE和高CE電解液下形成的Li SEIs中進行的Li+交換,為Li+交換率的定量提供了獨特但互補的方法。低CE電解液中表現出穩定和適度的Li+交換速率,高CE電解質表現出更高的總Li+交換率,并在循環過程中進一步增加。結果發現CE和Li+交換電流之間存在緊密的正相關關系,從而表明快速Li+交換的電解液與高CE相關。此外,結果還表明與循環后的Cu相比,未循環Cu上的Li+交換更緩慢,原始Cu上的CE相應更低,為在第一個沉積鋰步驟中發生的潛在過程提供了見解。最后,這些發現有助于電解液設計的新框架,以最大化SEI相,促進便利的Li+交換,對Li+交換和可逆性產生深遠的影響。
審核編輯:劉清
-
鋰離子電池
+關注
關注
85文章
3240瀏覽量
77705 -
SEM
+關注
關注
0文章
219瀏覽量
14437 -
電解液
+關注
關注
10文章
848瀏覽量
23101 -
OCV
+關注
關注
0文章
25瀏覽量
12531 -
EIS
+關注
關注
0文章
27瀏覽量
8835
原文標題:?美國麻省理工學院EES:Li+交換電流密度和CE關系如何?最佳SEI該如何設計?
文章出處:【微信號:清新電源,微信公眾號:清新電源】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
bq2431x DSJ EVM (HPA251)用于Li+充電器前端保護IC指南

磁化電流密度和傳導電流密度的關系
逆變器輸入電流和輸出電流的關系
SEI異步通訊—多摩川協議支持

過電壓和過電流保護IC和Li+充電器前端保護IC bq2431x數據表

過電壓和過電流保護IC和Li+充電器前端保護IC bq24300和bq24304數據表





 Li+交換電流密度和CE關系如何?最佳SEI該如何設計?
Li+交換電流密度和CE關系如何?最佳SEI該如何設計?













評論