引 言
鋰離子電池(LIBs)作為電化學儲能設備已經取得了實質性的進展。新電池系統的實施總是受到不利的電極/電解質界面反應的阻礙。因此,迫切需要優化電解質以適應不斷發展的電池系統。電解液作為鋰離子電池中不可或缺的部分,在新型電極材料的應用和儲能系統的設計中起著至關重要的作用。重要的是,陰離子衍生的界面化學策略刷新了電解液體系,并推動傳統LIBs和新電池化學的重大進展。通過在Li+溶劑化結構中引入陰離子,如高濃度電解液(HCEs)、局域高濃度電解液(LHCEs)、弱溶劑化電解液(WSEs),可以合理調控界面成膜過程。
然而,合適的陰離子數量有限,溶劑在確定陰離子衍生的界面化學中起著至關重要的作用。迄今為止,電解液的設計和選擇主要是基于實驗。這種傳統的電解液設計試錯過程,會導致一個漫長而復雜的研究周期。通用溶劑描述符的開發將有助于加速功能化電解液的發展,目前仍然是一個挑戰。本工作,我們統計分析了大量有機溶劑分子的表面電荷性質,并總結了其中的規律。目的是為電解液的溶劑選擇提供一種簡便的方法,為電解液工程設計提供一個清晰的圖像。
成 果 簡 介
課題組在期刊Advanced Energy Materials上發表題為“Electrostatic Potential as Solvent Descriptor to Enable Rational Electrolyte Design for Lithium Batteries”的研究性文章。該文章以目前電解液研究體系中涉及的有機溶劑為對象,分析了其表面電荷性質。總結了溶劑電荷特征與電解液溶劑化結構設計的關系。本研究提出靜電勢(ESP)可以作為溶劑選擇的直接和簡單的描述符,輔助設計電解液。該結果有助于對先進電解液新的理解和設計,促進利用人工智能/機器學習開發高性能電解液。
正 文 導 讀
鋰電池電解液的基本成分包括有機溶劑,陰離子和鋰鹽。理想的溶劑應克服陽離子和陰離子之間的電子相互作用來溶解鹽。基于對溶劑化學的理解,在電解液體系設計中,通常使用介電常數(?)或給體數(DN)代替極性來評價溶劑溶解鋰鹽的能力。如圖1,這兩個參數在使用過程中存在一定的局限性。例如氫氟醚類反溶劑和極性溶劑(乙二醇二甲醚,DME)的差不多;1,4二氧六環(1,4-DX)和乙腈(AN)的DN值差不多,但它們對鋰鹽的溶解,參與溶劑化的能力卻大不相同。
因此,非常需要一個能全面反映溶劑溶解能力的理化參數來指導電解液設計。但陰離子和溶劑都作為配體構成溶劑化結構,因此不同的陰離子會顯著影響溶劑與Li+的配位。由于不同的陰離子相互作用模型的復雜性,本文希望簡化模型并進行全面的討論。因此,只選用LiFSI作為電解液的主鹽。在該模型中(Li+-solvent-FSI-),無論FSI-是否參與溶劑化結構,不影響不同溶劑之間的競爭配位能力的比較。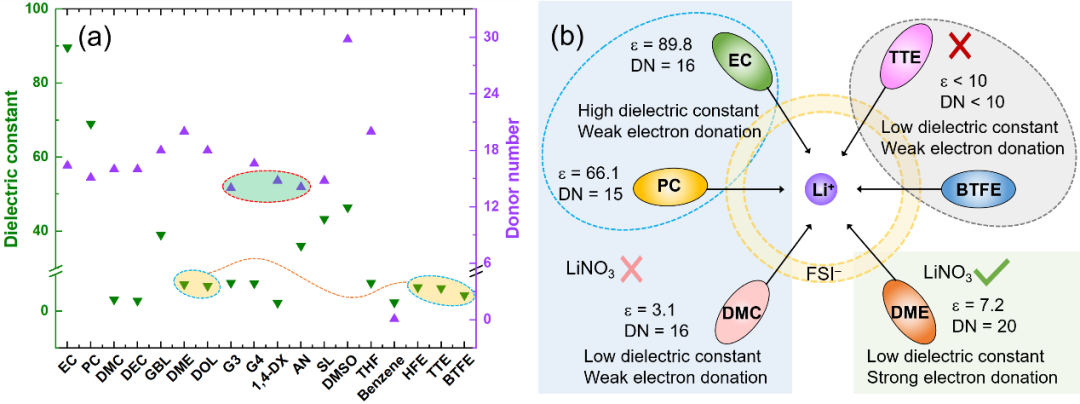
圖1. (a)鋰離子電池電解液溶劑的介電常數和給體數。(b)幾種典型溶劑的介電性質、給電子能力和溶鹽能力之間的關系示意圖,以上討論是在以LiFSI為主要鹽的情況下進行的。在電解液體系中,溶劑分子可以作為電子供體與Li+配位,供體單元具有強的負表面靜電勢。圖2列舉了幾種電解液體系常用的幾種溶劑化溶劑(醚類,酯類,環丁砜,乙腈等)和反溶劑(氫氟醚,二氯甲烷)的ESP圖。可以看出溶劑化溶劑和反溶劑的ESP特征存在明顯差異,溶劑化溶劑的負電荷主要集中在氧原子和氮原子上,產生了比反溶劑更強的負電勢。
對于溶劑化溶劑,最低靜電勢絕對值(|ESPmin|)遠高于其最高靜電勢(ESPmax),也就是|ESPmin| ? ESPmax。而反溶劑的ESP表現出相反的趨勢,|ESPmin| ? ESPmax,主要是因為氟原子的存在導致氧原子表面負電荷的分散,幾乎均等地分布在氧原子和氟原子上。這意味著反溶劑不是一個令人滿意的電子供體,這也暗示了反溶劑不參與溶劑化殼層。因此,我們認為根據分子的靜電勢特性來指導功能電解液的設計是可行的。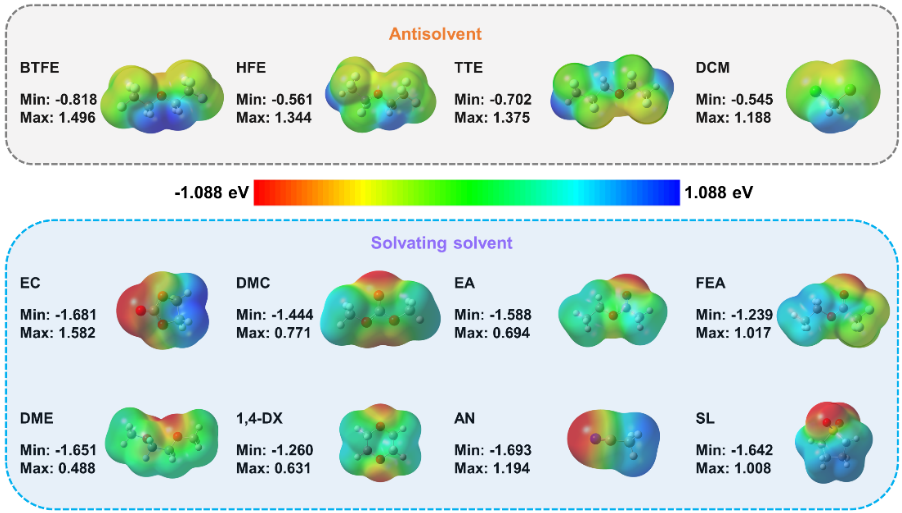
圖2. 真空條件下有機溶劑表面靜電勢圖為了驗證ESP規則的普適性,我們使用ESPmin和ESPmax對眾多溶劑分子進行統計分析。如圖3a所示,溶劑的分布很有規律性。氫氟醚(HFE)是一類典型的反溶劑,已被證實能抑制鋰枝晶,使鋰金屬電池具有較高的循環穩定性。
此外,二氯甲烷(DCM)作為反溶劑,成功提高了金屬鋰電池的低溫性能。這些抗溶劑均位于圖3a的左上角(綠色陰影),它們的ESPmin值較低,即|ESPmin| ? ESPmax。此外,苯和1,2-二氟苯(dFBn)也是一種對Li+親和力較低,可以作為稀釋劑的新型反溶劑。苯甲醚是一種添加劑來防止鋰離子鋰中的過充,其對鋰鹽的溶解度也很低。可以看出,這類芳香族溶劑(紫色陰影)的特點是低的|ESPmin|和ESPmax。因此,溶劑表現出弱的ESPmin表明它不是優秀的電子供體,不利于鋰鹽的溶解,是其成為合適的反溶劑的主要特征。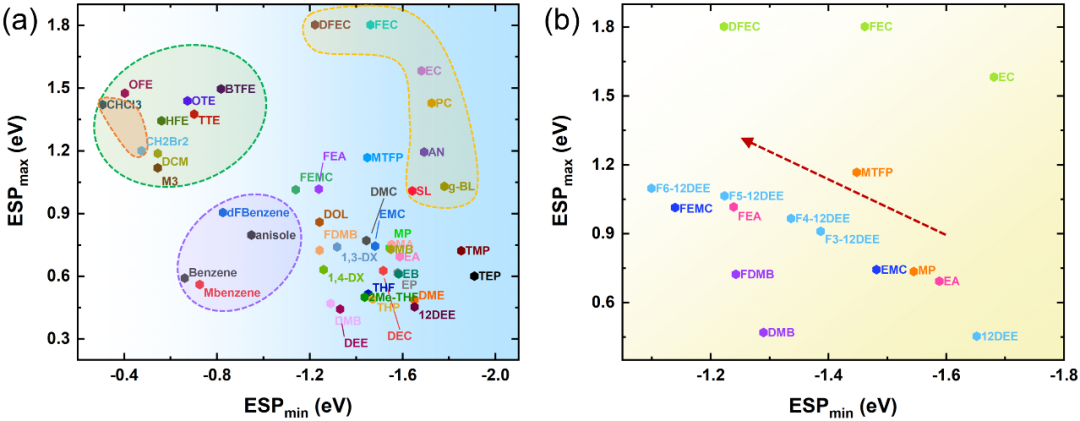
圖3. 真空條件下用于鋰電池電解液的有機溶劑靜電勢(a), (b)氟化溶劑的靜電勢變化規律。在非水電解液中,溶劑與陰離子溶劑化的競爭行為決定了Li+的溶劑化結構。在傳統的1 M LiPF6碳酸酯電解液中,主要的溶劑化結構是只有溶劑參與Li+溶劑化鞘,并形成溶劑分離離子對(SSIPs)。然而,對于WSEs即使在低濃度下也可以形成接觸離子對(CIPs)和聚集離子對(AIPs)。常規溶劑主要分布在圖3a的右側,表面靜電勢存在很強的負值。碳酸乙烯酯(EC)、碳酸丙烯酯(PC)、乙腈(AN)等強極性溶劑(黃色陰影)的正、負表面靜電勢都比較強且|ESPmin|≈ESPmax。
而對于乙醚(DEE)、1,2-二氧基乙烷(12DEE)、1,3-二氧戊環(DOL)和1,4-dx等弱溶劑,ESPmax顯著降低(|ESPmin| ? ESPmax)。雖然使用ESPmin和ESPmax測量極性是不準確的,但它仍然是一個有用的參考。對于弱極性溶劑,ESPmax的變化可以代表極性的變化。更具體地說,如果ESPmin相似,ESPmax越高,電荷分離程度越高,從而導致極性越強。這樣的觀察結果可以合理地解釋Li+的溶劑化結構。更負的ESPmin使溶劑更易與Li+配合,而ESPmax的變化表明分子極性的波動。
對于弱溶劑化溶劑,低ESPmax意味著極性低,在低濃度時陰離子更傾向于與Li+結合形成CIPs或AIPs。圖3b顯示了EC、乙酸乙酯(EA)、丙酸甲酯(MP)、1,2-二氧基乙烷(12DEE)及其氟化衍生物的ESP。值得注意的是,含氟溶劑的ESPmin的比本征溶劑的負電荷大,這說明氟原子削弱了配位溶劑對Li+的親和力,可以促進Li+的脫溶化過程。因此,我們可以通過ESPmin ESPmax圖大致區分反溶劑、強溶劑化溶劑和弱溶劑化溶劑。此外,我們計算了幾種從未被用作LIBs電解液溶劑的溶劑分子的ESP,如三氯甲烷(CHCl3)、二溴甲烷(CH2Br2)和甲苯(MBenzene),它們表現出與DCM或二氟苯等反溶劑類似的電荷分布特征,可以被認為是未來的反溶劑候選分子。
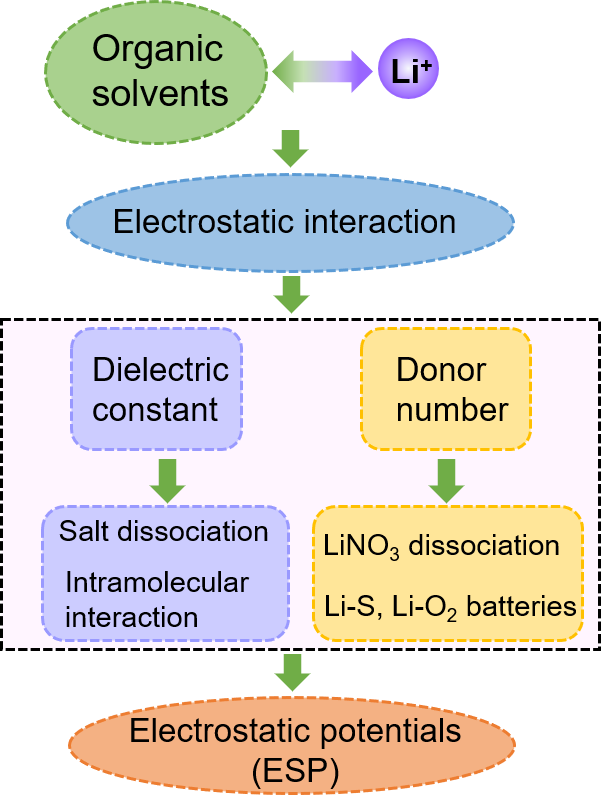
圖5. 選擇靜電勢作為描述符的基本思路。圖5闡述了選擇ESP作為描述符的基本思路。對于鋰電池電解液,溶劑分子與離子的相互作用主要是通過靜電相互作用產生的。介電常數和供體數都提供了關于供體和受體之間靜電相互作用的信息,但每一個都有自己的重點。側重于描述分子在電場中的電荷極化,而DN則反映了溶劑化物中富電子吸引Li+的能力。EPS描述了分子表面具體位置的電荷和密度,可以用來表征溶劑化物與Li+之間的微觀相互作用。
結 論
綜上所述,本工作系統研究了電解液工程中溶劑的表面靜電勢,闡明了溶劑的表面電荷特性。生成的ESPminESPmax溶劑圖有明顯的分布規律。計算結果表明,反溶劑的表面電荷分布特征為|ESPmin| ? ESPmax。應用這一規律,我們預測了幾種可能成為下一代反溶劑的候選分子。此外,表面ESP的變化可以用來比較溶劑參與溶劑化的強度。溶劑化溶劑起到電子供體的作用與Li+配合,ESPmin的降低表明溶劑化能降低。這一結果使我們能夠篩選反溶劑、強溶劑化溶劑和弱溶劑化溶劑。因此,分析溶劑的ESP是篩選溶劑和調節溶劑化結構的一種簡單方法。
審核編輯:劉清
-
鋰離子電池
+關注
關注
85文章
3332瀏覽量
78762 -
ESP
+關注
關注
0文章
192瀏覽量
34742 -
電解液
+關注
關注
10文章
860瀏覽量
23445 -
機器學習
+關注
關注
66文章
8493瀏覽量
134179
原文標題:何向明課題組王莉AEM:簡易溶劑描述符助力電解液AI&機器學習
文章出處:【微信號:Recycle-Li-Battery,微信公眾號:鋰電聯盟會長】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
通過 FX3 以 5200*3900 分辨率、15fps 的速度從我的 fpga 傳輸視頻數據流,但無法設置最小/最大比特率描述符值,怎么解決?
將CY7C68013A連接到基板管理控制器 (BMC),讀取設備描述符時發生FX2超時錯誤怎么解決?
非接觸式液位傳感器精準檢測電解液液位優選方案

Banana Pi 發布 BPI-AI2N &amp; BPI-AI2N Carrier,助力 AI 計算與嵌入式開發
Banana Pi 發布 BPI-AI2N &amp; BPI-AI2N Carrier,助力 AI 計算與嵌入式開發

水系電解液寬電壓窗口設計助力超長壽命水系鈉離子電池
直面行業痛點,引領行業發展 -比創達 “AI&;amp;EMC,電磁兼容” 高峰論壇圓滿落幕

onsemi LV/MV MOSFET 產品介紹 &amp;amp; 行業應用




















評論