對于大多數(shù)人來說,傷口只是一種小麻煩,無需太多有意識的努力就能自行愈合。然而,對于患有某些慢性疾病(例如糖尿病、外周血管疾病)、免疫系統(tǒng)受損(例如系統(tǒng)性紅斑狼瘡),甚至具有營養(yǎng)不良和衰老等常見系統(tǒng)性病理/生理狀態(tài)的人來說,急性傷口更容易發(fā)展為慢性傷口。事實上,慢性傷口的高患病率已造成了巨大的社會經(jīng)濟負(fù)擔(dān)(約占發(fā)達(dá)國家醫(yī)療保健總支出的1%~3%,并且隨著人口中位年齡的增長而增加),并給患者帶來了切實的痛苦。因此,迫切需要可以促進(jìn)這些患者群體更快康復(fù)的策略。傷口的愈合過程通常分為四個連續(xù)而且相互重疊的階段:止血、炎癥、生長和成熟。這些并發(fā)階段涉及許多細(xì)胞類型(按通常的出現(xiàn)順序列示):活化的血小板、中性粒細(xì)胞、單核細(xì)胞、巨噬細(xì)胞、肥大細(xì)胞、樹突狀細(xì)胞、T細(xì)胞、內(nèi)皮細(xì)胞、周細(xì)胞、造血干細(xì)胞、成纖維細(xì)胞、肌成纖維細(xì)胞、黑色素細(xì)胞和角質(zhì)形成細(xì)胞。在傷口愈合過程中,這些類型的細(xì)胞會被募集和遷移到傷口部位,無論它們是靠近傷口部位還是必須通過循環(huán)系統(tǒng)進(jìn)行長距離移動。
化學(xué)梯度、機械梯度和電梯度(即分別被稱為趨化性、趨觸性/趨硬性和趨電性的過程)都有助于將上述細(xì)胞募集或引導(dǎo)至傷口。值得注意的是,趨電性是指細(xì)胞在電場(EF)作用下遷移的能力。中性粒細(xì)胞、單核細(xì)胞、淋巴細(xì)胞、巨噬細(xì)胞、內(nèi)皮細(xì)胞、成纖維細(xì)胞和角質(zhì)形成細(xì)胞都被證明是具有趨電性的。有趣的是,當(dāng)皮膚的上皮層破裂時,傷口周圍會自然形成小的電場。這種自然形成的(即內(nèi)源性)電場的強度存在很大的個體差異,這取決于患者的系統(tǒng)性特質(zhì)(例如年齡、患病情況)。結(jié)合大多數(shù)皮膚細(xì)胞表現(xiàn)出趨電性這一事實,傷口周圍這些內(nèi)源性電場的發(fā)現(xiàn)引發(fā)了這樣的假設(shè),即電信號對于傷口愈合中的細(xì)胞遷移過程至關(guān)重要。
角質(zhì)形成細(xì)胞是皮膚中最普遍的細(xì)胞類型,其密集堆積在任何給定的側(cè)向?qū)觾?nèi),并且也緊密排列在垂直層(即分層)中。在垂直層中,越靠近最外層的頂端層,角質(zhì)形成細(xì)胞就越分化。在皮膚以及融合培養(yǎng)的細(xì)胞層中,角質(zhì)形成細(xì)胞作為一個整體遷移。以往關(guān)于皮膚細(xì)胞趨電性的體外研究通常集中在單個細(xì)胞上,因此忽略了實際皮膚中細(xì)胞的復(fù)雜組織結(jié)構(gòu)對遷移行為的影響。然而,集體細(xì)胞遷移更能代表角質(zhì)形成細(xì)胞等細(xì)胞類型的體內(nèi)細(xì)胞動力學(xué)。
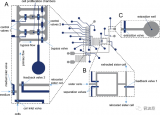
據(jù)麥姆斯咨詢報道,近期,德國弗萊堡大學(xué)(University of Freiburg)、呂勒奧理工大學(xué)(Lule? University of Technology)以及查爾姆斯理工大學(xué)(Chalmers University of Technology)的研究人員于Lab on Chip期刊共同發(fā)表了題為“Bioelectronic microfluidic wound healing: a platform for investigating direct current stimulation of injured cell collectives”的論文。該工作旨在實現(xiàn)以下三重研究目標(biāo):(a)探索電引導(dǎo)信號(電場分布)對傷口愈合率的影響;(b)演示在沒有通常需要的鹽橋的情況下,如何實現(xiàn)非金屬直流(DC)刺激電極材料的穩(wěn)定性和細(xì)胞安全性;(c)建立糖尿病傷口模型以檢驗電刺激究竟是可以改善還是會惡化傷口的愈合動力學(xué)。
為了實現(xiàn)以上的研究目標(biāo),研究人員利用微流控平臺開展了“經(jīng)典”劃痕實驗,以探索電場刺激加速傷口修復(fù)的參數(shù)空間。該研究分析了多種微流控模型,以確定能夠最好地模擬標(biāo)準(zhǔn)劃痕實驗,同時具有微流控平臺提供的優(yōu)越實驗控制的設(shè)計。直流兼容電極材料是體外電場刺激的關(guān)鍵要素,并且對臨床轉(zhuǎn)化至關(guān)重要。在該項研究中,研究人員制備了基于激光誘導(dǎo)石墨烯(LIG)和PEDOT:PSS水凝膠的電極,并將其集成在微流控平臺內(nèi),該電極能夠?qū)崿F(xiàn)持續(xù)數(shù)小時的直流刺激。利用這種芯片上的傷口環(huán)境,該研究可以利用健康細(xì)胞以及模擬糖尿病角質(zhì)形成細(xì)胞的培養(yǎng)模型,實現(xiàn)對電刺激加速傷口愈合概念的探索。相關(guān)研究結(jié)果表明,電場刺激可有效加速健康細(xì)胞的傷口愈合,并且可以恢復(fù)受損的糖尿病樣細(xì)胞的活動能力。
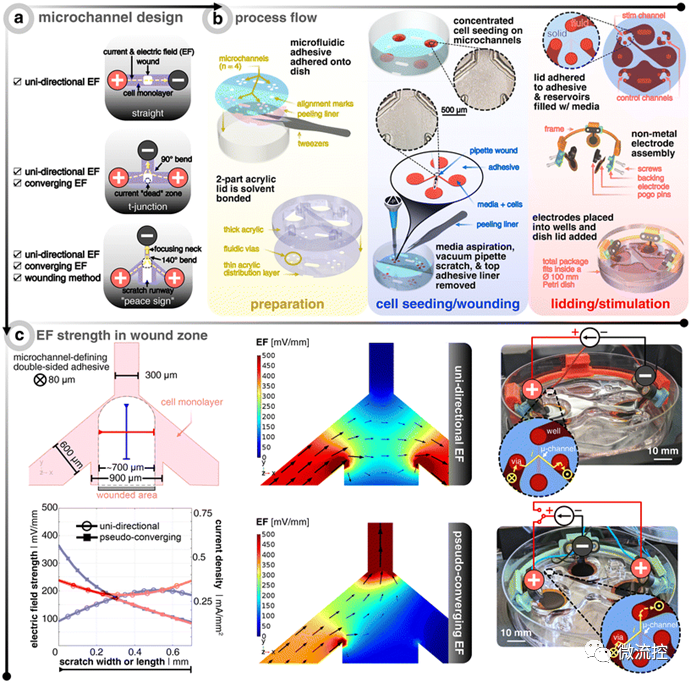
圖1 傷口周圍有不同電場(EF)分布的微流控平臺
為了可重復(fù)地產(chǎn)生趨電性行為,使趨電效應(yīng)與其他可能的干擾解耦是必要的。例如,電極-電解質(zhì)界面的法拉第反應(yīng)可以誘導(dǎo)氧化還原反應(yīng),從而導(dǎo)致陽極的pH值降低(即H+增加)和陰極的pH值上升(即H+減少)。由于之前的研究明確指出pH值是趨電性的決定因素,并且由于微流控腔室內(nèi)的密閉環(huán)境導(dǎo)致系統(tǒng)對這種變化更加敏感,因此,該研究明確驗證了直流刺激下微流控平臺內(nèi)pH值的穩(wěn)定性。此外,通過液阻(即微通道)施加直流電流的另一種可能的干擾是焦耳加熱效應(yīng)可以增加細(xì)胞的新陳代謝,并使得細(xì)胞更快地遷移。因此,研究人員對該影響因素也進(jìn)行了進(jìn)一步的研究。研究結(jié)果表明,在該微流控平臺上利用直流電流對細(xì)胞進(jìn)行12小時的電刺激,細(xì)胞不會受到電化學(xué)誘導(dǎo)的法拉第反應(yīng)和熱誘導(dǎo)的細(xì)胞凋亡的影響。
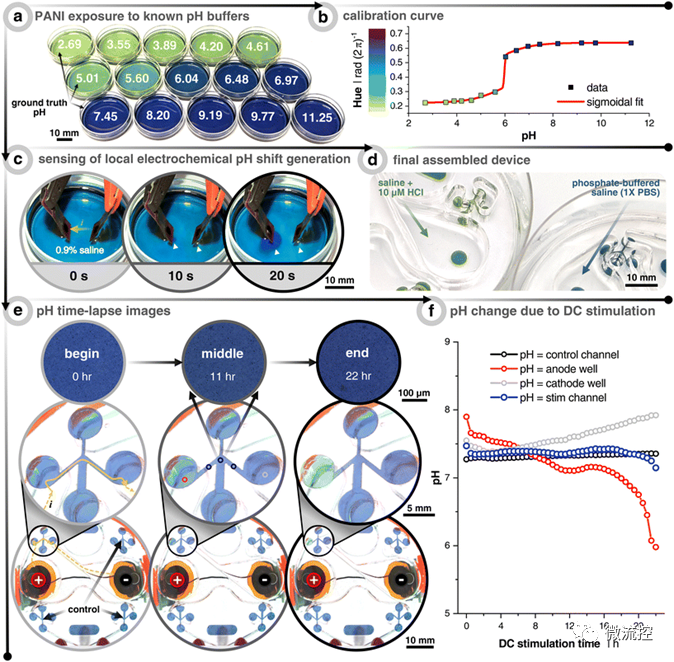
圖2 測量由于直流(DC)電流刺激引起的pH值變化
接著,研究人員比較了電刺激傷口邊緣的一端(即單向電場)是否與交替極化傷口邊緣的兩端(即偽收斂電場)一樣可以有效實現(xiàn)傷口的愈合。研究結(jié)果發(fā)現(xiàn),與未受電刺激的對照組相比,單向電引導(dǎo)信號將健康和糖尿病樣角質(zhì)形成細(xì)胞群的傷口愈合率提高了近三倍,從而在群體角質(zhì)形成細(xì)胞愈合動力學(xué)方面具有優(yōu)勢。此外,在單向電刺激下,活動抑制和糖尿病樣角質(zhì)形成細(xì)胞的傷口愈合率(從1.0%/h增加到2.8%/h)恢復(fù)到了與健康的未受電刺激的角質(zhì)形成細(xì)胞(3.5%/h)相當(dāng)?shù)乃健R虼耍撗芯拷Y(jié)果證明,以可控方式進(jìn)行的電刺激可能是加速傷口修復(fù)的可行途徑,也為其他研究人員開發(fā)最優(yōu)的用于體內(nèi)直流刺激的電極提供了參考。
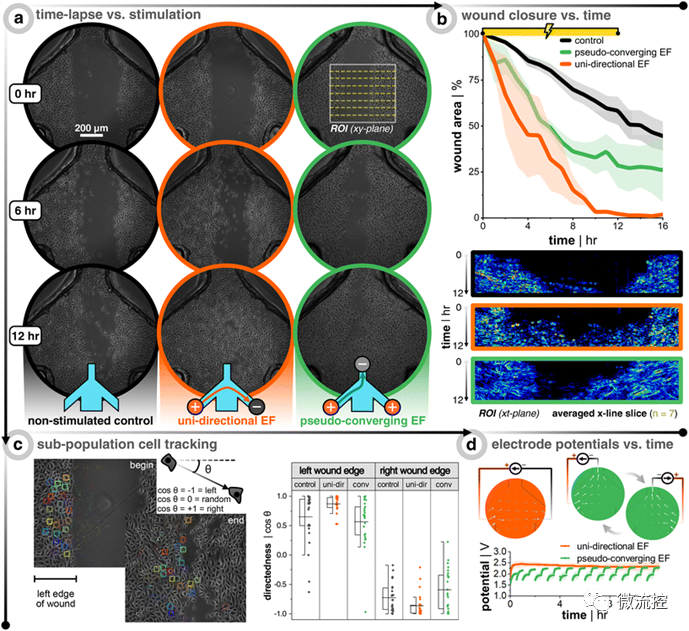
圖3 健康角質(zhì)形成細(xì)胞的生物電子傷口愈合實驗表明刺激后傷口可以更快愈合
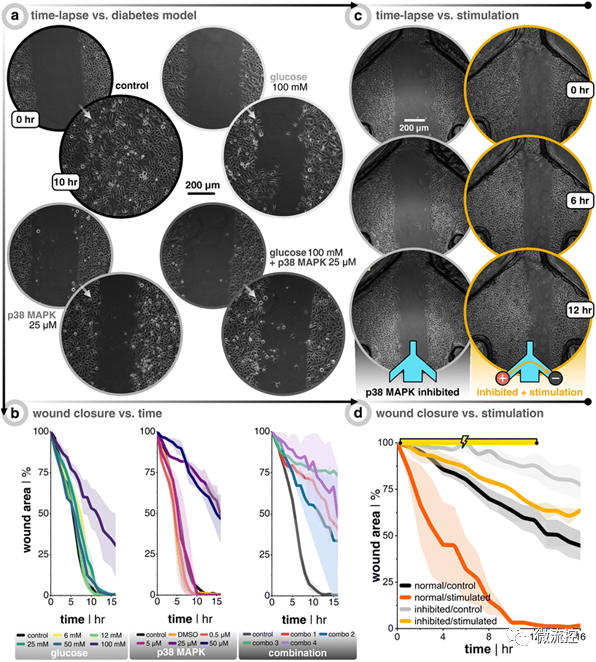
圖4 抑制角質(zhì)形成細(xì)胞活性會減緩細(xì)胞遷移,而直流電刺激有助于恢復(fù)這種失去的活動能力 論文鏈接: https://doi.org/10.1039/D2LC01045C
審核編輯 :李倩
-
模型
+關(guān)注
關(guān)注
1文章
3226瀏覽量
48809 -
微流控
+關(guān)注
關(guān)注
16文章
525瀏覽量
18885
原文標(biāo)題:生物電子微流控平臺,用于直流電刺激下受傷細(xì)胞群傷口愈合機制研究
文章出處:【微信號:Micro-Fluidics,微信公眾號:微流控】歡迎添加關(guān)注!文章轉(zhuǎn)載請注明出處。
發(fā)布評論請先 登錄
相關(guān)推薦
生物電阻抗分析在疾病臨床監(jiān)測和診斷中的應(yīng)用介紹
何為生物電?生物電的原理是什么?
直流電路的過流保護(hù)設(shè)計方法
美國試驗將“經(jīng)顱直流電刺激”(TDCS)技術(shù)的用途從促進(jìn)受傷士兵恢復(fù)
LED在傷口愈合與皮膚護(hù)理方面的應(yīng)用
經(jīng)顱直流電刺激技術(shù)介紹

經(jīng)顱直流電刺激(tDCS)_在康復(fù)醫(yī)學(xué)中的應(yīng)用與發(fā)展

恒流直流電源設(shè)計

經(jīng)顱直流電刺激對孤獨癥譜系障礙兒童腦電的研究
通過生物電子系統(tǒng)實現(xiàn)傷口護(hù)理和加速傷口愈合
可用于單細(xì)胞分析的選擇性液滴提取微流控裝置
用于單細(xì)胞譜系追蹤圖像引導(dǎo)的微流控系統(tǒng)




 生物電子微流控平臺,用于直流電刺激下受傷細(xì)胞群傷口愈合機制研究
生物電子微流控平臺,用于直流電刺激下受傷細(xì)胞群傷口愈合機制研究










評論