據麥姆斯咨詢報道,近日,南京大學宋玉君教授團隊開發了一種高通量的單細胞微流控平臺,并結合載酶金屬有機框架,用于實時無損監測單細胞內外的代謝物濃度。同時基于癌細胞特有的有氧糖酵解代謝特性,該平臺實現了高效的癌細胞識別及其遠端成瘤能力評估。
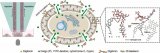
超過90%的癌癥相關死亡是由腫瘤轉移引起的。轉移是一個復雜的過程,包括原發腫瘤細胞的脫落、內滲進入循環系統、在循環系統中遷移、外滲到靶器官以及定植形成微轉移。事實上,只有<0.1%的循環腫瘤細胞(CTC)最終定殖成功。研究表明,癌細胞的“瓦博格效應(Warburg effect)”在腫瘤的定殖中起著關鍵作用,因為癌細胞分泌的大量乳酸有助于免疫逃避、細胞遷移和血管形成等,從而促進繼發性腫瘤的發展。因此,在單細胞層面實現癌細胞的“糖代謝”特征分析,對于評估癌細胞遠端成瘤能力具有重要意義。
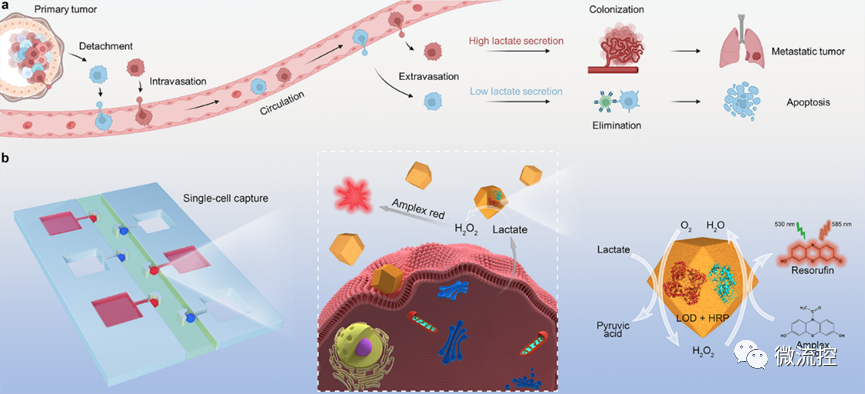
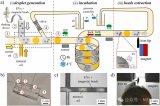
圖1 基于微流控芯片的單細胞乳酸代謝分析
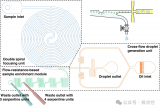
為此,研究團隊設計了一種陣列式微流控芯片,實現了>99%的單細胞捕獲效率,并借助氟化液構建了無交叉污染的單細胞微環境,用于模擬外滲過程中的腫瘤微環境。進一步利用負載葡萄糖氧化酶或乳酸氧化酶的金屬有機框架及相應熒光探針,實現了細胞內外的代謝物濃度的半定量可視化分析,進而評估單細胞的成瘤能力。
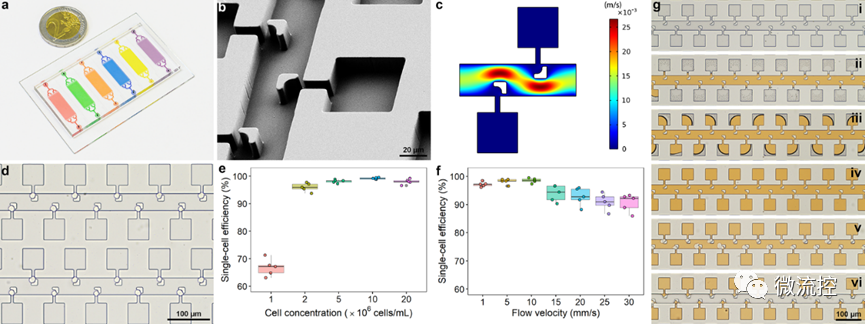
圖2 微流控芯片上單細胞微環境的構建
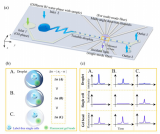
基于該微流控平臺,研究團隊分析了正常乳腺上皮細胞MCF-10A、弱轉移能力的乳腺癌細胞MCF-7、強轉移能力的乳腺癌細胞MDA-MB-231,以及乳酸抑制藥物處理過的乳腺癌細胞的“糖代謝”特征。微流控芯片上的大規模統計分析結果與小鼠尾靜脈轉移瘤模型一致,驗證了該平臺用于癌細胞代謝分析及成瘤能力評估的可行性。
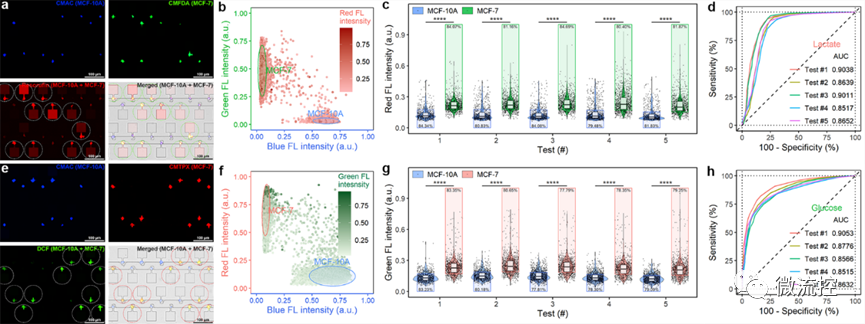
圖3 不同細胞成瘤能力的分析
此外,該微流控平臺可直接用于捕獲分析未經處理的全血樣本中的循環腫瘤細胞,腫瘤細胞的捕獲率可達80%以上,根據單細胞“糖代謝”特征檢測腫瘤細胞的靈敏度高達95%以上,具有較高的臨床應用潛力。
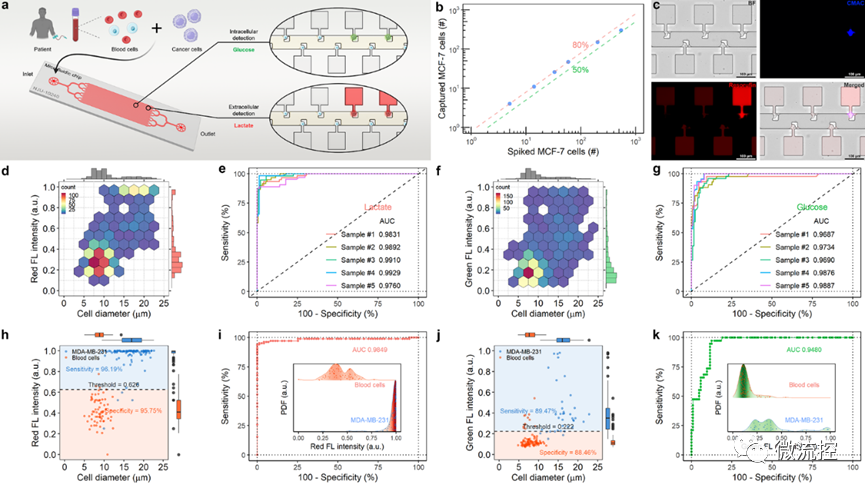
圖4 全血樣本中的癌細胞檢測分析
總之,這種高通量的微流控平臺在單細胞無損檢測和長期監測方面具有巨大應用潛力。不僅可以用于臨床稀有細胞的代謝物分析,還可以實現單細胞層面的藥效評估,對于精準醫療和液體活檢具有重要的啟發意義。
審核編輯:劉清
-
MCF
+關注
關注
0文章
7瀏覽量
18699 -
MDA
+關注
關注
0文章
13瀏覽量
12240 -
微流控
+關注
關注
16文章
534瀏覽量
18913
原文標題:基于載酶金屬有機框架的微流控平臺,實現單細胞代謝物分析和癌細胞遠端成瘤能力評估
文章出處:【微信號:MEMSensor,微信公眾號:MEMS】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
Aigtek高壓放大器在介電泳的微流控細胞分離技術中的應用
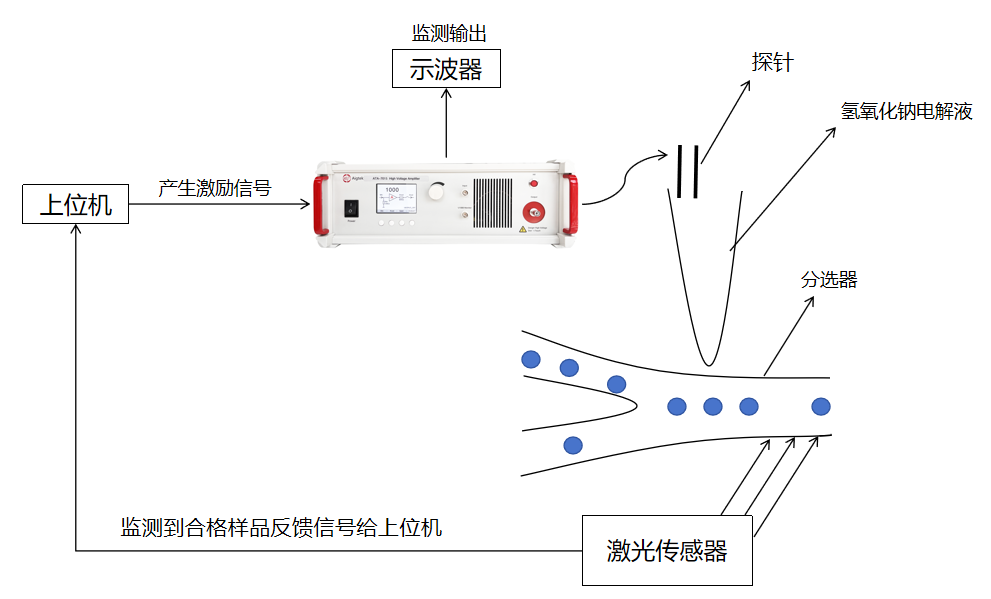
采用微流控技術實現重金屬分析,助力環境監測與污染控制
ATA-7020高壓放大器在微流控3D細胞微球培養中的應用
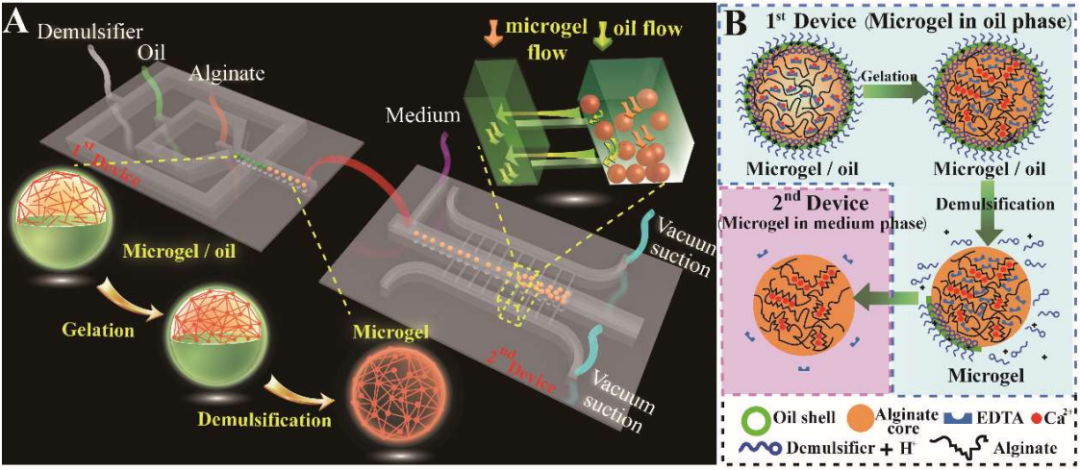
基于雙極性電極陣列的微流控芯片,可實現細胞可控、非接觸三維旋轉

用于人體汗液和體溫多功能檢測的可穿戴微流控汗液傳感系統





 基于載酶金屬有機框架的微流控平臺實現單細胞代謝物分析
基于載酶金屬有機框架的微流控平臺實現單細胞代謝物分析











評論