雙光子顯微鏡是對深層散射組織進行活體觀測不可或缺的儀器,以其遠超單光子顯微成像的穿透深度而受到生命科學和醫學研究的廣泛關注。然而,傳統雙光子顯微成像的點掃描成像模式從根本上限制了其成像通量與三維感知速度,極易受復雜活體成像環境干擾,同時激發點巨大的瞬時光強會對活體生物樣本造成持續性的非線性光損傷,導致高速三維成像時長嚴重受限,極大地制約了病理學、免疫學和腦科學的發展。
針對這些難題,2023年5月12日,清華大學戴瓊海、吳嘉敏、祁海共同通訊在Cell期刊上發表題為Two-photon synthetic aperture microscopy for minimally invasive fast 3D imaging of native subcellular behaviors in deep tissue 的研究論文。首次提出了基于空間約束的多角度衍射編碼,實現非相干光孔徑合成;建立了雙光子合成孔徑顯微術(Two-photon synthetic aperture microscopy, 2pSAM),“化點為針”,通過多角度針狀光束的掃描在實現高速三維感知的同時,將雙光子成像光毒性降低了1000倍以上;融合了戴瓊海院士團隊2021年同樣在Cell期刊上所提出的數字自適應光學架構,具備高速多區域像差矯正能力,即使在惡劣復雜活體環境下依然保持近衍射極限的空間分辨率,并進一步提升了傳統雙光子成像的穿透深度。基于此,2pSAM能夠在哺乳動物深層散射組織中非侵入式地觀測大范圍亞細胞級動態變化,將毫秒級三維連續觀測時長從數分鐘提高到數十小時,為系統性地研究大規模細胞在不同生理與病理狀態下的交互作用打開了大門。交叉研究團隊利用2pSAM在小鼠活體觀測到了一系列新現象,包括急性腦損傷后腦組織內周的多細胞互作,神經元在超長時程連續觀測下展現出對視覺刺激的表征穩定性與功能多樣性,以及首次完整高速記錄下了小鼠免疫反應過程中淋巴結生發中心的形成過程,為病理學、腦科學和免疫學的研究打開了新窗口。

傳統雙光子顯微鏡使用“點掃描”的方案對三維樣本進行掃描,類似于共聚焦熒光顯微鏡,由于雙光子成像的非線性效應使其能夠獲得數倍于單光子成像的穿透深度。例如,雙光子顯微鏡在小鼠大腦皮層的最大穿透深度可以達到1 mm。然而,這種點掃描方式嚴重限制了雙光子顯微鏡的三維成像速度與數據通量,并且由于在聚焦點位置極大的瞬時光強帶來了非常嚴重的非線性光損傷隱患。2pSAM采用了軸向景深拓展的“針掃描”方案,通過改變針狀光束的不同傾角實現樣本三維信息的多角度投影,類似CT一樣實現快速三維成像;同時,受到雷達成像中合成孔徑方法的啟發,通過在像面處引入針孔所帶來的空間衍射編碼約束,實現了非相干光的孔徑合成,將多角度信息融合為大數值孔徑對應的高空間分辨率;進一步利用樣本的時空連續性先驗,有效避免了視角掃描帶來的時間分辨率損失。這樣一種全新的計算雙光子成像架構,在保留雙光子本身深層組織穿透能力的同時,將有效成像通量提升了三個數量級以上。
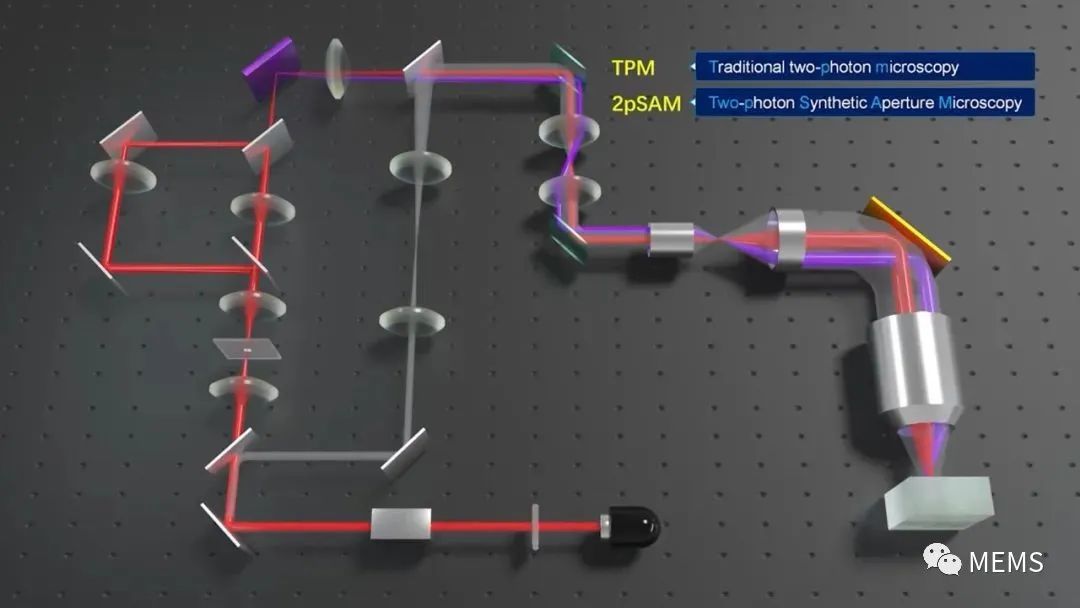
圖1雙光子合成孔徑顯微術(2pSAM)系統圖
除此之外,樣本引起的光學像差給顯微成像帶來的分辨率與信噪比損失十分嚴重,隨著成像深度的增加這種降質尤為明顯。目前雙光子成像中的硬件自適應光學技術主要面臨著以下一些問題:1、成像系統復雜、成本高昂;2、有效校正視場有限,大視場多區域校正速度緩慢。2pSAM通過激發光編碼獲得了超精細的四維空間角度光場數據,能夠使用數字自適應光學架構(DAO),無需在光學系統中增加額外的波前傳感器或者空間調制器,就能實現信號采集與自適應像差校正的解耦,在后處理端完成大范圍多區域自適應光學,顯著提升在復雜成像環境中的空間分辨率與信噪比。
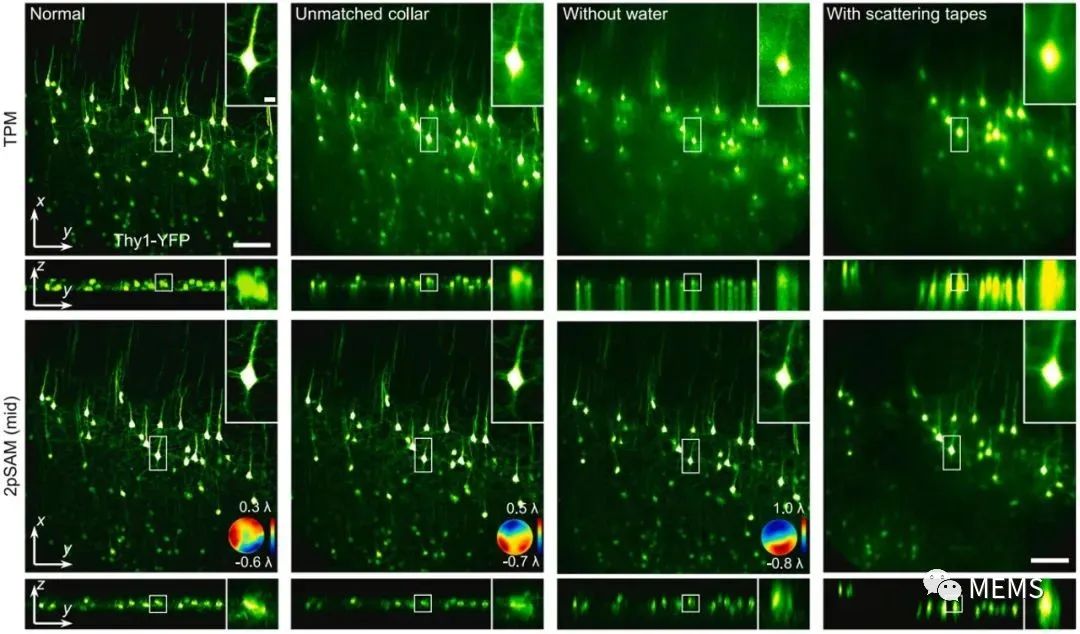
圖2 雙光子合成孔徑顯微術(2pSAM)結合數字自適應光學(DAO)與傳統雙光子顯微鏡(TPM)面對復雜成像條件下的結果對比。從左至右依次為:正常條件下拍攝,物鏡校正環不匹配情況下拍攝,物鏡為水鏡且缺乏浸潤水的情況下拍攝,物鏡與樣本之間增加散射膠帶后進行拍攝。
長時間的激光照射會對活體樣本產生嚴重的光毒性。研究團隊發現,傳統雙光子顯微成像由于使用飛秒激光激發與高NA會聚,在樣本局部會產生巨大的瞬時光強,由此所產生的非線性光毒性在以往被極大地低估了,而一旦在長時程成像過程中,就會不斷積累損傷從而影響細胞正常狀態。與之對比,2pSAM化點為針,通過軸向景深拓展,在保持同樣熒光激發效率的前提下,將瞬時峰值功率降低了1000倍,從而有效解決了非線性光損傷的問題。一方面能顯著減少熒光探針的光漂白,對于同一類易淬滅染料,在同樣激發光強下,傳統雙光子僅能拍攝幾十個三維體,而2pSAM能夠連續拍攝幾十萬個三維體而沒有明顯的信號衰減。除此之外,團隊還對小鼠腦皮層中的小膠質細胞與腦損傷過程中的中性粒細胞進行了連續成像測試,發現即使使用較弱的光強,傳統雙光子顯微成像在連續拍攝半小時以上時仍會導致大量細胞凋亡,而在2pSAM成像過程中細胞保持了正常的表型,并且相比于對照組結果無明顯差異。團隊通過一系列在體與離體實驗充分證明了2pSAM能夠將傳統雙光子成像的光毒性下降三個數量級以上,為長時程高速活體組織成像打開了新窗口。
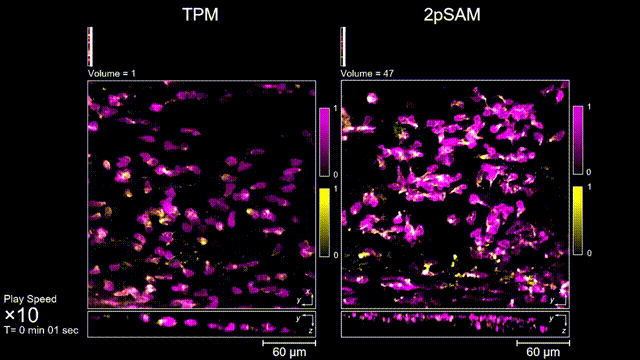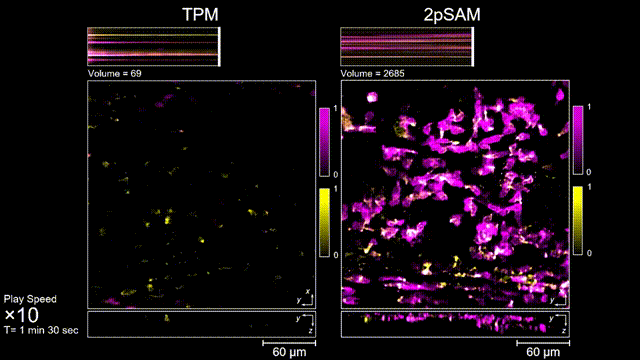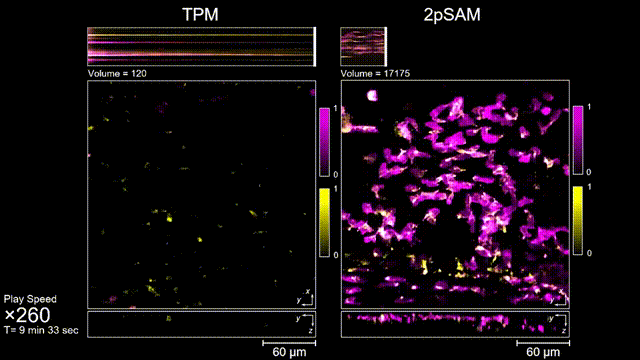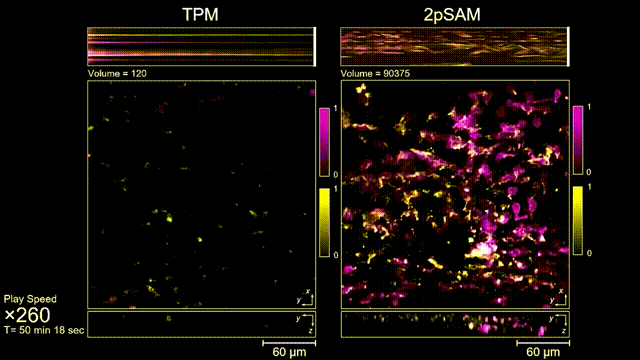
圖3 小鼠大腦急性開窗損傷后的皮層免疫細胞成像,TPM(左)與2pSAM(右)光漂白對比。
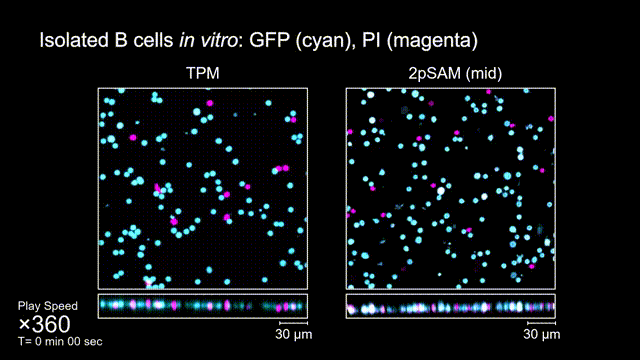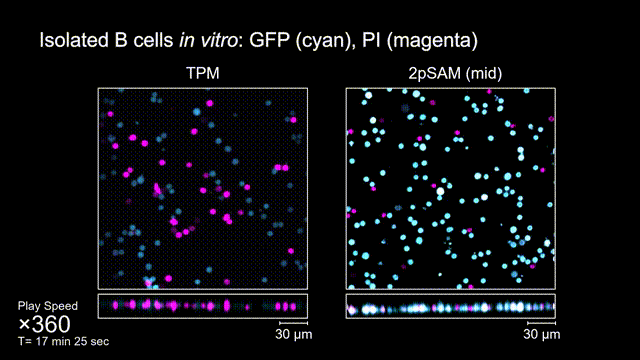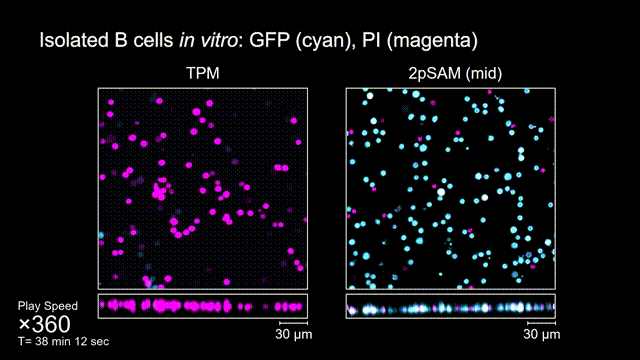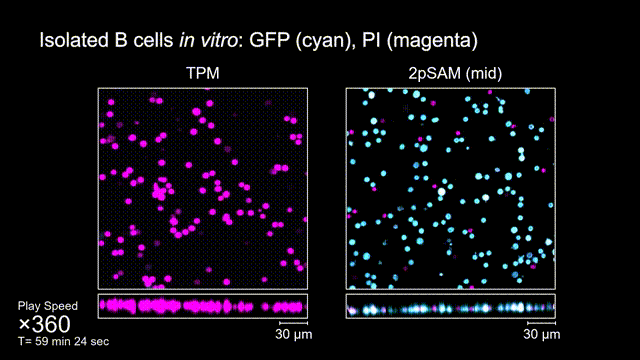
圖4 離體B細胞(GFP,藍色通道)連續拍攝實驗:使用PI標記細胞凋亡(紅色通道),對比TPM(左)與2pSAM(右)的光毒性。
生發中心(Germinal center, GC)是次級淋巴器官中的動態組織區域,是被抗原激活后的B細胞在趨化作用引導下聚集形成的結構,也是產生高親和力抗體及形成長期免疫記憶關鍵場所。但是由于GC形成的隨機性和免疫細胞本身對光損傷的敏感性,完整的GC形成過程從未被高速長時間的清晰記錄過。借助2pSAM,得以首次完整清晰地觀測到了免疫反應下GC形成的全部過程。研究人員將帶有熒光標記的抗原特異性B細胞回輸到小鼠體內,隨后將抗原接種到腹股溝附近以誘導引流淋巴結中生發中心的形成,并于免疫后90到110個小時內(生發中心未形成期),在大視場下持續地對淋巴結中抗原特異性B細胞的動態行為進行追蹤,成功揭示了GC形成過程中B細胞的分裂增殖是GC形成的主因,輔助以周圍活化B細胞的聚集。由于拍攝時長達十余小時,淋巴結本身會產生劇烈的形變,2pSAM通過多視角信息能夠進行實時軸向聚焦位置反饋,實現自動對焦,有效避免了長時程拍攝過程中的樣本漂移。
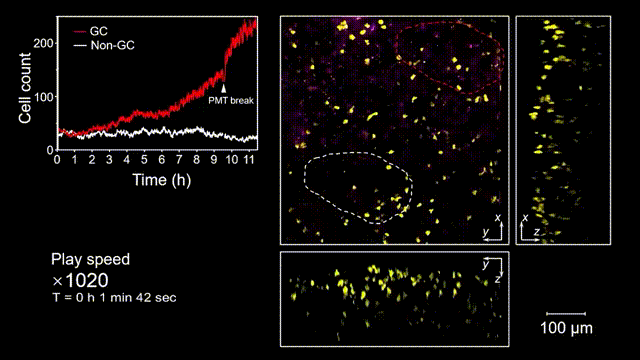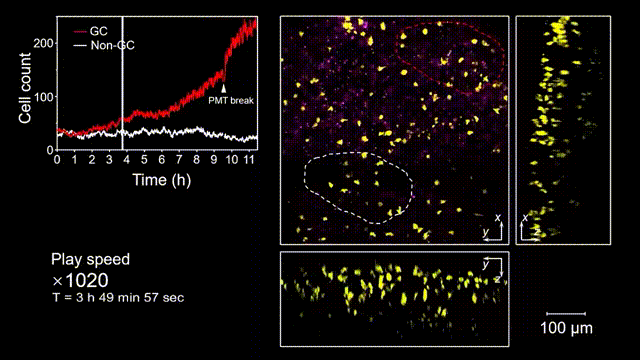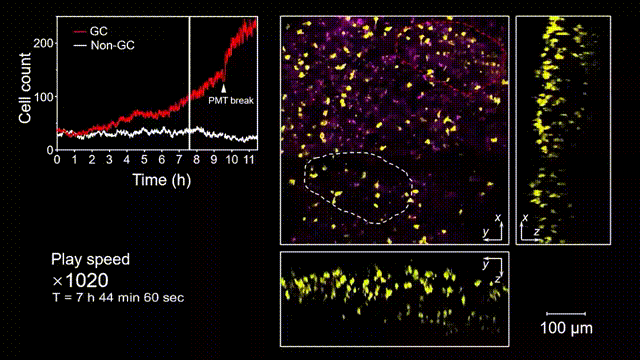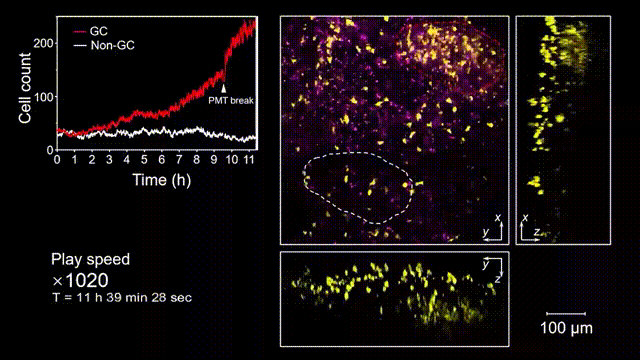
圖5 小鼠腹股溝淋巴結免疫反應后生發中心形成過程的完整觀測和記錄
研究人員進一步借助2pSAM在患有創傷性大腦損傷(Traumatic brain injury, TBI)的小鼠和正在接受視覺條紋刺激的GCaMP轉基因小鼠進行腦皮層組織的細胞動態觀測。在TBI小鼠受傷區域磨薄顱骨后觀測到了外周免疫細胞中性粒細胞在浸潤后與內周星形膠質細胞的相互作用,如通過直接接觸定向產生遷移體(migrasome)來傳遞物質和信息。對GCaMP轉基因小鼠開顱恢復2周后進行視覺上的條紋刺激,進一步證實了長達數小時內小鼠視覺皮層神經元鈣信號對不同方向條紋選擇性表達的持續性和穩定性,同時也通過長時程功能數據挖掘出了多種單細胞水平的神經響應類型,體現了神經元的功能多樣性。這些現象對于傳統雙光子顯微鏡而言都極具挑戰,特別是會由于光毒性本身導致會導致細胞異常表現,比如會導致神經元在長時程拍攝過程中響應強度不斷下降。
清華大學自動化系博士生趙志鋒、周逸亮、醫學院基礎醫學系博士后劉波、自動化系博士后賀敬為該論文的共同第一作者,清華大學自動化系、腦與認知科學研究院、清華-IDG/麥戈文腦科學研究院戴瓊海教授,吳嘉敏助理教授,醫學院基礎醫學系祁海教授為論文共同通訊作者,趙家胤、蔡燁怡、范靜濤、李欣陽、王紫霖、盧志參與并做出重要貢獻。
原文鏈接:
https://doi.org/10.1016/j.cell.2023.04.016
審核編輯 :李倩
-
自動化
+關注
關注
29文章
5725瀏覽量
81258 -
顯微鏡
+關注
關注
0文章
606瀏覽量
23857 -
神經元
+關注
關注
1文章
368瀏覽量
18712
原文標題:衍射編碼雙光子合成孔徑顯微術,實現深層活體組織時空跨尺度觀測
文章出處:【微信號:MEMSensor,微信公眾號:MEMS】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
高分辨率合成孔徑雷達圖像的直線特征多尺度提取方法
合成孔徑雷達的工作原理是什么?
怎么實現合成孔徑雷達衛星電磁兼容設計?
合成孔徑雷達衛星
合成孔徑雷達圖像處理電子書

合成孔徑雷達的研究熱點解析
載合成孔徑雷達系統的接口實現與設計
合成孔徑雷達的工作原理_合成孔徑雷達的特點作用
合成孔徑成像的原理及發展



















評論