電池中的能量實際上來自哪里?讓我們仔細看看!
這是我的電池連接到手電筒燈泡以構成一個簡單的電路。我打開了一個回形針來做一根連接線,我把它夾在電池底部和燈泡側面之間。如果你仔細看,你會發現燈泡在發光。那是因為電子正在穿過它!
陽極和陰極?
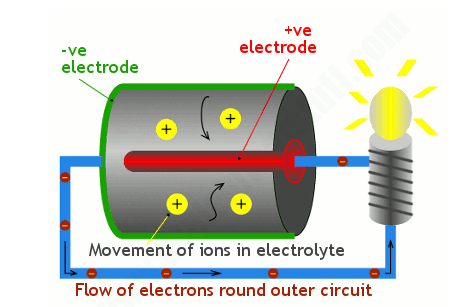
現在這是里面發生的事情。電池的正極端子(在照片中顯示在我左手拇指的正上方,在下面的插圖中顯示為紅色)連接到大部分隱藏在電池內部的正極。我們稱之為陰極。外殼和電池底部構成負極端子或負電極,在藝術品中也稱為陽極 ,顏色為綠色。曲別針線在藝術中由藍線表示。
讓我們快速澄清一點困惑。在學校,你可能知道陰極是負極,陽極是正極?然而,這實際上僅適用于電解 (通過化學物質傳遞電流以將其分解)之類的事情。電池就像倒退的電解(它們分解化學物質來發電),所以陽極和陰極這兩個術語會互換。好的?為避免混淆,我建議最好不要使用陽極和陰極這兩個術語。最好說“正極端子”和“負極端子”,這樣你的意思就很清楚了,不管你是在談論電池還是電解——或者任何其他有陰極的東西。
化學反應
現在回到我們的電池。正極和負極被化學電解液隔開。它可以是液體,但在普通電池中更可能是干粉。
當您將電池連接到燈并打開時,化學反應開始發生。其中一個反應在負極產生正離子(此處顯示為大黃色斑點)和電子(較小的棕色斑點)。正離子流入電解質,而電子(較小的棕色斑點)繞著外部電路(藍線)流向正極,并使燈在途中點亮。在正極發生單獨的化學反應,進入的電子與從電解質中取出的離子重新結合,從而完成電路。
由于電池內部發生的化學反應,電子和離子會流動——通常是兩個化學反應同時進行。確切的反應取決于制造電極和電解質的材料。(本文進一步給出了一些例子,我們比較了不同類型的電池。如果您想了解更多關于特定電池的反應,請輸入您感興趣的電池類型,然后輸入“anode cathode”在您最喜歡的搜索引擎中搜索“反應”。)無論發生什么化學反應,電子圍繞外電路運行以及離子與電解質反應(移入或移出)的一般原理適用于所有電池。當電池產生電能時,其內部的化學物質會逐漸轉化為不同的化學物質。它們發電的能力減弱,電池電壓慢慢下降,最終電池電量耗盡。換句話說,如果電池因為內部化學物質耗盡而無法產生正離子,那么它也無法為外部電路產生電子。
現在你可能會想:“等一下,這沒有任何意義!為什么電子不走捷徑,直接從負極通過電解質跳到正極?事實證明,因為電解質的化學性質,電子不能以這種簡單的方式流過它。事實上,就電子而言,電解質幾乎是一個絕緣體:它們無法跨越的屏障。它們最簡單的正極路徑電極實際上是通過外電路流過。
-
正極
+關注
關注
0文章
53瀏覽量
10305 -
燈泡
+關注
關注
0文章
109瀏覽量
24016 -
負極
+關注
關注
0文章
66瀏覽量
9460 -
電池
+關注
關注
84文章
10564瀏覽量
129515
發布評論請先 登錄
相關推薦




鋰氧電池是如何工作的?一文揭曉其中的貓膩
救生衣上的電池如何工作
銀鋅蓄電池是如何工作的?資料下載

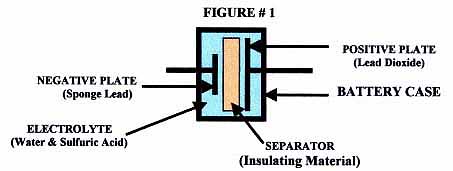
鉛酸電池是如何工作的




 電池是如何工作的
電池是如何工作的










評論