什么是吸附?
有時候,化學物質會吸附在表面上,這種現象可能發生在氣相中的固體表面以及浸沒在液體溶液中的固體表面。化學物質在表面上聚集的能力在傳感和分離過程中都非常有用,這也是催化反應的一種方式。
粘附在表面的過程稱為吸附。請不要將吸附與吸收一詞混淆,吸收是指一種化學物質被吸收到固體或溶液中。
BET 多層吸附示意圖,這是吸附的其中一種類型。圖片由 Life of Riley 提供。在CC BY-SA 3.0許可下使用,通過Wikimedia Commons分享。
吸附可能涉及表面與被吸附物之間的化學鍵形成(化學吸附)或者涉及表面與被吸附物之間通過氫鍵或范德華力等分子間作用力產生的吸引(物理吸附)。一般來說,物理吸附分子在表面上更容易發生移動,吸附力也比較弱。
等溫吸附
吸附過程可以描述為平衡反應:
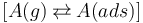
其中,氣相中的化學物質 A(g) 稱為吸附物:它以一定的吸附速率被吸附,然后以一定的解吸速率進行解吸。
我們如何從數學上描述這個平衡反應呢?最簡單的方法之一是美國物理化學家 Irving Langmuir 發現的。在他的模型中,他提出了以下假設:
- 吸附物有一個最大表面濃度csat (mol^-2),在該濃度下表面是飽和的
- 吸附速率常數不依賴于吸附物的表面覆蓋率:也就是說,所有吸附點都是相同且相互獨立的
- 吸附是一個二階過程,其速率與鄰近表面的本體相中的吸附物濃度以及空位的比例成線性關系
- 解吸是一個一階過程,其速率與吸附物的表面覆蓋率內呈線性
通過這些假設,我們可以將表面上由吸附作用導致的物質通量使用如下公式描述:
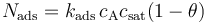
其中 Nads 是表面上的通量 (mol m^2s^-1) ;kads 是吸附速率常數 (m^3 mol-1 s-1);cA 是鄰近本體相中表面的濃度 (mol m^-3);θ 是吸附物的表面覆蓋率,= cA,ads/csat(無單位),因此(1-θ)是空位的比例。
同樣,由于解吸而離開表面的物質通量為:
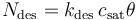
其中,kdes是解吸速率常數 (s-1)。
在平衡狀態下,吸附物的表面覆蓋率是恒定的,因此吸附在表面和離開表面的通量必須相等。使上面的表達式相等并消去同類項,可以得到:
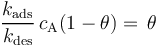
吸附速率常數與解吸速率常數的比率 (kads / kdes)是吸附的平衡常數,通常用大寫字母表示為Kads。平衡常數越大,吸附的熱力學驅動力越大。然后,通過重新排列上面的表達式,我們將表面覆蓋范圍表示為:
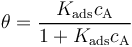
這是 Langmuir 等溫吸附。在給定溫度條件下, Kads 取某一特定的值,我們可以預測平衡狀態下吸附物的表面覆蓋范圍隨其本體濃度變化的情況。
當然,Langmuir 的模型是簡單的近似。在真實系統中,通常情況下相鄰吸附分子之間存在相互作用,因此隨著表面覆蓋范圍的增加,吸收額外的物質變得更容易或更困難。所以,研究人員開發了更復雜的數學模型來更精確分析真實的吸附系統。需要指出的是 Freundlich 等溫吸附模型,其中包含一個額外的經驗常數,可以分析吸附分子之間的相互作用。BET 等溫吸附模型可用于發生多層吸附的系統,在這樣的系統中,吸附分子的第二層和隨后的外層與吸附物質的分子結合,而不是與化學基質的下表面結合。
在 COMSOL Multiphysics? 軟件中定義吸附
在使用 COMSOL Multiphysics? 軟件建立化學物質傳遞和反應模型時,您可以使用一系列工具在模型中引入吸附效應。
對于均質多孔介質中的吸附,有一個特殊的吸附子節點可用于多孔介質傳遞屬性和部分飽和多孔介質域特征。在這個子節點中,您可以為任何本體物質定義“Langmuir”、“Freundlich”或“用戶定義”吸附。這里,我們假設被吸附物質與本體處于熱力學平衡狀態,因此等溫吸附關系完全成立。有關如何使用該吸附子節點的示例,請參見下面的屏幕截圖:
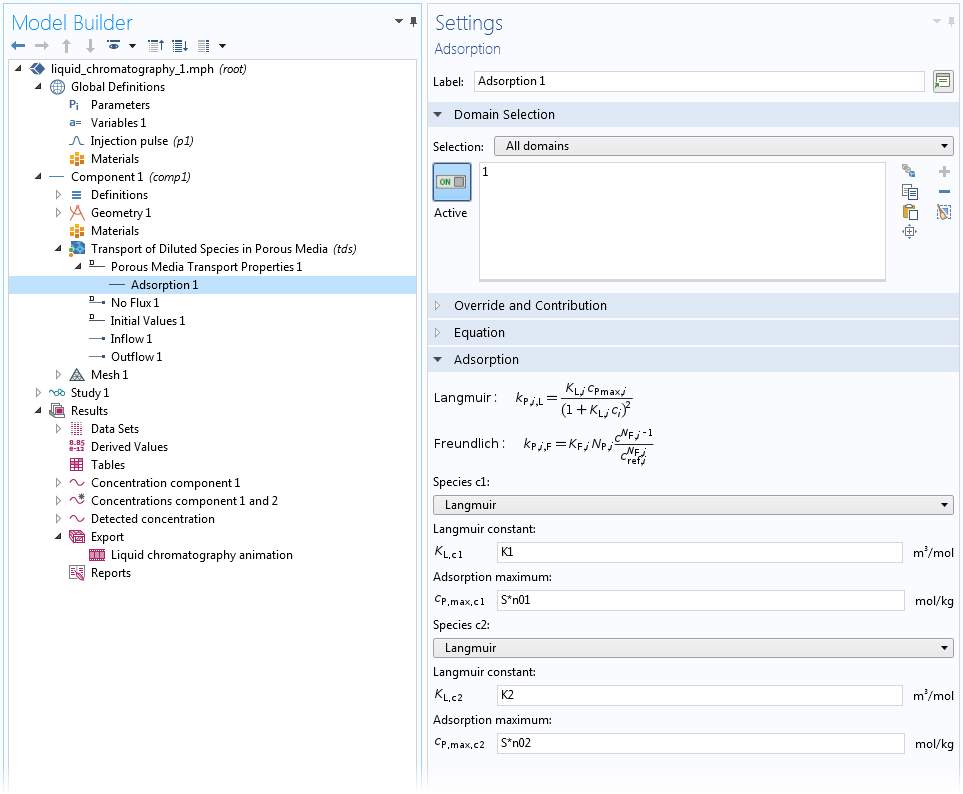
使用 Langmuir 等溫吸附的高效液相色譜(HPLC)系統模型中均勻介質上兩種物質的吸附設置。
如果吸附或解吸過程是吸附和解吸動力學控制的,使得速率常數變得很重要,并且表面不保持平衡,那么設置中會涉及更多的細節。有必要使用附加的接口來描述吸附物質的表面濃度。正如本系列第一篇文章中所討論的,您可以使用表面反 接口來描述吸附物質。或者,如果描述多孔介質中的表面分布,可以使用稀物質傳遞接口,并將該物理中的擴散系數和對流速率場設置為零。
吸附過程表示將物質從本體(氣體或液體溶液)相轉移到表面的通量。通過在邊界添加這樣的通量或在均質域中添加反應,可以表達上面所示的吸附反應。此反應的動力學和熱力學可以設置為遵循 Langmuir 等溫吸附或更復雜的反應機制,包括用戶定義的任意形式的動力學表達式。請注意,直接在物質名稱后面鍵入(ads)也可以將吸附物質構建到反應工程或化學接口中定義的反應機制中。
使用自定義的化學反應方程來描述吸附的另一個原因是競爭性吸附的情況,在這種情況下,兩種或多種被吸附物質會共享相同的吸附點。這種現象是催化劑中毒的常見原因:由于另一種分子具有較強吸附力,催化劑無法吸附預期的物質,這可能導致反應所需的催化劑永久失活。
涉及吸附的模型示例
在 COMSOL Multiphysics “案例庫”中,您可以找到一系列演示不同類型吸附建模的教學模型。
液相色譜法
高效液相色譜(HPLC)系統使用一維模型建模,其中模擬的尺寸代表色譜柱中流動相的流動長度。這里,由兩種不同組分的 Langmuir 平衡常數表示的不同吸附平衡導致不同程度的停留時間。由于溶劑的穩定流動與不同的吸附速率的共同作用,導致不同的吸附組分在空間和時間上分離。
這里,結合使用多孔介質稀物質傳遞接口與吸附子節點來表示平衡吸附過程。
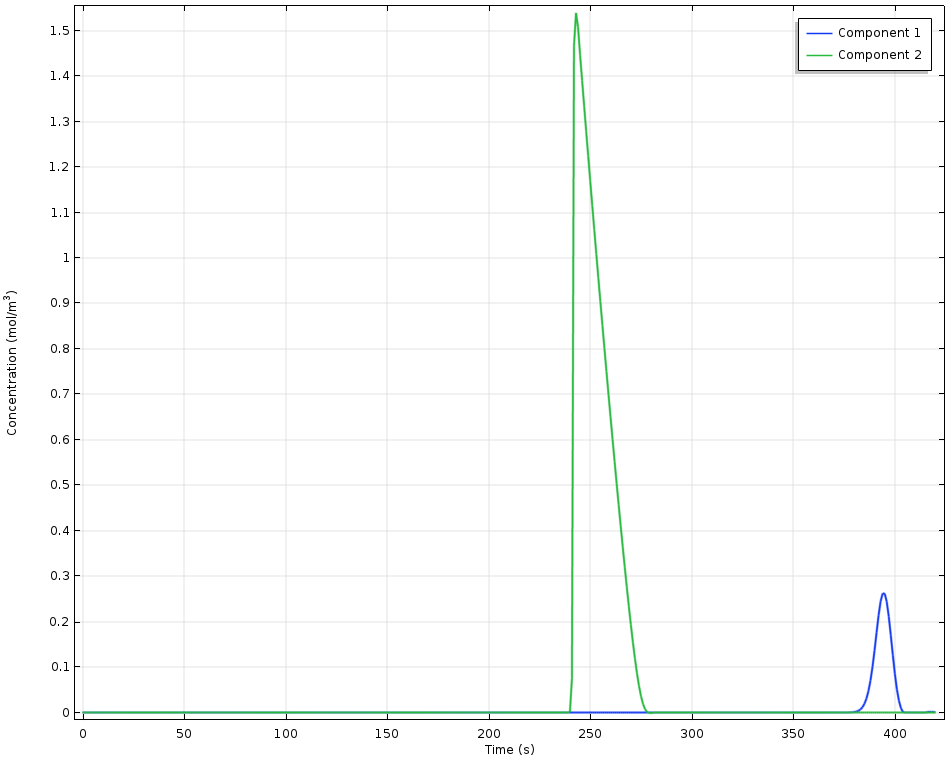
高效液相色譜實驗中檢測到的濃度隨時間的變化。組分 1 具有較高的吸附能力,因此存留時間更長。
蛋白質吸附
在離子交換柱中,蛋白質吸附在柱表面,并置換離子,如前一篇關于蛋白質吸附過程的博客文章所述。化學接口可用于描述多種相互作用蛋白質的更復雜的反應機制,該接口可與稀物質傳遞接口(用于在溶液中遷移的物質)和表面反應接口 (用于被吸附物質)相耦合。
離子交換柱中的蛋白質吸附。
傳遞和吸附
在本例中,我們使用稀物質傳遞接口描述溶液中物質的擴散和對流。同時,化學物質也會吸附在特定邊界上的活性中心上。在該邊界上,我們使用一般形式邊界偏微分方程來表達用戶定義的表面覆蓋方程。如上所述,該動力學方程基于吸附和解吸速率的 Langmuir 近似,但不假設反應達到平衡。因此,Langmuir 等溫吸附本身不一定成立。而吸附和解吸通量則需要動態考慮。
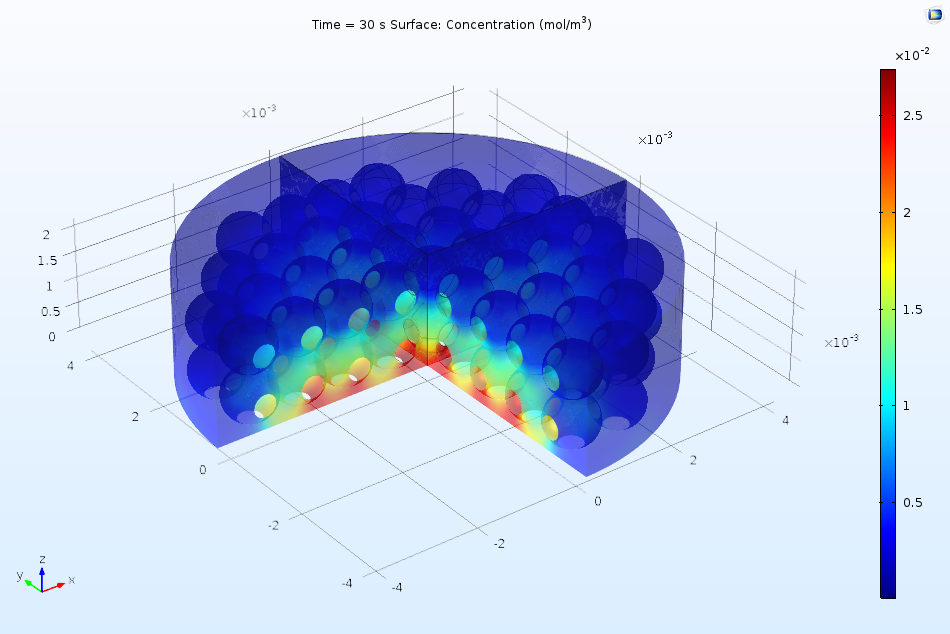
下圖顯示了溶解的吸附物在活性表面的流動如何使吸附的表面濃度隨著時間的推移而逐漸增加。由于濃度在 2 秒后仍在繼續上升,很明顯還沒有達到平衡,因此動力學模型(而不是熱力學模型)更適合描述這一表面過程。一般來說,上游(左邊)的覆蓋率較高,這是因為上游端的流動濃度較高,其中已經發生少量吸附。在下游邊緣,由于擴散的邊緣效應,表面濃度升高。
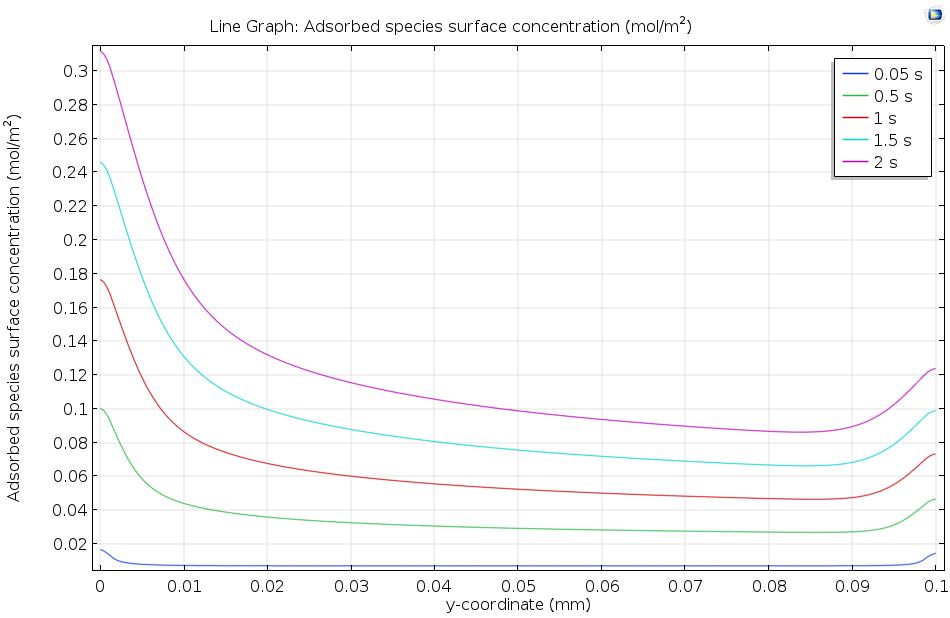
沿活性表面的長度方向繪制吸附物質表面濃度,含有吸附物的溶液在活性表面上流動。隨著時間的推移,吸附物質的濃度增加。
關于表面建模的總結思考
希望通過這一系列文章,您能夠了解為什么表面對于化學過程如此重要,并了解在 COMSOL Multiphysics 的化學模型中包含表面現象的不同方法。
-
HPLC
+關注
關注
0文章
42瀏覽量
12688 -
COMSOL
+關注
關注
34文章
93瀏覽量
55712
發布評論請先 登錄
相關推薦
COMSOL Multiphysics在超材料與超表面仿真中的應用
研究級高性能全自動程序升溫化學吸附儀
三站全功能型多用吸附儀_物理吸附
【Aworks申請】適用于粗糙表面的真空吸附式隧道工況檢測爬壁機器人系統
【OK210申請】適用于粗糙表面的真空吸附式隧道工況檢測爬壁機器人系統
電鍍廢水中鎳(活性炭纖維)的電吸附性能實驗
電極電位對L - 蛋氨酸分子吸附構型影響的表面增強拉曼光譜
吸附式干燥器的運行與選型
微孔吸附劑在化學存儲領域獲得潛在應用
硅片表面有機污染物的吸附行為




 什么是吸附?在COMSOL中模擬表面吸附
什么是吸附?在COMSOL中模擬表面吸附










評論