繼上篇結尾:
——Roukes將其比作功能磁共振成像(fMRI),一種目前用于對整個大腦進行成像的類似技術。他說:"fMRI掃描中的每個體素,或三維像素,通常約為一立方毫米的體積,包含大約10萬個神經元。因此,每個體素代表了所有這10萬個細胞的平均代謝活動。綜合神經光子學的首要目標是實時記錄這10萬個神經元集合中的每個神經元正在做什么。


高分辨率
High Resolution


這意味著研究人員現在可以在高度散射的神經組織中實現神經元活動的密集功能成像,在任意深度提供細胞尺度的分辨率。
Caltech高級研究科學家Moreaux說:"我們的方法是通過在三維空間晶格上分布密集的微尺度光子發射器和探測器像素陣列,從而于在大腦中植入整個無透鏡的成像系統。這些像素陣列被集成到狹窄的硅柄上,結合了硅納米探針制造的最新發展結果。配合功能性分子報告器和光遺傳驅動器,這種新型裝置展現了訊問小鼠大腦皮層的10萬個神經元的所有神經活動的前景。
Roukes表示,該團隊的長期目標是傳播集成神經光子學的先進儀器,以實現多機構合作,利用這種新技術開拓先進的神經科學研究。以前,這種神經技術的開發主要依靠單個實驗室或調查員領導的研究。
大腦計劃背后的團隊走到一起,為神經科學研究帶來了大規模的合作,以前的物理科學中也是如此的。Roukes說,現在,綜合神經光子學為這種儀器建設團隊合作開了一扇門。他說:"許多構建模塊已經存在了十年或更久。但是,直到最近,還沒有人有這樣的眼光、意愿和資金來把它們放在一起,實現這些強大的神經科學工具。
例如,就如Moreaux所說,為了使神經光子探針的光發射器在組織內進行微光束傳輸,研究人員必須促進從現有的紅外光子學電路范式(廣泛用于電信應用)向可見光子學電路的轉變。"更具體地說,用藍光,以適配熒光生物標志物的激發光學光譜。我們在加州理工學院的Kalvi Nanoscience Institute(KNI)的潔凈室開展了這項工作,并與我們在法國Leti-CEA和新加坡AMF的合作伙伴一起推進。"當然,開發由紅外線激活的光遺傳執行器,這種"反向"努力也為使用紅外線光子學電路提供了進一步的可能性。值得注意的是,近紅外光遺傳執行器的開發近來發展勢頭很好。


突破
Breakthrough


最近,在分子報告器方面的一些突破可以實現多模式和多物理感應。同樣,光遺傳執行器能夠對神經活動進行光學控制,以及通過基因編碼影響傳遞分子報告器和提供細胞類型特異性的執行器的。
在挑戰方面,特別是涉及到硬件時,Moreaux覺得一個關鍵的技術挑戰是將光傳輸和光子傳感器整合在同一芯片上,并采用可植入的形狀因素(硅柄)。'換句話說,就是一種既能傳遞圖案化的脈沖光又能進行光子檢測的集成技術,如CMOS和光子學電路(硝酸硅)的集成。
如果該技術要被廣泛采用,該技術的大規模生產能力將是至關重要的。因此,Moreaux說,另一個挑戰是,這種集成能力不僅必須在小規模的概念驗證中實現,而且還必須在代工規模上實現。此外,由于集成神經光子學使用光來引導神經元活動的電信號,如果該技術要用于繪制大腦電路和其他應用,光學報告器方面的開發也是至關重要的。
莫羅說:"雖然在過去十年中,光遺傳報告器(熒光團)領域肯定有很多進展,但為了在綜合神經光子學的背景下優化其使用,有一些挑戰需要考慮。例如,對報告器表達的空間密度進行更精細的控制:密度太高,你就失去了分離神經元的能力,密度不夠,你就無法充分利用該技術。
當然,除了技術上的挑戰,開發這種類型的技術所需的投資也是一個巨大的障礙。莫羅說:"對這種類型的投資的買入,更有可能在有更大機會獲得更大的實際投資回報的領域獲得驅動力,例如在臨床領域。
盡管有這樣一些挑戰,Moreaux認為該方法是可計量的。他說:"我們可以鋪設多個模塊,以密集地覆蓋大腦深處的擴展區域。我們預計,這將最終允許訊問--在大腦的任意位置和深度同時記錄和模式化刺激數百萬個神經元--以單細胞的分辨率和細胞類型的特異性來揭示神經網絡的動態。
莫羅說,通過與代工伙伴的合作,人們實現了在如可見光波長集成納米光子學的低損耗晶圓級的大規模生產過程上的歷史性突破。這反過來又允許在腦組織中演示相干光束的形成;實現微發射器的光束穩定相位陣列的構成和微發射器探針陣列的選擇性平面照明;以及創建可植入的、角度可選擇的單光子微探測器陣列。
莫羅說:"這些構成了具有微觀尺寸的完整植入式可見光波長功能成像系統的基本構件。此外,我們通過開發和實施計算方法來評估散射介質中的熒光光子產量,驗證了集成光子學范式的基礎物理學。有了這些工具,我們已經驗證了我們的計算方法,以進行光源分離和定位,從而能夠確定實用的、可實現的架構,能夠在深度上實現密集的體積活動重建。
這些系統是基于現有電子和光子芯片代工廠已經常規應用的大規模生產過程。莫羅認為,像這樣的行業伙伴關系,對于使這項工作成為商業現實至關重要。他解釋說:"與混合光子學和CMOS制造技術代工伙伴的合作,對于共同整合植入式硅柄上的不同技術功能塊將是非常重要的。同樣,擁有后處理和光電封裝專業知識的行業伙伴也是如此。我們已經與CEA-Leti和AMF,以及IBM和臺積電在CMOS芯片制造方面進行了合作。
研究小組認為,所有這些發展和行業的伙伴關系共同驗證了集成神經光子學的潛力。


虹科伙伴之聲
Lumencor Insights


虹科伙伴Lumencor的技術工程師Iain Johnson就過去15年里發展的光遺傳學技術表達了看法,這些技術是神經科學家們稱手的工具,提供神經網絡以功能復雜性的光譜和空間分辨率數據,同時避免使用歷史上無處不在的微電極進行直接的物理訊問。光遺傳學使用非破壞性的照明來處理細胞和細胞功能,而不是使用侵入性電極。遺傳學 "指的是光激活離子通道蛋白的轉基因表達,需要將光輸入轉變成感興趣的細胞中的電活動。
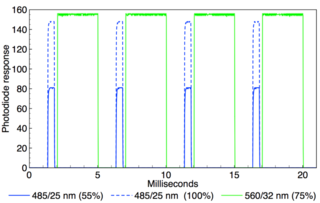
圖1:示波器記錄了由Spectra X光引擎的TTL觸發產生的485nm(0.5ms脈寬)和560nm(3ms脈寬)交替輸出脈沖。兩個疊加的示波器軌跡顯示,其中485nm的強度通過RS232串行命令從100%調整到55%,而560nm的強度保持不變。485nm和560nm脈沖的時間間隔是~0.25ms

虹科Spectra X光引擎
用于光遺傳學刺激的照明源必須在光譜、空間和時間輸出特性方面滿足某些要求。本文考慮的這些特性與基于固態LED和激光的光引擎的性能有關。
光遺傳學主要的光譜輸出要求是光引擎的光譜輸出與可光激活的離子通道蛋白的作用光譜的最大交集。目前,最常用的光譜輸出是475nm,用于刺激channelrhodopsin(ChR2),575nm用于抑制halorhodopsin(NpHR)。基于LED的光引擎提供的光譜輸出在時間上是不連續的(圖1),但在空間上是重合的。額外的光譜輸出有利于使用新的光蛋白,并為熒光標記和電壓敏感的染料提供激發,與光遺傳刺激或抑制并行:例如,1. 通過使用近紅外(>700nm)光刺激,可以達到更深的組織滲透。2. 通常的做法是使用黃色熒光蛋白(YFP)的共同表達,以便通過熒光顯微鏡確定ChR2的位置。3. 選擇YFP是因為它的熒光激發(510nm)與ChR2的光刺激(475nm)有足夠的波長間隔,這兩個過程可以獨立啟動。
對于大腦切片或培養的神經元制劑的體外實驗,基于LED的光引擎與熒光顯微鏡相配合,提供了適合同時刺激數千個神經元的寬場照明。對于ChR2的刺激,在樣品平面上需要1mW/mm2的輻照度閾值,這個水平是用于傳統熒光顯微鏡的低端范圍。空間選擇性的照明可以通過添加數字微鏡設備(DMD)來產生。
對于單個細胞的選擇性刺激,需要能聚焦到衍射有限的光斑尺寸<10μm的激光器。體內實驗提供了額外的能力來觀察光遺傳刺激引起的復雜行為結果。光通常通過直徑為200μm的多模光纖傳輸,連接到植入動物大腦的插管上。與LED相比,激光在這些光纖中具有更好的耦合效率,因此是體內光遺傳學的首選光源。
神經元的電活動是在毫秒級的時間范圍內被調制的。因此,用于光遺傳學刺激的照明源必須具有相同時間尺度的光學調制能力(圖1)。Kubota和同事最近發表的一篇文章充分利用了虹科Spectra X光引擎提供的時間和輸出功率控制,對表達ChR2的大鼠背根神經節(DRG)神經元進行了光刺激。記錄了恒定強度下不同的光脈沖持續時間(0.1至10ms)和恒定脈沖寬度下不同的刺激強度(2至78mW)的影響。
此外,用一對0.5ms的脈沖隔開5至20ms的不同間隔進行刺激,以評估ChR2脫敏的效果。
總的來說,光遺傳學和傳統電刺激的定量比較結合,為以前不熟悉光遺傳學技術能力的讀者提供了一個有用的參考點。
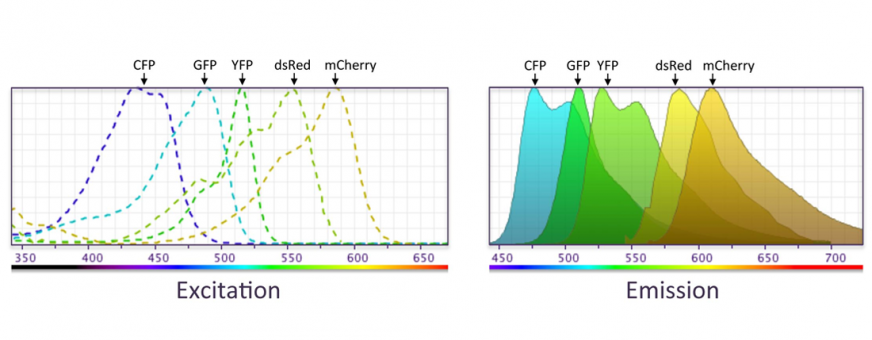
1什么是熒光分子報告器(Fluorescent molecule reporter)
又稱熒光蛋白/報告分子,為測量單個細胞或細胞群的基因表達的工具。;如GFP, CFP, YFP, mCherry...
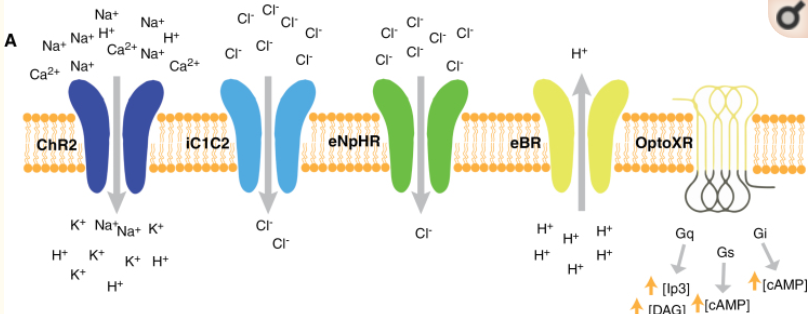
什么是光遺傳學執行器(Optogenetic actuator)
一種可改變細胞活動的蛋白質。當暴露于光照時,其就會表達。這些致動器可以用來誘導單個或多個動作電位(可以組織成有規律的尖峰序列,也可以以用戶控制的速度進行偽隨機),抑制神經活動,或修改生化信號通路,對事件的時間進行毫秒級控制。如ChR2, IC1C2, eNpHR等
-
示波器
+關注
關注
113文章
6267瀏覽量
185383
發布評論請先 登錄
相關推薦
“具身風暴”完成超千萬天使輪融資
虹軟ArcMuse計算技術引擎全面升級
虹科培訓 | 重磅來襲!波形分析課程全面上線!

工業交換機引起廣播風暴怎么辦?

虹科方案 領航智能交通革新:虹科PEAK智行定位車控系統Demo版亮相

虹科應用 當CANoe不是唯一選擇:發現虹科PCAN-Explorer 6
虹科直播 | 令你耳目一“新”的新能源車診斷分享

倒計時7天搶先預約!虹科邀您共赴國際CiA中國技術日

工業交換機如何防止廣播風暴
SpaceX星鏈服務因地磁風暴影響退化
虹科干貨丨輕松掌握PCAN-Explorer 6,dll調用一文打盡!




 虹科技術丨頭腦風暴 (下)
虹科技術丨頭腦風暴 (下)











評論