驗證的由來
20世紀50至60年代,美國輸液藥劑的污染導致了各種敗血病病例的產生。FDA調查結果表明,與敗血癥案例相關的批次藥物并不是由于企業沒做無菌檢查或違反藥事法規的條款將無菌檢查不合格的批號投放了市場。問題在于無菌檢查本身的局限性、設備或系統設計建造的缺陷以及生產過程中的各種偏差及問題。FDA將這類問題歸結為“過程失控”,FDA從敗血癥案例的調查分析中深切地體會到產品需要檢驗,然而檢驗并不能確保藥品的質量。從質量管理是系統工程的觀念出發,FDA當時認為有必要制訂一個新的文件,以

“通過驗證確立控制生產過程的運行標準,通過對已驗證狀態的監控,控制整個工藝過程,確保質量”
為指導思想,強化生產的全過程控制,進一步規范企業的生產及質量管理實踐。
這個文件即是1976年6月1日發布的“大容量注射劑GMP 規程(草案)”,它首次將驗證以文件的形式載入GMP史冊。實踐證明,驗證使GMP的實施水平躍上了一個新的臺階, 因此專家認為該規程是GMP發展史上新的里程碑。
2.苛刻的要求與時代的需求
隨著醫療技術的飛速發展,無菌醫療器械的應用也越來越廣泛,滅菌過程作為無菌醫療器械生產的特殊過程,是醫療器械生產過程中的需要定期驗證和重點控制的過程。
產品滅菌的目的是使產品無任何類型的存活微生物,在滅菌過程中,微生物的死亡規律是用指數函數表示的。因此任何單位產品上微生物的存在可用概率表示,概率可以減少到很低,但不可能為零。該概率可用無菌保障水平 (SAL) 表示,通常無菌概念是指無菌保障水平 (SAL) 達到 10-6。
醫療器械滅菌驗證一般分為
安裝確認 (IQ):獲得證據并用文件證明滅菌設備及其附屬設施,已按規定的要求被提供和安裝 ;
操作確認 (OQ):當設備按程序運行時,獲得證據并用文件來證明已安裝的設備,有能力在指定的允差范圍內提供特定的過程 ;
性能確認 (PQ):獲得證據并用文件證明設備能夠在預先設定的參數下持續運行,且這個過程加工后的產品是無菌的。性能確認一般包括物理性能確認和微生物性能確認,器械所使用的材料對滅菌方法的適用性,也是性能驗證中的重點。
3.虹科溫度驗證系統
E-Val Pro - 有線驗證系統

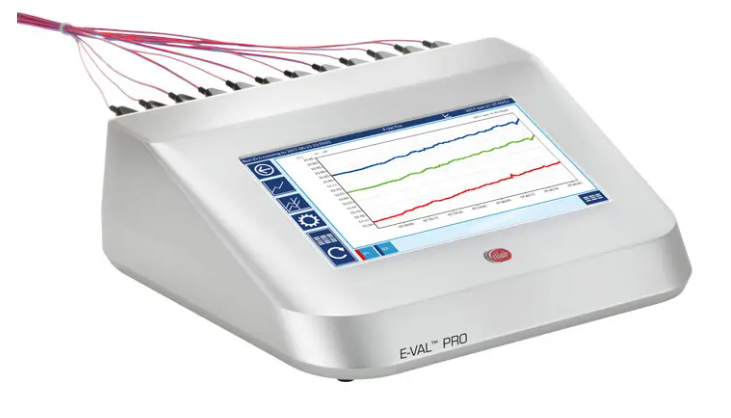
-
尺寸緊湊且重量輕,在受控環境中非常容易操作。
-
符合 FDA 法規和 GAMP 指南,旨在成為任何熱驗證過程的理想解決方案。
-
安全且受密碼保護的模塊最多可處理40個熱電偶,大內存一次最多可保存10個研究。
-
內置8小時電池,可作為獨立裝置使用或通過 LAN/USB 連接到 PC。
-
提供4和12通道陣列,可以處理所有熱電偶類型以及模擬和數字輸入。

Tracksense Pro--無線驗證系統


-
是一種耐用,智能,準確且高度靈活的系統,用于測量溫度,壓力,濕度,電導率,CO2,真空和蒸汽滲透率。
-
通過將適當的記錄儀與選定的可互換傳感器結合使用,最終為用戶配置了TrackSense Pro無線數據記錄儀解決方案。可以輕松地在測量參數和多種不同的傳感器選件之間進行切換。
-
可在傳感器和記錄儀之間放置一個SKY模塊形式的實時數據通信選件,從而可以將實時數據直接傳輸到PC。
這些功能使TrackSense Pro數據記錄儀與大多數應用程序兼容,因此成為了最通用的選擇。

關于虹科和Ellab(意萊伯)

自1949年以來,Ellab一直提供行業領先的精度和品質的熱驗證解決方案。虹科Ellab的硬件和軟件由丹麥的總部設計、制造和分銷,虹科與Ellab(意萊伯)合作提供驗證系統,校準系統,驗證和確認以及租賃服務和校準服務,服務于大型、中型、小型的制藥、醫療和食品行業的客戶。我們在滅菌,冷凍干燥,隧道式烘箱,巴氏殺菌等多種應用提供解決方案。
原文標題:【虹科分享】想保障制藥無菌生產,您需要的是驗證
文章出處:【微信公眾號:醫安與電子技術】歡迎添加關注!文章轉載請注明出處。
-
醫療器械
+關注
關注
19文章
823瀏覽量
51433
發布評論請先 登錄
相關推薦
虹科培訓 | 重磅來襲!波形分析課程全面上線!

虹科方案 領航智能交通革新:虹科PEAK智行定位車控系統Demo版亮相

無菌制藥物聯網監控管理系統解決方案
虹科案例|為什么PCAN MicroMod FD是數模信號轉換的首選方案?

E-Val Pro Plus有線驗證解決方案,功能升級,優化制藥流程,確保安全性和合規性!
虹科分享丨無線數據記錄儀與傳統有線熱電偶系統的對比優勢
虹科方案 | 符合醫藥行業規范的液氮罐運輸和存儲溫度監測解決方案

革新監測技術:無線數據記錄系統如何顛覆食品、醫療和制藥行業的驗證流程

提高生產效率!虹科MSR165快速檢測機器故障,實現精準優化
PLC遠程監控在制藥行業的應用

AtomGit教程 | 使用AtomGit雙因素驗證保障您的賬戶安全





 【虹科分享】想保障制藥無菌生產,您需要的是驗證
【虹科分享】想保障制藥無菌生產,您需要的是驗證











評論