微流控技術是一種對微尺度流體(微升到皮升量級)進行精確控制和操縱的技術。近二三十年來,得益于納米制造技術的成熟與生化技術對操縱微量液體的需求,微流控技術取得了飛速的發(fā)展。與傳統(tǒng)的檢測方法相比,基于微流控平臺的檢測技術具有節(jié)省樣本與試劑用量,反應速度更快,高通量,易便攜,自動化潛力高等優(yōu)勢。
1998年Burns等提出的將多種生物、化學分析功能整合在一張微小芯片上的“芯片實驗室”(lab-on-a-chip, LOC)的概念,展示了微流控技術應用于臨床檢測、精準醫(yī)療的美好前景。近年來,開發(fā)“芯片實驗室”,又稱“微型全分析系統(tǒng)”,已經發(fā)展為一個物理、微電子、材料、化學、生物、醫(yī)學等多學科交叉的新型研究領域。本文主要介紹了微流控技術的分類、原理,以及其在臨床核酸檢測、免疫蛋白檢測、藥物篩查等方面的應用,以展示該技術在臨床檢測領域的應用前景及挑戰(zhàn)。
微流控在臨床檢測領域的應用及進展
微流控技術的發(fā)展促進了臨床檢測領域“即時檢測”(point-of-care-testing, POCT)概念的誕生與發(fā)展。“即時檢測”是指在照顧病人的當下即可使用的醫(yī)學檢測方法,其檢測設備需要具有便攜性、操作簡單、檢測速度快、結果準確可靠,可由 非專業(yè)檢驗人員甚至病人自己操作,可極大減輕專業(yè)醫(yī)學檢測人員的負擔。目前微流控技術已在臨床檢測的多個方面如核酸檢測、免疫測定、耐藥性檢測等獲得應用。
在核酸檢測中的應用
在對臨床樣本中的DNA或RNA進行分析之前,需要先將核酸分子從原始樣本中提取、純化。微流控芯片中最常用的核酸提純方法是磁珠法。Sista等人在數(shù)字微流控芯片上利用磁珠法從人全血樣本中成功提純人基因組DNA,并用于后續(xù)的聚合酶鏈式反應(polymerase chain reaction, PCR)。在該系統(tǒng)中,血液樣本在芯片上相繼與裂解液、DNA捕獲磁珠、清洗液、洗脫液結合。通過激活電極移動液滴,配合位于芯片底部的磁力裝置,可實現(xiàn)不同液滴與磁珠的結合與分離,從而完成 DNA提純過程。許多微流控芯片在提取核酸時,會通過加熱來加速細胞裂解。鑒于對核酸進行后續(xù)分析通常需要控溫裝置,這種設計在不增加設備復雜度的同時可以提高核酸提取的效率。除了磁珠法、加熱法等方法,一些微流控芯片利用介電泳效應(dielectrophoresis trapping)、等速電泳分離等微流控領域獨有的技術來完成核酸分子的提純。此外,為了滿足第二代測序技術對于更高純度核酸樣本的需求,Choi等人利用慣性聚焦技術(inertial focusing),使全血、血漿樣本中的巨細胞病毒顆粒在通過螺旋形的微流通道后與血細胞分離,降低了樣本中人類基因的比例,減少了后續(xù)測序的背景噪音。
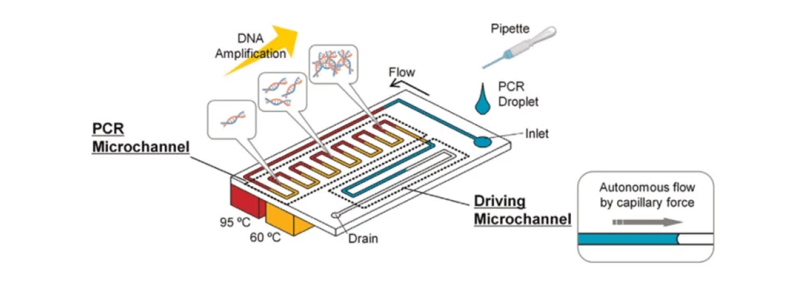
作為一種高特異性、高靈敏度、反應快速的核酸擴增手段,PCR在微流控領域的應用也得以充分開發(fā)。精確的溫度控制系統(tǒng)是完成PCR的基本條件。基于溫控的實現(xiàn)方法,可以簡單地將微流控芯片上的PCR方法分為2類:靜止PCR和動態(tài)PCR。在靜止PCR方法中,反應液在PCR過程中位置不變,通過對固定反應點的升降溫來實現(xiàn)熱循環(huán)。如Chang等人利用金屬鉑作為加熱元件和感溫元件對固定的PCR反應位點進行溫控,成功在數(shù)字微流控芯片上擴增出二型登革病毒核酸。在動態(tài)PCR方法中,反應液在幾個具有特定溫度的恒溫域之間受控地來回移動,以此實現(xiàn)反應液的熱循環(huán)。Sista等人開發(fā)的用于PCR的微流控芯片具有一個60℃恒溫域和一個95℃恒溫域,反應液在2個恒溫域之間移動,18 min即可完成40個循環(huán)的PCR反應。PCR與微流控技術的結合還突破了傳統(tǒng)PCR方法反應速度的極限。對于液滴微流控來說,微小液滴具有的高表面積與體積比使得熱量傳導更快、更均一,可極大加速PCR反應進程。Wheeler等人從反應熱動力學、DNA聚合酶等角度探索了在微流控芯片上進行超快速PCR的極限,利用適合于進行快速PCR的SpeedSTAR HS DNA聚合酶或KAPA2G DNA聚合酶,并減少在變性、退火、延伸各步驟的停留時間,在3 min以內完成了35個循環(huán)的PCR擴增反應。陳天藍等人設計的數(shù)字微流控芯片用鉻電極作為溫控系統(tǒng),可以使液滴超快速升降溫,在7 s之內完成對SYBR和特異性分子信標探針的溶解曲線分析。與傳統(tǒng)的PCR設備相比,不喪失靈敏度的前提下,在大部分微流控芯片上進行PCR可以至少減少50%的反應時間和70%的樣本消耗。
除了與PCR技術結合,各種基于微流控芯片的等溫核酸擴增技術也得以開發(fā)。雖然在靈敏度和特異性方面與PCR有差別,但由于等溫擴增技術對溫度的精準控制要求較低,開發(fā)者更容易將相應設備小型化、便攜化。萬諒等人開發(fā)的便攜式微流控設備,可在不到一個鞋盒大小的數(shù)字微流控平臺上實現(xiàn)對布魯氏菌基因的環(huán)介導等溫擴增(loop mediated isothermal amplification, LAMP)及檢測。在67℃ 40 min的擴增反應之后,通過對分子信標探針的熔解曲線分析,不到5 min即可完成對目的基因的檢測。Laili等人開發(fā)的微流控核酸檢測芯片則結合了滾環(huán)擴增技術(rolling circle replication, RCA)和微流電泳技術,在37℃ 60 min的RCA擴增反應后,可通過在微流通道中進行電泳分離來檢測樣本中是否含有霍亂弧菌的目的基因。
鑒于微流控領域反應液的微小體積,更需要高靈敏度的檢測方法來檢測樣本中的核酸分子。目前微流控芯片上開發(fā)的實時PCR方法最常用的是熒光檢測法,通過SYBR等非特異性嵌入式染料或者Taqman探針、分子信標探針等特異性熒光探針來檢測目的基因。小型發(fā)光二極管可被整合到微流控系統(tǒng)中,代替較大的汞燈、水銀燈等作為激發(fā)光源。除了實時PCR,研究者們在各種微流控平臺上整合了核酸雜交技術、毛細管電泳技術、焦磷酸測序技術、DNA光學圖譜技術等核酸分析方法,作為核酸擴增產物的后續(xù)檢測分析方法。
在免疫分析中的應用
基于抗原抗體之間特異性結合的免疫分析法是臨床診斷領域最常用的檢測方法之一。傳統(tǒng)的免疫分析方法,如酶聯(lián)免疫吸附法(enzyme linked immunosorbent assay, ELISA),具有成本低,易操作的優(yōu)點,但耗時長、費人力、需要額外設備如酶標儀等特性也阻礙了其應用于即時檢測。基于微流控平臺的免疫分析方法,可以促進抗原抗體之間的吸附,減少反應時間,實現(xiàn)自動控制,整合小型光學探頭使設備小型化,實現(xiàn)即時檢測的目標。
誘餌抗原(或抗體)的包被、液相的轉移和反應信號的捕捉是酶免分析試驗最基本的3個方面。
誘餌抗原(或抗體)的包被對酶免試驗的靈敏度和特異性有著極大影響。平面介質(如PDMS、玻璃等)、磁珠和非磁性微球是微流控領域3類最常用的包被介質。Kevin等人將蛋白質的包被整合到PDMS聚合過程中,由于該方法簡單易行并具有較高包被效率,在PDMS微流芯片的應用具有很大潛力。
在通道型微流控芯片中,液相轉移常通過操縱泵和閥門來完成,也可以利用離心力等方法完成。Wang等人通過微型氣動泵和微型氣動閥,完成了在PDMS芯片上對丙肝病毒(hepatitis C virus, HCV)抗體的酶免檢測。Lai等人基于微離心力開發(fā)的酶免分析芯片,可將酶免試驗整合到一張普通光碟大小的微流設備中。在數(shù)字微流控芯片中,液相的更換通常由電極驅動液體移動配合著磁力裝置完成。Wheeler等人設計的數(shù)字微流控芯片中,位于芯片底部的磁力裝置用于固定或移動包被了風疹病毒表面抗原的磁珠,驅動電極來控制樣本、酶標記物、顯色液等不同液滴與磁珠融合、分離,可同時完成風疹病毒IgM和IgG的自動化檢測。
傳統(tǒng)實驗室進行的酶免分析方法中,通常使用酶標儀測吸光度來確認反應結果。而微流控設備多數(shù)選擇用熒光信號來檢測芯片上酶免反應的結果。相比于吸光度,熒光信號靈敏度和特異性都更高,且將現(xiàn)有的熒光標記系統(tǒng)用于微流控芯片上可實現(xiàn)多重檢測。Tohid等人設計的PDMS微流芯片可以在單一通道完成對五種抗體的多重檢測。除了光學信號,電化學信號也常應用于微流控芯片上去檢測酶免反應結果,通過檢測被免疫反應改變的電勢、電流、電壓、電容、電阻等因素,可以獲得定量結果。與光學信號相比,電化學信號不需要額外的激發(fā)光源,更容易被整合到小型化的微流控系統(tǒng)中,而且電化學信號的檢測靈敏度不受光程、液體濁度等因素的影響,用于微流控系統(tǒng)有著天然的優(yōu)勢。
在細胞分析中的應用
開發(fā)能夠進行細胞培養(yǎng)、分選、分析的微流控芯片也是微流控領域的一大研究熱點。微流控技術小型化、高通量的特點使得其具有利用珍貴稀少的組織細胞樣本進行高通量分析的潛力,為精準醫(yī)療、個性化醫(yī)療提供支持。Irena等人驗證了在數(shù)字微流控芯片上進行細胞培養(yǎng)、藥物細胞毒性分析實驗的可行性。該實驗中,普朗尼克F68作為添加劑被加入液滴中,以減少芯片表面對細胞及蛋白質的吸附,從而降低驅動液滴所需的電壓,以免對細胞造成傷害。Ada等人研發(fā)的PDMS微流控芯片利用特殊設計的微流通道生成含單細胞的液滴,可以在2.4 cm×2.4 cm大小的芯片上實現(xiàn)對腫瘤細胞系以及原生腫瘤組織細胞的藥物篩查。
基于微流控芯片的3D細胞培養(yǎng)技術也是近年來微流控技術應用于生物醫(yī)學領域的一類發(fā)展方向。與傳統(tǒng)的2D細胞培養(yǎng)方法相比,3D環(huán)境下進行細胞培養(yǎng)能更好地模擬體內真實的細胞生長環(huán)境、反應細胞與胞外基質的相互作用。Yu等人設計的PDMS芯片中,多個平行的細胞培養(yǎng)腔與微小通道交聯(lián),模擬了體內組織與毛細血管網之間的相互作用。Raty等人的實驗結果證明小鼠胚胎細胞在微流通道中的生長速度比傳統(tǒng)平板培養(yǎng)更接近體內真實生長速率。而Yeong等人將PDMS形成的特殊結構與多孔細胞培養(yǎng)板結合,灌注水凝膠形成多個平行的3D細胞培養(yǎng)腔體,構建了一個與傳統(tǒng)細胞分析、藥物篩選等實驗方法完全兼容的、高通量的3D細胞培養(yǎng)微流控平臺。
除了基于細胞培養(yǎng)的微流控芯片,能代替大型流式細胞設備的微型細胞分選芯片也是一個研究焦點。除了通過熒光標記、大小等因素進行分選,微流控芯片還可以通過介電泳效應對細胞進行分選。在非均勻電場中,不同極性的細胞會朝著不同電場強度的地方遷移,利用介電泳效應和經特殊設計的微流通道,Takahashi等人完成了高通量細胞分選。此外,慣性微流體技術也常被應用于細胞分選。Kwon等人利用螺旋形的微流通道,使得死細胞、細胞碎片等在通過微流控芯片后從細胞培養(yǎng)液中析出,可進一步應用于灌注式細胞培養(yǎng)。Abdulla等人設計的多個微流通道級聯(lián)的微流控芯片無需對細胞進行任何標記就可以將循環(huán)腫瘤細胞(circulating tumor cells, CTC)從稀釋的全血樣本中分離,且分離出的CTC保持高存活率,便于進行后續(xù)藥物篩查等試驗。
展望
近年來,微流控技術在臨床診斷領域的應用研究極大促進了現(xiàn)場、即時檢測和精準、個性化醫(yī)療的發(fā)展。盡管現(xiàn)時微流控技術的全面推廣還受限于制備過程中的復雜操作、芯片對生化成分的吸附等一系列問題,但隨著新材料、新技術、新發(fā)現(xiàn)的不斷涌出,有著來自各個學科的研究人員對微流控技術持續(xù)的研究與改善,微流控技術在臨床診斷領域乃至基礎醫(yī)學研究領域的巨大潛能毋庸置疑。微流控技術的產業(yè)化也將推動臨床檢測方法朝著小型化、快速化、高通量、便攜性、自 動化的方向發(fā)展,“芯片實驗室”的廣泛應用指日可待。
-
檢測
+關注
關注
5文章
4480瀏覽量
91443 -
微流控
+關注
關注
16文章
525瀏覽量
18885 -
臨床診斷
+關注
關注
0文章
4瀏覽量
5819
發(fā)布評論請先 登錄
相關推薦
微流控技術的生物學應用
基于磁珠操控的微流控平臺實現(xiàn)副溶血性弧菌的快速捕獲與檢測
采用微流控技術實現(xiàn)重金屬分析,助力環(huán)境監(jiān)測與污染控制
微流控芯片3大制作技術
ATA-4012C高壓功率放大器在精準醫(yī)療的MEMS微流控研究中的應用
優(yōu)可測推動微流控技術革新,精準助力生物醫(yī)學等行業(yè)的發(fā)展





 微流控技術在臨床檢測中的應用
微流控技術在臨床檢測中的應用















評論