小細(xì)胞外囊泡(sEVs;< 200 nm)中含有脂質(zhì)、核酸和蛋白質(zhì),被認(rèn)為是多種疾病的生物標(biāo)志物,具有良好的應(yīng)用前景。然而,從血液中分離小細(xì)胞外囊泡的常規(guī)方法與目前的臨床工作流程不兼容,因此嚴(yán)重阻礙了血源性小細(xì)胞外囊泡在臨床環(huán)境中的應(yīng)用。在過(guò)去的十多年中,由于能夠精確、可控地操縱微米級(jí)和納米級(jí)尺寸的物體,微流控技術(shù)已經(jīng)被越來(lái)越多地被用作小細(xì)胞外囊泡處理和分離的基本工具。根據(jù)分離模式的不同,基于微流控技術(shù)的小細(xì)胞外囊泡分離策略可以分為被動(dòng)和主動(dòng)兩類(lèi)。其中,被動(dòng)分離方法不需要施加外力,而是通過(guò)使用尺寸依賴(lài)的流體動(dòng)力或復(fù)雜的通道結(jié)構(gòu)(例如納米孔膜和納米柱陣列)來(lái)分離小細(xì)胞外囊泡。相反,主動(dòng)分離方法需要應(yīng)用外力場(chǎng),尤其是聲場(chǎng)、電場(chǎng)和磁場(chǎng)來(lái)操縱小細(xì)胞外囊泡。
在臨床環(huán)境中,迫切需要制造成本低廉、操作簡(jiǎn)單、不需要專(zhuān)業(yè)知識(shí)、樣品制備步驟少,實(shí)驗(yàn)結(jié)果具有良好的一致性和可重復(fù)性,同時(shí)具有高分離純度和回收率的細(xì)胞外囊泡分離系統(tǒng)。上述分離血源性小細(xì)胞外囊泡的主動(dòng)技術(shù)需要產(chǎn)生和應(yīng)用外力,這就需要使用外部設(shè)備,這反過(guò)來(lái)又增加了處理成本并使實(shí)驗(yàn)工作流程復(fù)雜化。相對(duì)地,從全血中分離小細(xì)胞外囊泡的被動(dòng)微流控方法在成本、易用性和可重復(fù)性方面具有優(yōu)勢(shì),但其并非沒(méi)有局限性。例如,基于過(guò)濾的微流控平臺(tái)容易受到膜堵塞的影響,而其它被動(dòng)技術(shù),如基于慣性和粘彈性的微流控技術(shù),則表現(xiàn)出次優(yōu)的回收率和純度。在臨床環(huán)境中,除了考慮與經(jīng)濟(jì)性和用戶(hù)友好性有關(guān)的因素外,實(shí)現(xiàn)小細(xì)胞外囊泡的高回收率和高純度至關(guān)重要,特別是在僅可以獲得少量生物液體的情況下。因此,對(duì)能夠快速、可重復(fù)、高效地從全血中分離小細(xì)胞外囊泡的高效、簡(jiǎn)單、低成本的微流控工具的需求尚未得到滿(mǎn)足。
據(jù)麥姆斯咨詢(xún)報(bào)道,為了解決上述問(wèn)題,近期,來(lái)自瑞士蘇黎世聯(lián)邦理工學(xué)院(ETH Zurich)、蘇黎世大學(xué)(University of Zürich)和蘇黎世大學(xué)醫(yī)院(University Hospital Zurich)的研究人員提出了一種被動(dòng)、高效、粘彈性和無(wú)標(biāo)簽的微流控系統(tǒng),其能夠直接從人體血液中分離小細(xì)胞外囊泡。此外,研究人員利用從全血中分離獲得的熒光小細(xì)胞外囊泡對(duì)該微流控系統(tǒng)的分離性能進(jìn)行了評(píng)估,結(jié)果顯示,其純度和回收率分別超過(guò)97%和87%。相關(guān)研究成果以“Direct isolation of small extracellular vesicles from human blood usingviscoelastic microfluidics”為題發(fā)表在Science Advances期刊上。
具體而言,該集成式粘彈性微流控系統(tǒng)包括兩個(gè)模塊:細(xì)胞去除模塊和小細(xì)胞外囊泡分離模塊(圖1A)。在第一個(gè)模塊中,微米級(jí)血液成分,特別是白細(xì)胞、紅細(xì)胞和血小板,被有效地從血液樣本中去除。隨后,“無(wú)細(xì)胞”的血液被無(wú)縫地引入第二個(gè)模塊,并在這里實(shí)現(xiàn)小細(xì)胞外囊泡與其它細(xì)胞外囊泡亞群的分離。
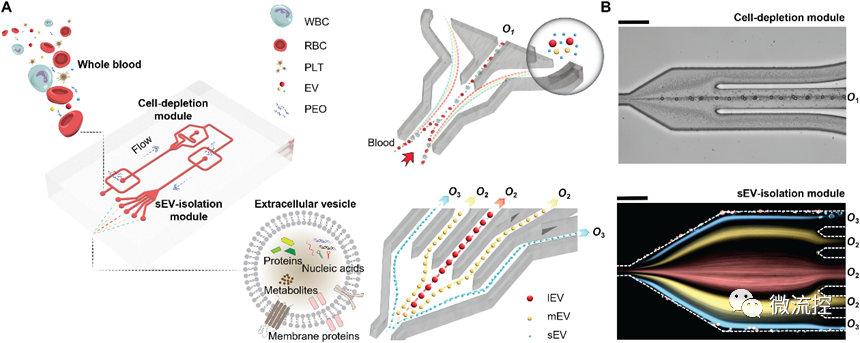
圖1 用于全血小細(xì)胞外囊泡分離的粘彈性微流控系統(tǒng)示意圖
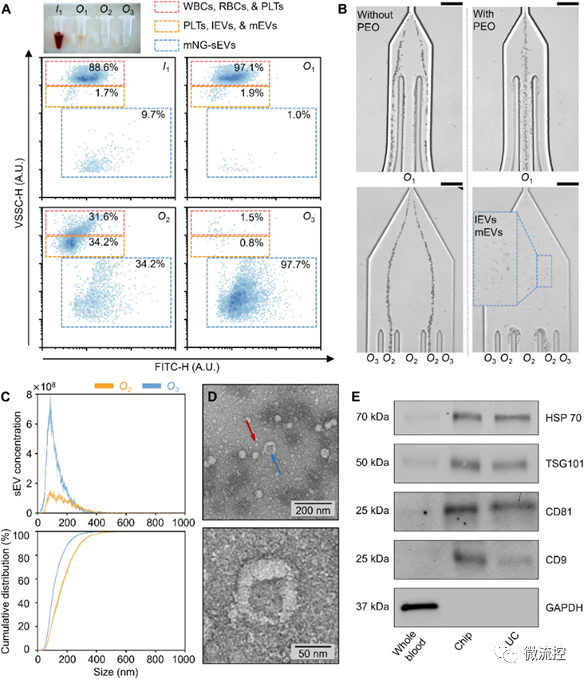
圖2 利用粘彈性微流控系統(tǒng)對(duì)從全血中分離獲得的小細(xì)胞外囊泡進(jìn)行表征
為了進(jìn)一步研究和比較利用超速離心法(UC,小細(xì)胞外囊泡分離的金標(biāo)準(zhǔn))和粘彈性微流控系統(tǒng)分離的血源性小細(xì)胞外囊泡樣品的蛋白質(zhì)組成,研究人員提取了兩種小細(xì)胞外囊泡樣品中的蛋白質(zhì),并使用數(shù)據(jù)依賴(lài)性采集(DDA)和平行累積連續(xù)碎裂(PASEF)方法進(jìn)行了基于質(zhì)譜的蛋白質(zhì)組學(xué)分析。分析結(jié)果證實(shí),利用粘彈性微流控系統(tǒng)獲取的小細(xì)胞外囊泡在蛋白質(zhì)組成方面表現(xiàn)出與金標(biāo)準(zhǔn)超速離心法的相似性能。
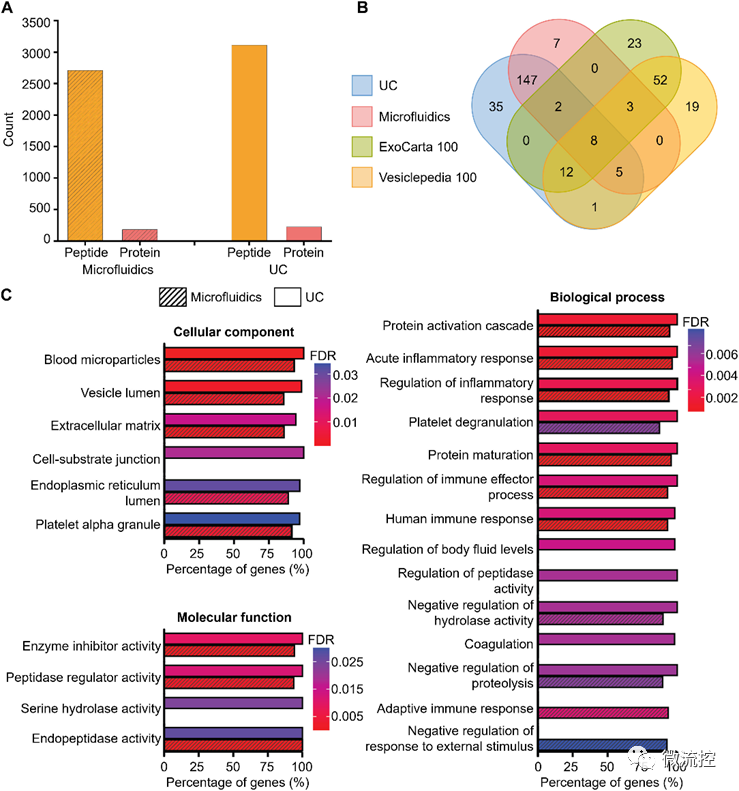
圖3 基于質(zhì)譜法檢測(cè)的細(xì)胞外囊泡相關(guān)蛋白的通路ORA分析
隨后,為了證明該粘彈性微流控系統(tǒng)在臨床液體活檢中的有效性,研究人員從20名癌癥患者(CPs)和20名健康捐獻(xiàn)者(HDs)的血液中分離出小細(xì)胞外囊泡,并將其濃度和尺寸與通過(guò)金標(biāo)準(zhǔn)超速離心法獲得的數(shù)據(jù)進(jìn)行了比較。值得注意的是,與金標(biāo)準(zhǔn)超速離心法相比,基于粘彈性微流控系統(tǒng)的方法顯著提高了小細(xì)胞外囊泡的獲取率。
最后,研究人員利用從10例健康捐獻(xiàn)者的血液活檢樣本中獲得的小細(xì)胞外囊泡探索了其濃度和尺寸與血液儲(chǔ)存時(shí)間的關(guān)系。作為血液老化過(guò)程的一部分,血細(xì)胞中會(huì)脫落小細(xì)胞外囊泡,因此,隨著時(shí)間的推移,血源性小細(xì)胞外囊泡的數(shù)量會(huì)增加。如圖5C所示,在29天的血液儲(chǔ)存期間,小細(xì)胞外囊泡的濃度顯著增加,從而證實(shí)了上述預(yù)測(cè)。此外,圖5D中的數(shù)據(jù)表明,在同一時(shí)間段內(nèi),相比于濃度的變化,小細(xì)胞外囊泡尺寸的增加則更為緩慢(但可測(cè)量)。因此,上述觀察結(jié)果證實(shí)了該研究所開(kāi)發(fā)的粘彈性微流控系統(tǒng)在同步監(jiān)測(cè)血液質(zhì)量方面的潛力。
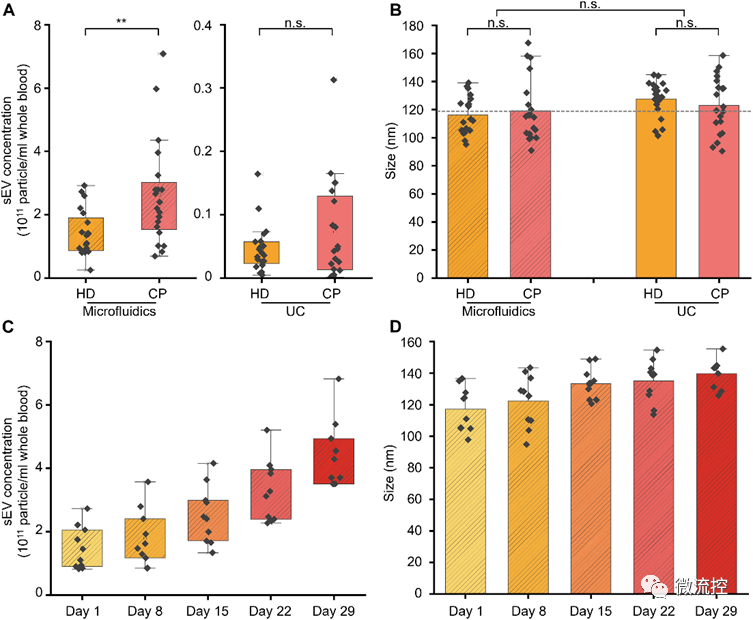
圖4 基于粘彈性微流控系統(tǒng)的液體活檢過(guò)程中分離獲得的小細(xì)胞外囊泡,用于癌癥診斷和監(jiān)測(cè)小細(xì)胞外囊泡的濃度和尺寸與血液儲(chǔ)存時(shí)間的關(guān)系
綜上所述,與現(xiàn)有的小細(xì)胞外囊泡分離技術(shù)相比,本文所提出的粘彈性微流控平臺(tái)具有低成本、易于操作、高小細(xì)胞外囊泡回收率和高純度的特點(diǎn),可用于科研和臨床研究。
審核編輯:劉清
-
微流控系統(tǒng)
+關(guān)注
關(guān)注
1文章
73瀏覽量
1867
原文標(biāo)題:利用粘彈性微流控系統(tǒng),直接從人體血液中分離小細(xì)胞外囊泡
文章出處:【微信號(hào):Micro-Fluidics,微信公眾號(hào):微流控】歡迎添加關(guān)注!文章轉(zhuǎn)載請(qǐng)注明出處。
發(fā)布評(píng)論請(qǐng)先 登錄
相關(guān)推薦
使用原代腫瘤細(xì)胞進(jìn)行藥物篩選的數(shù)字微流控系統(tǒng)
Aigtek高壓放大器在介電泳的微流控細(xì)胞分離技術(shù)中的應(yīng)用
S型微流控芯片的優(yōu)勢(shì)
ATG-2000系列功率信號(hào)源在介電電泳細(xì)胞分選測(cè)試中的應(yīng)用

ATA-7020高壓放大器在微流控3D細(xì)胞微球培養(yǎng)中的應(yīng)用
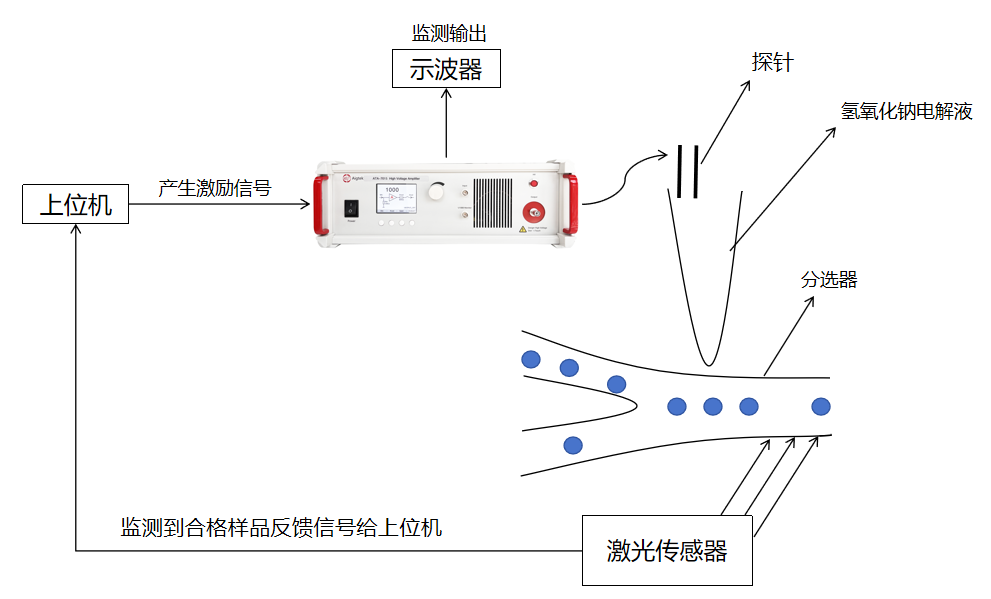
ATA-320功率放大器在免疫磁珠法分離細(xì)胞實(shí)驗(yàn)中的應(yīng)用
寬帶功率放大器基于微流控技術(shù)的細(xì)胞分選的應(yīng)用
武漢大學(xué):研究微流控電化學(xué)集成傳感器,快速、高效分離和靈敏檢測(cè)致病菌
ATA-2088高壓放大器在細(xì)胞分選中的作用是什么

激光如何對(duì)您的血液計(jì)數(shù)

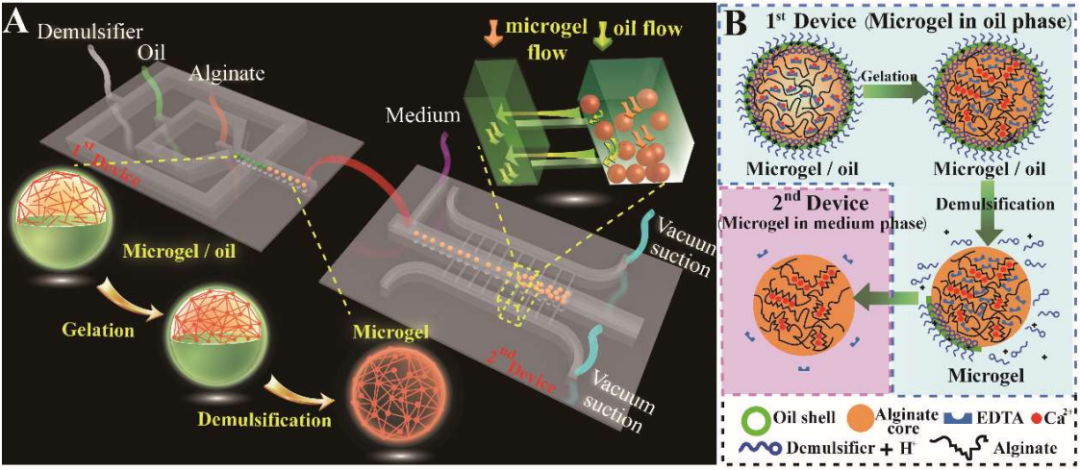
基于磁珠的液滴微流控平臺(tái),用于細(xì)胞外囊泡的高效分離
安泰ATA-7050高壓放大器在微流控細(xì)胞分選中的應(yīng)用
基于離子濃度極化的微流控平臺(tái)用于ctDNA的高靈敏度檢測(cè)

基于磁性探針的級(jí)聯(lián)相轉(zhuǎn)移微流控芯片用于循環(huán)腫瘤細(xì)胞檢測(cè)

如何利用磁性微流控系統(tǒng)實(shí)現(xiàn)免疫細(xì)胞分泌行為的定量檢測(cè)呢?




 利用粘彈性微流控系統(tǒng),直接從人體血液中分離小細(xì)胞外囊泡
利用粘彈性微流控系統(tǒng),直接從人體血液中分離小細(xì)胞外囊泡










評(píng)論