2023年11月,復旦大學鄒欣/郝潔團隊在Cell Reports Methods 以長文形式發(fā)表了題為:“scCURE identifies cell types responding to immunotherapy and enables outcome prediction”的論文,從免疫治療相關細胞動態(tài)異質性的角度提出了一個腫瘤免疫治療研究新思路。同期,團隊在Journal of Translational Medicine以長文形式發(fā)表“Integrative multi-omics analysis unveils stemness-associated molecular subtypes in prostate cancer and pan-cancer: prognostic and therapeutic significance”,使用單細胞和bulk數據整合方式構建基于干性特征的腫瘤分子分型模型,用于預測免疫治療療效。
一.
scCURE
單細胞RNA測序(scRNA-seq)顯著推進了我們對不同類型細胞如何響應免疫治療的理解。然而,盡管取得了這些進展,免疫治療的機制基礎和預測模型仍存在不一致性。例如,一些研究報告了不同的細胞亞型與這兩個方面分別相關,但沒有明確的解釋。這些不一致性可能源自未經表征的細胞間異質性。
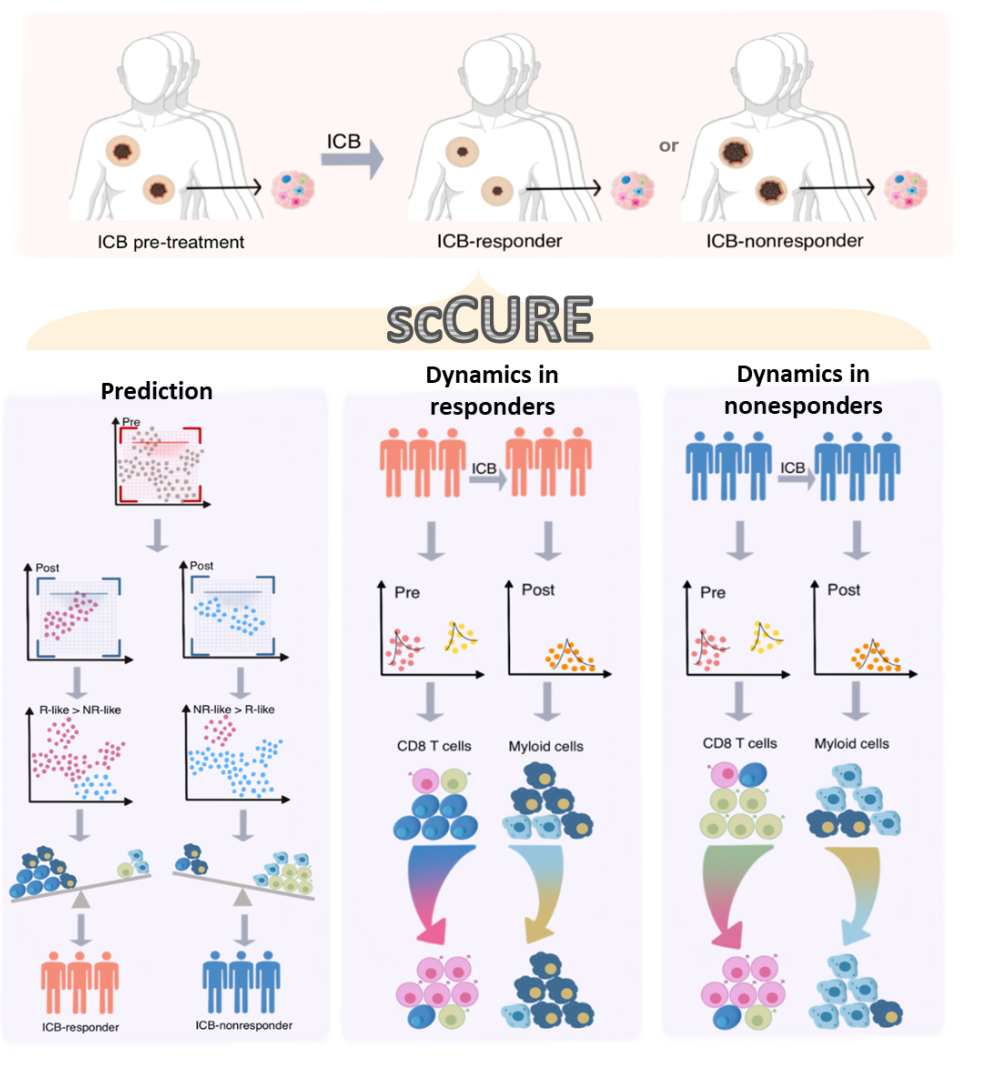
為了解決這個問題,我們提出了scCURE,利用模式識別建模來區(qū)分免疫治療過程中發(fā)生變化和未發(fā)生變化的細胞。我們假設這些可能的細胞異質性可以分為兩種主要類型:1) 變化的細胞。這些細胞的動態(tài)特征反映了患者對免疫治療的響應方式。2) 未變化的細胞。來自治療前后樣本的這類細胞具有類似的細胞和分子功能,差異主要由無關因素引起,例如批次效應和隨機噪聲。未變化細胞的基線特征可能提供治療結果的預測信息。為了捕捉這種異質性,關鍵在于區(qū)分免疫治療誘導的細胞狀態(tài)轉變和其它無關變化。為了實現這一點,scCURE包括以下主要步驟:1) 分類模型構建。使用期望最大化(EM)方法對治療前后條件下的細胞分別進行訓練,使用預定義的K個高斯模型進行訓練。根據最大似然準則,將每個細胞分配給特定的高斯模型。假設數據集由K個亞型/功能類別的細胞組成,在每個亞型/功能類別內,細胞是同質的。因此,每個亞型/功能類別可以建模為一個高斯分布。具有不同參數的多個高斯分布的組合可以用來近似真實世界的單細胞數據。假設高斯模型的數量足夠多,可以充分描述細胞異質性,一個高斯模型代表變化或未變化的細胞。2) 變化和未變化細胞的區(qū)分。為了區(qū)分代表變化和未變化細胞的高斯模型,我們窮盡了治療前后兩個條件之間所有可能的高斯模型對,并計算它們之間的KL散度。如果來自兩個條件的一對高斯模型在KL散度方面彼此最接近,那么分配給這兩個高斯模型的細胞不應該包含系統性變化,這些細胞被注釋為未變化;否則,它們被注釋為變化。根據未變化細胞的特征,我們構建了一種免疫治療預測得分。此外,從變化細胞中解釋出的免疫治療反應/抵抗機制可以與預測模型很好地結合。scCURE的示意圖如圖1所示。
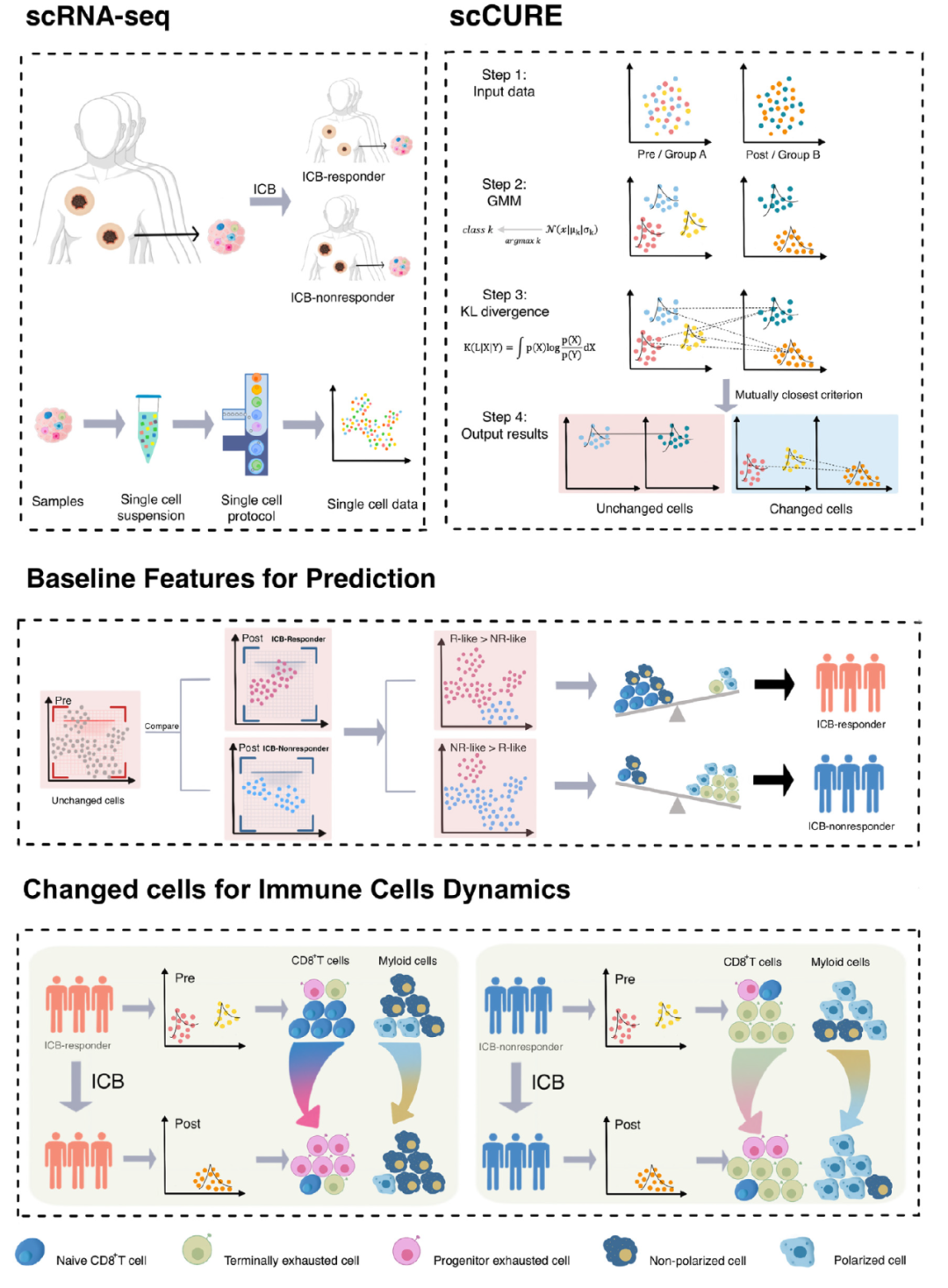
圖1. scCURE流程圖。
1、模擬數據顯示了scCURE的高可靠性
我們比較了已有方法MNN 和CCA,并通過多種度量如PPV、F1 score和AUC等評估不同方法的可靠性。
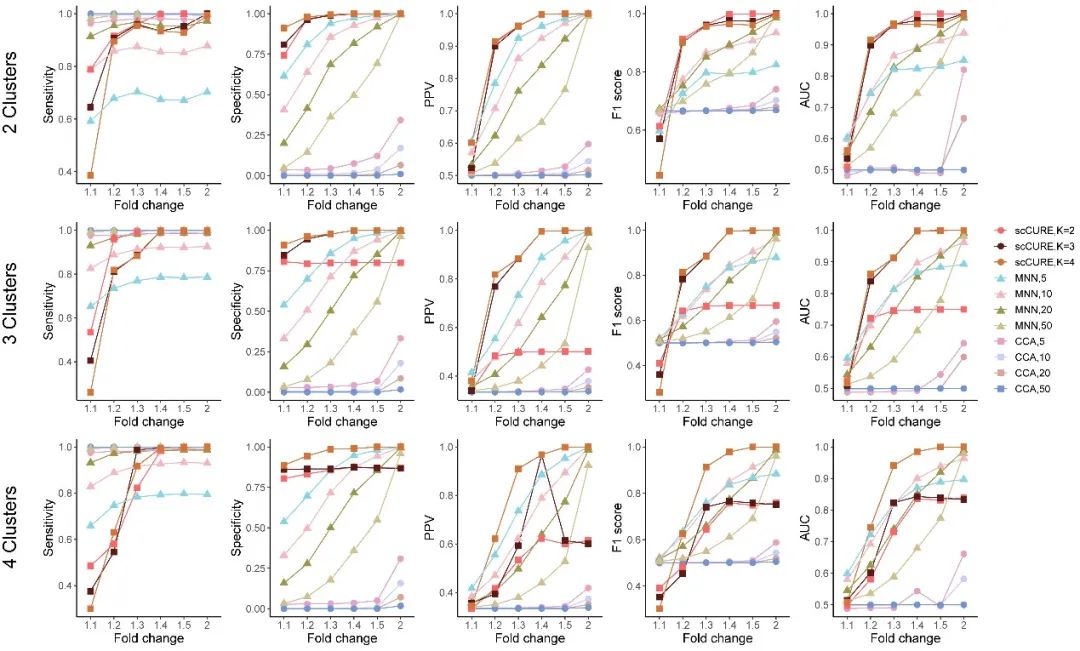
圖2. 模擬數據結果顯示scCURE在可靠性上明顯優(yōu)于已有CCA和MNN方法。這是構建精準免疫治療研究模型的保證。
2、基于未變化CD8+ T細胞構建黑色素瘤免疫治療預測模型
通過分別比較治療前-治療后(響應)的樣本和治療前-治療后(不響應)的樣本,scCURE在治療前的樣本中判定出了R-like和NR-like細胞,分別代表響應特征和不響應特征。細胞亞型判定顯示R-like主要是na?ve型特征,NR-like主要是終末耗竭型特征,這與已有知識相吻合。基于R-like和NR-like細胞比例,在小樣本中我們顯示了該細胞比例特征具有很好的免疫治療療效預測能力(圖3E)。
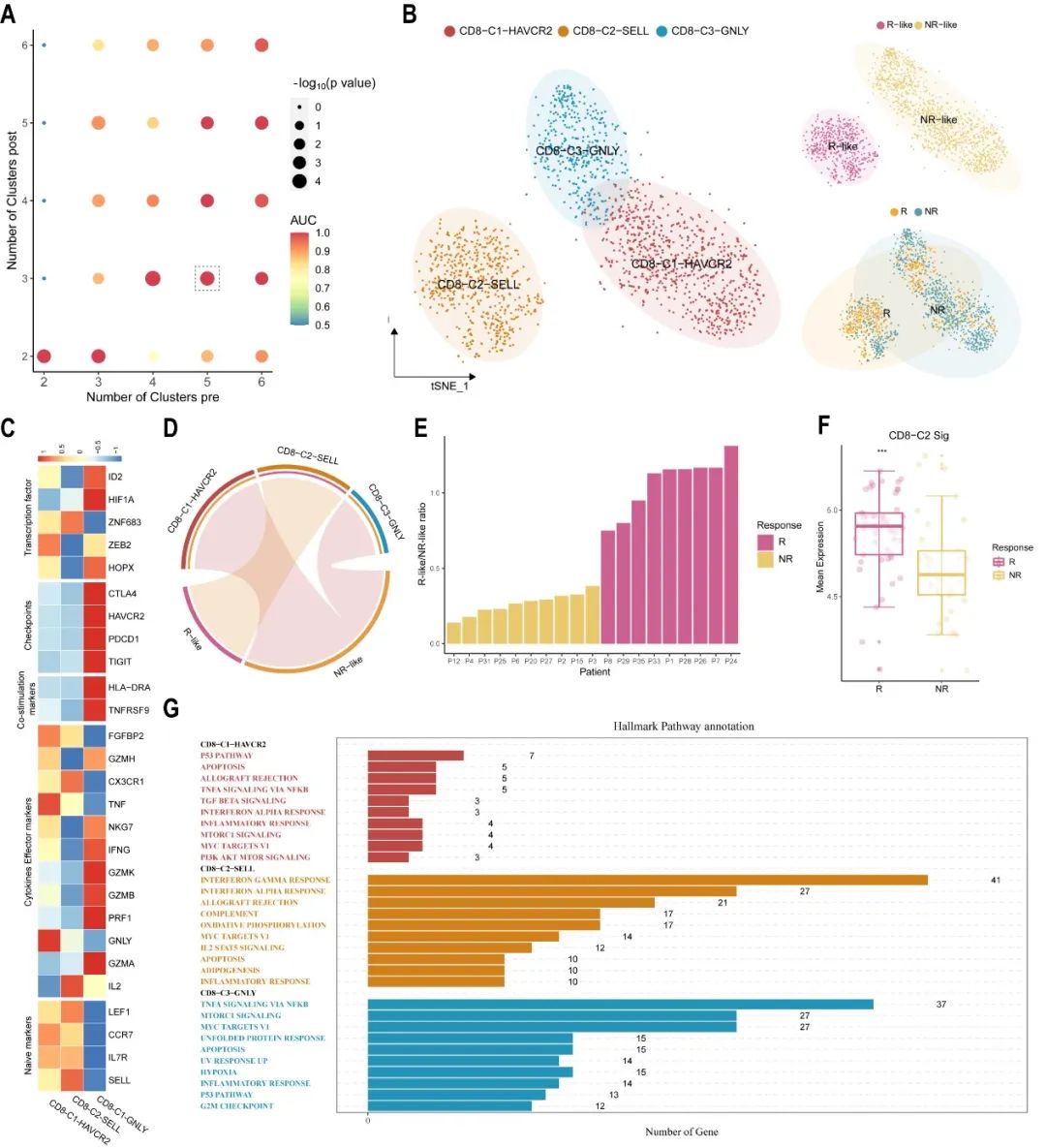
圖3. scCURE判定的不變的CD8+ T細胞在基線狀態(tài)的特征預測免疫治療療效。
3、基于變化的CD8+ T細胞進行研究免疫治療研究
基于在響應病人中變化的CD8+ T細胞在治療前后變化的特征,我們可以總結出免疫治療促使na?ve型的和終末耗竭型的T細胞向初始耗竭型亞型轉變(圖4)。我們在非響應患者樣本中也觀察到了類似的特征。
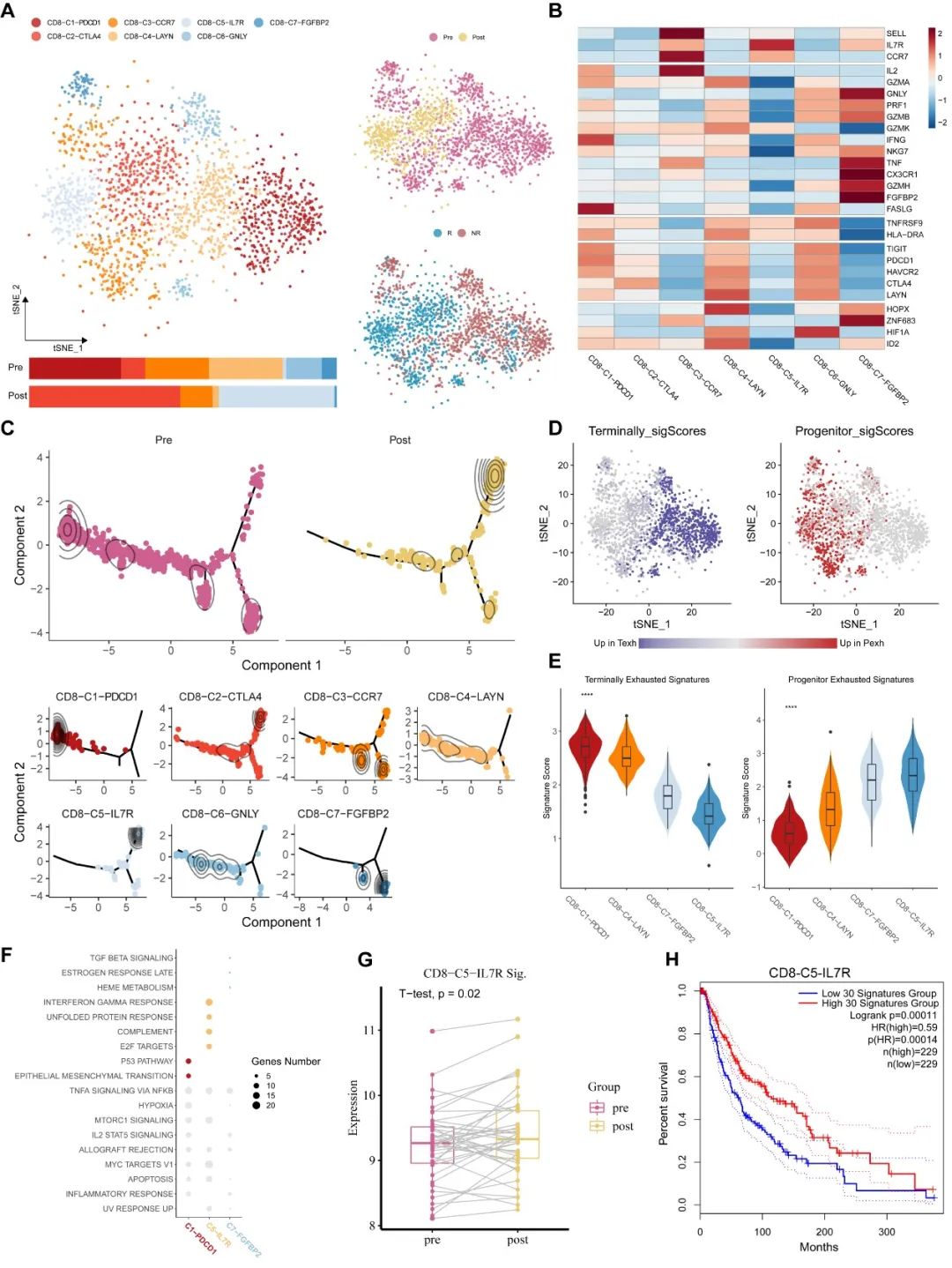
圖4. 免疫治療促使CD8+ T細胞的激活。
4、基于scCURE的免疫治療中巨噬細胞研究
與CD8+ T細胞不同的是,我們觀察到在響應患者中巨噬細胞會被免疫治療激活。相反,在非響應患者中,巨噬細胞的抗腫瘤特征會在治療后失活。這顯示了療效預測模型在腫瘤精準治療中的重要性。同時,細胞間通訊顯示在響應患者中,CD8+ T細胞和巨噬細胞具有明顯的協同作用(圖5G),而該現象沒有在非響應患者中發(fā)現。
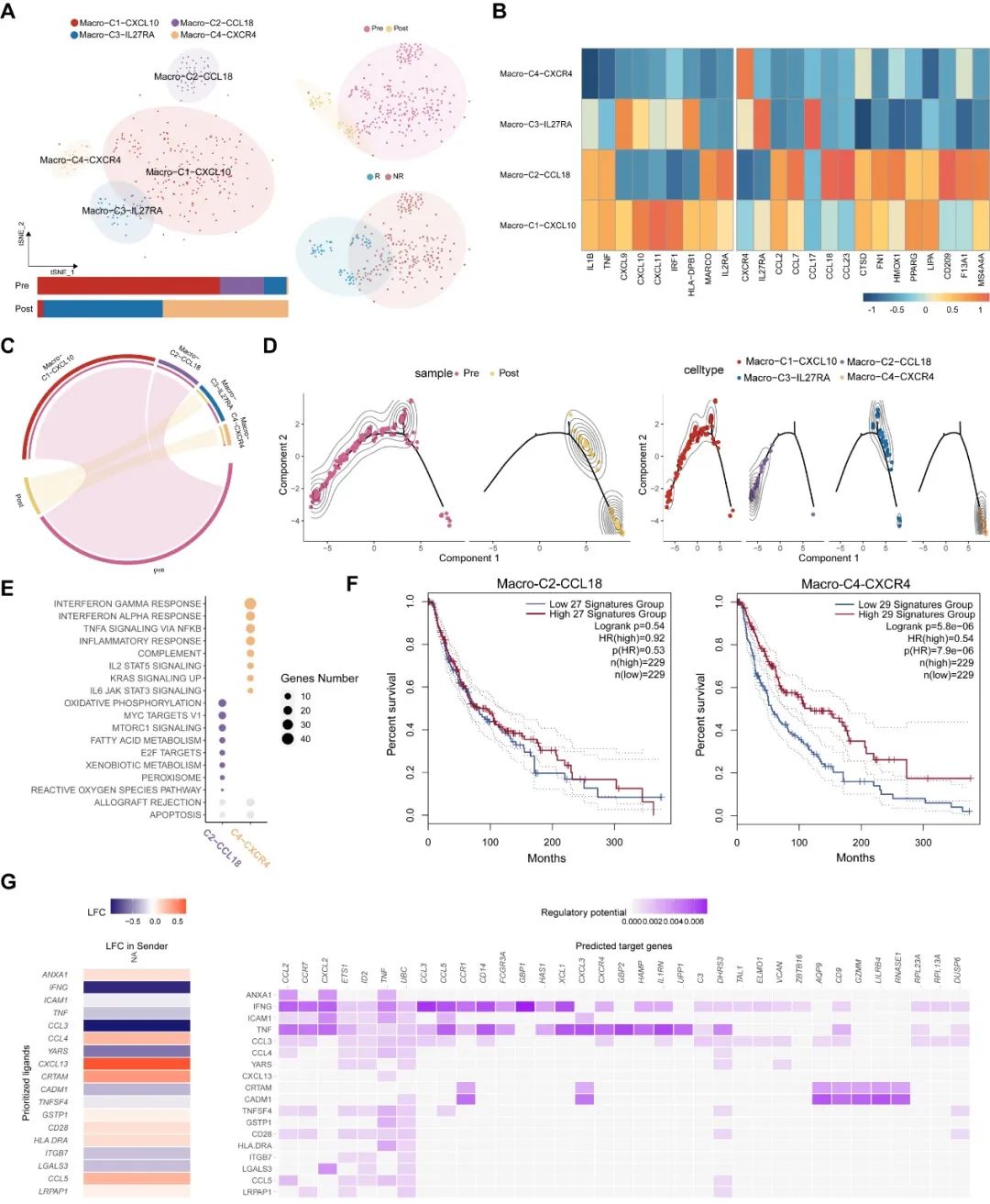
圖5.免疫治療響應患者中的巨噬細胞動態(tài)特征。
二.
基于單細胞和bulk數據的前列腺癌干性分型研究
前列腺癌(PCA)是全球第五大導致癌癥相關死亡的原因,晚期的治療選擇有限。PCA的免疫抑制性腫瘤微環(huán)境(TME)導致其對免疫治療的敏感性降低。盡管分子亞型分類有望為PCA的精準治療提供重要線索,但目前仍然缺乏臨床實踐中可靠和有效的分子分類方法。因此,我們旨在提出一種基于干性特性的新型分類方法,以指導包括免疫治療在內的PCA個體化臨床治療。
我們首先進行了PCA的綜合多組學分析,以評估干細胞水平的異質性。采用無監(jiān)督的層次聚類方法,基于干性特征基因對PCA進行分類。為了使患者分類更具臨床應用性,我們使用四個PCA數據集和76種機器學習算法共同開發(fā)了一個干性亞型預測模型。
圖6顯示了干性特征與臨床特征的廣泛關聯性。基于單細胞數據和bulk數據,我們構建了一個干性分型模型,將PCA患者分成3個亞型(圖7b)。
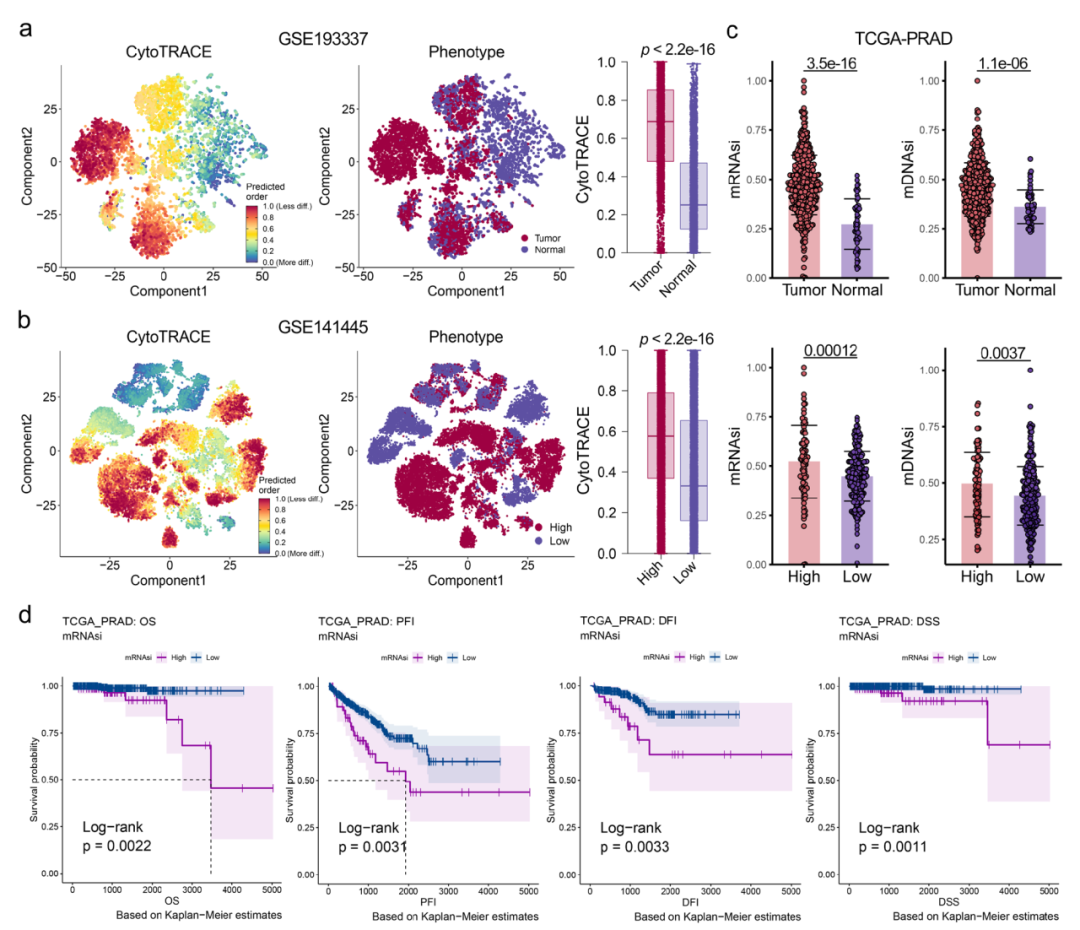
圖6.干性特征與前列腺癌臨床特征的廣泛關聯性。
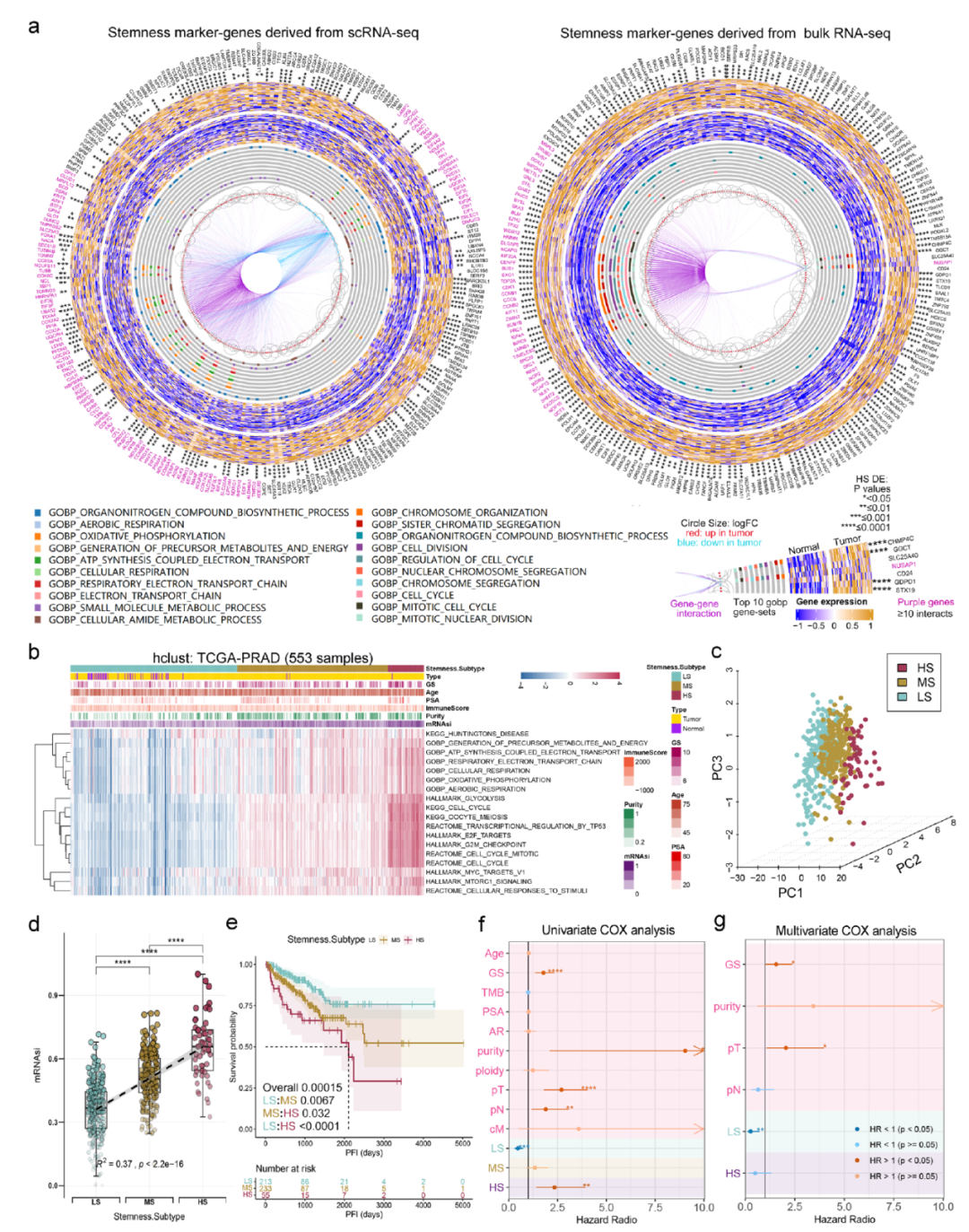
圖7.干性特征分型模型構建。
圖8顯示了不同的干性分型患者具有不同的臨床特征,基因突變特征和表觀遺傳特征。
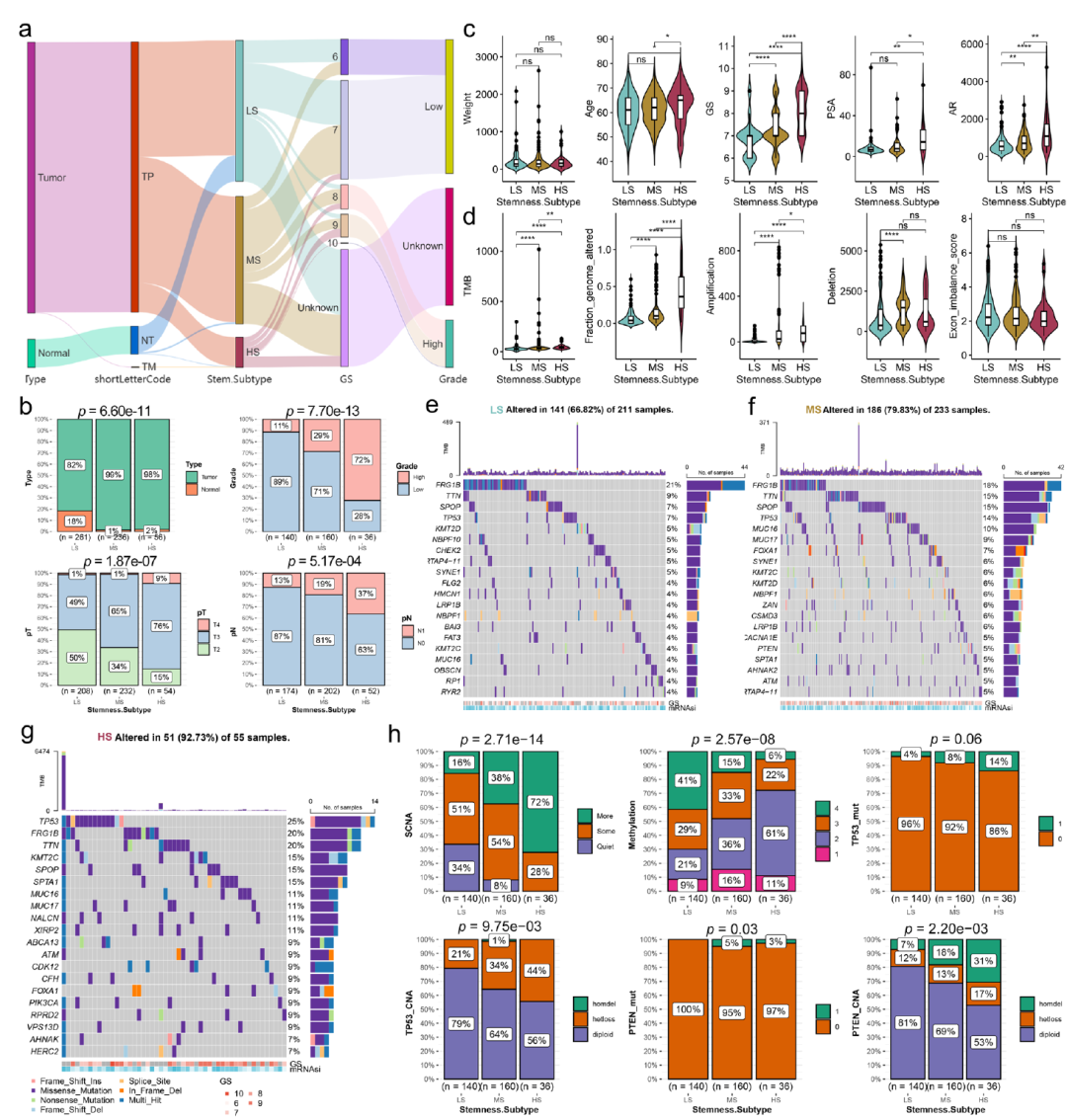
圖8.不同干性分型患者的多組學特征。
圖9顯示了我們提出的干性分型模型可以用于預測患者對ICB免疫治療的響應。
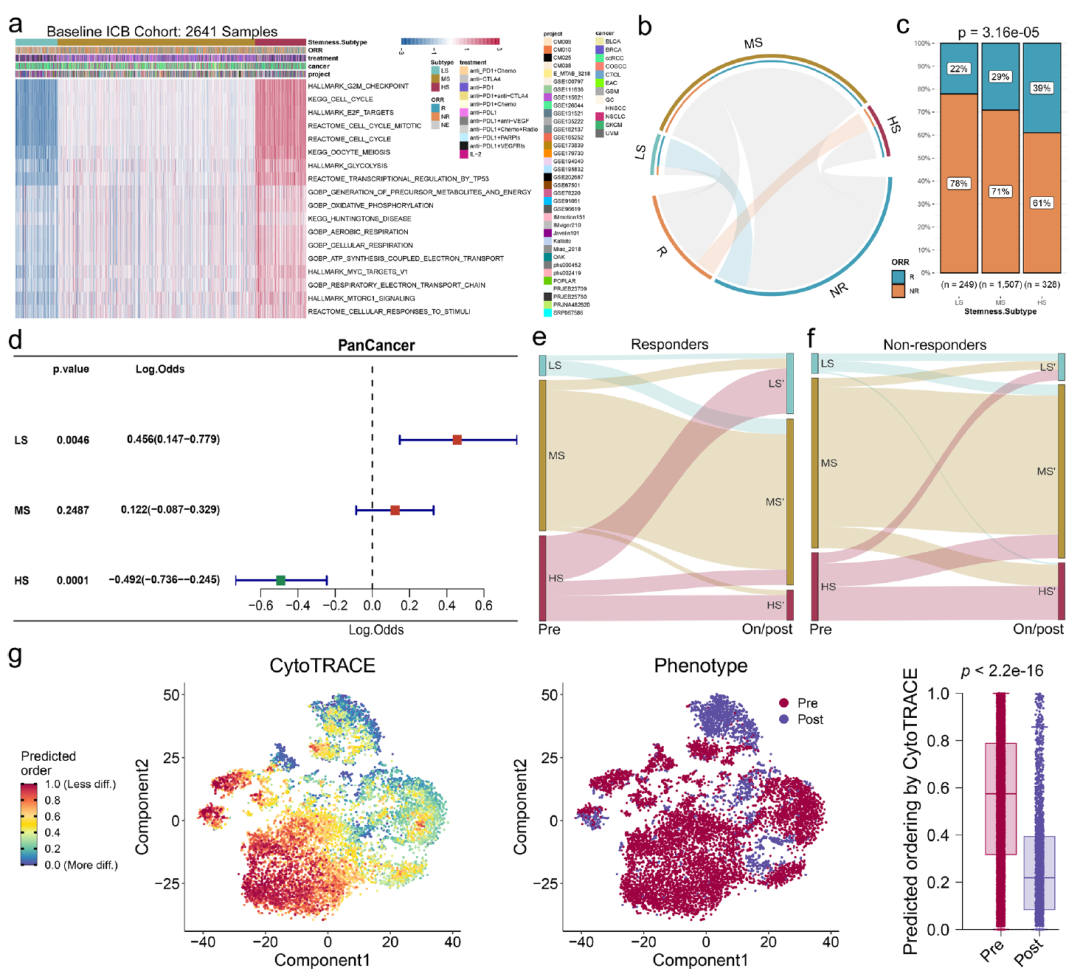
圖9.不同干性分型患者對ICB免疫治療具有不同的響應特性。
論文的通訊作者為復旦大學附屬中山醫(yī)院郝潔研究員,復旦大學附屬金山醫(yī)院鄒欣副研究員。論文的主要參與人員包括上海交通大學附屬第六人民醫(yī)院鄭坤,復旦大學附屬腫瘤醫(yī)院劉宇峻等。該研究得到了國家自然科學基金(82170045,31800253),上海交通大學醫(yī)學院高水平地方高校創(chuàng)新團隊 (SSMU-ZLCX20180502)的支持。
SBC中心實驗室
SBC中心實驗室聚焦單細胞、空間多組學前沿技術,圍繞基因組、表觀組、轉錄組、蛋白組、代謝組和微生物組等多維組學研究,以國際一流水平的技術平臺,二十余年專業(yè)經驗的技術團隊,打造創(chuàng)新產品服務體系,高效助力科學發(fā)現產品研發(fā)。中心始終以嚴謹的科學態(tài)度,堅持創(chuàng)新,服務國家重大戰(zhàn)略任務,推動技術成果轉化應用和帶動產業(yè)集群發(fā)展。長期舉辦學術論壇、專題研討會、前沿技術培訓,為數十家跨國制藥企業(yè)和上千家國內科研機構、院校、醫(yī)院提供系統全面一站式的科研與轉化解決方案,日益發(fā)揮面向生物醫(yī)藥全行業(yè)功能效益和策源動力。
-
模型
+關注
關注
1文章
3226瀏覽量
48809 -
數據集
+關注
關注
4文章
1208瀏覽量
24689
原文標題:復旦大學郝潔/鄒欣團隊Cell子刊發(fā)表單細胞分析新技術用于腫瘤精準免疫治療
文章出處:【微信號:SBCNECB,微信公眾號:上海生物芯片】歡迎添加關注!文章轉載請注明出處。
發(fā)布評論請先 登錄
相關推薦
天合光能與復旦大學共建先進光伏技術校企聯合實驗室

德力西電氣榮獲復旦大學雙碳目標與氣候變化貢獻獎
使用原代腫瘤細胞進行藥物篩選的數字微流控系統
復旦大學半導體研發(fā)取得重要突破
實戰(zhàn)分享:腫瘤電場治療硬件設計方案

晶能光電與復旦大學合作研究用于可見光通信的紅色發(fā)射微型發(fā)光二極管

嘉善復旦研究院與復旦大學研發(fā)全無機鈣鈦礦集成光科技
基于磁性探針的級聯相轉移微流控芯片用于循環(huán)腫瘤細胞檢測

新技術在生物樣本冷凍中的應用案例分析
復旦大學在壓電能量采集接口電路方向取得重要科研進展




 復旦大學郝潔/鄒欣團隊Cell子刊發(fā)表單細胞分析新技術用于腫瘤精準免疫治療
復旦大學郝潔/鄒欣團隊Cell子刊發(fā)表單細胞分析新技術用于腫瘤精準免疫治療












評論