癌癥作為全球第二大死因,每年導(dǎo)致約1千萬人死亡。循環(huán)腫瘤細(xì)胞(CTCs)是指從原發(fā)腫瘤病灶脫落并進(jìn)入外周血液循環(huán)的各類腫瘤細(xì)胞,被認(rèn)為是癌癥轉(zhuǎn)移的重要標(biāo)志物。CTCs在腫瘤早期就已出現(xiàn),并攜帶腫瘤大量的實(shí)時信息,因此CTCs檢測在癌癥研究中受到了越來越廣泛的關(guān)注。然而,由于血液中CTCs數(shù)量極少,1mL全血中僅含有1 ~ 10個CTCs,高效分離并準(zhǔn)確測定全血樣品中的CTCs存在巨大困難。近年來,微流控芯片技術(shù)已發(fā)展成為一種極具潛力的從血液中分選富集CTCs的技術(shù)。CTCs分選性能在很大程度上取決于芯片的設(shè)計,因此,設(shè)計并搭建分選性能優(yōu)異、操作簡便的微流控芯片平臺至關(guān)重要。
近期,武漢大學(xué)胡斌教授課題組報道了一種基于磁性探針的級聯(lián)相轉(zhuǎn)移多功能微流控芯片平臺,通過與電感耦合等離子體質(zhì)譜(ICP-MS)聯(lián)用,成功實(shí)現(xiàn)CTCs的高活性分選、純化、釋放和定量檢測,相關(guān)成果以“ACascaded Phase-Transfer Microfluidic Chip with Magnetic Probe for High-ActivitySorting, Purification, Release, and Detection of Circulating Tumor Cells”為題發(fā)表在國際化學(xué)權(quán)威雜志AnalyticalChemistry上。
研究人員構(gòu)建了一個多功能級聯(lián)相轉(zhuǎn)移微流控芯片平臺,該芯片集被動分選和主動分選于一體,主要由分選區(qū)、純化區(qū)和釋放區(qū)三個功能區(qū)組成。實(shí)驗(yàn)原理如圖1所示,CTCs在微流控芯片中經(jīng)歷分選、純化和釋放,之后引入ICP-MS檢測實(shí)現(xiàn)對其的準(zhǔn)確定量。首先,將EpCAM適配體修飾的磁球與去除紅細(xì)胞的血液樣品共孵育一段時間,實(shí)現(xiàn)磁性探針對CTCs的識別和捕獲,隨后將其從入口樣品處引入芯片。在細(xì)胞分選區(qū)域,CTCs在中心強(qiáng)磁場和螺旋通道的共同作用下,迅速從寬分布狀遷移至通道內(nèi)壁,并沿著內(nèi)側(cè)從第一個分選口處進(jìn)入細(xì)胞純化區(qū),此時大量血細(xì)胞則從出口1流出,實(shí)現(xiàn)CTCs的初步分選。同時,另一入口通入的PBS緩沖液將與進(jìn)入純化區(qū)的CTCs樣品流形成穩(wěn)定的層流,CTCs在磁力和流體動力的共同作用下,從樣品流相轉(zhuǎn)移至PBS緩沖液中,而剩余血細(xì)胞則保持在原樣品流中從出口2流出,完成CTCs的進(jìn)一步純化。核酸酶溶液從核酸酶入口處通入,與含有CTCs的PBS流在釋放區(qū)形成穩(wěn)定的層流。在鋸齒狀的芯片結(jié)構(gòu)和矩形磁鐵的磁場作用下,CTCs再次相轉(zhuǎn)移至酶溶液中,并在強(qiáng)磁場作用下被固定在鋸齒凹槽內(nèi)。此時,持續(xù)流動的酶溶液不斷酶解磁球與細(xì)胞之間連接的適配體,最終磁球留在鋸齒凹槽內(nèi),而細(xì)胞從磁球上脫離后則隨酶溶液從出口3流出,實(shí)現(xiàn)溫和的CTCs釋放。將CTCs收集,可用于后續(xù)ICP-MS定量檢測或再培養(yǎng)等下游分析。
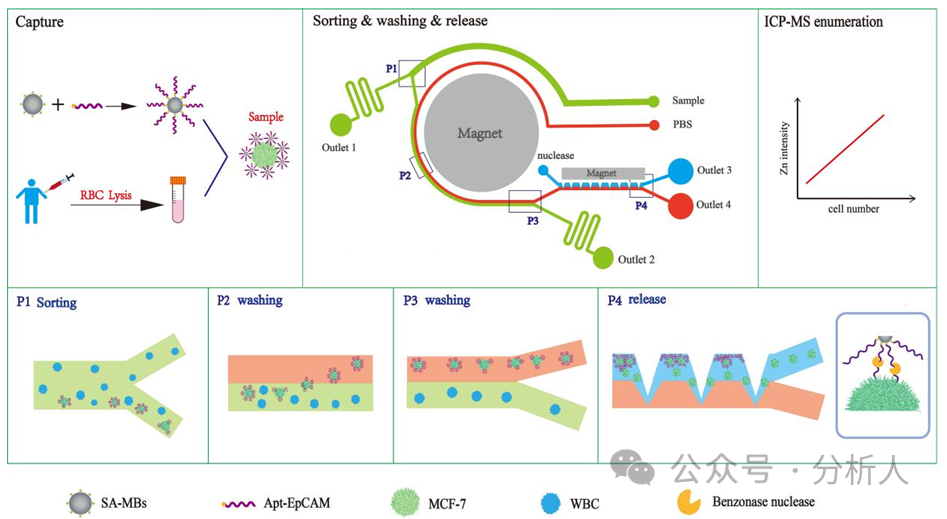
圖1 級聯(lián)相轉(zhuǎn)移多功能微流控芯片的設(shè)計及CTCs捕獲、分選、純化、釋放和ICP-MS檢測原理圖
隨后,研究人員分別考察了CTCs分選純化區(qū)芯片和CTCs釋放區(qū)芯片的可行性。將磁性探針結(jié)合的CTCs和含有紅色墨水的PBS緩沖液分別引入分選純化區(qū)芯片,并在顯微鏡下觀察細(xì)胞在芯片中的遷移,結(jié)果如圖2A ~ 2C所示。在第一個分選口處、相轉(zhuǎn)移過程中和第二個分選口處,均能觀察到CTCs沿著預(yù)設(shè)的路徑發(fā)生轉(zhuǎn)移,并最終從目標(biāo)出口流出,表明分選純化區(qū)的設(shè)計可行。同樣地,將磁性探針結(jié)合的且Hoechst預(yù)染色的CTCs和核酸酶溶液分別從兩個入口引入釋放區(qū)芯片,如圖2D ~ 2G所示,可以觀察到凹槽內(nèi)的CTCs先迅速積累,隨后逐漸被釋放,且目標(biāo)出口所收集到的CTCs表面并未觀察到明顯的磁性顆粒,表明芯片釋放區(qū)可以成功實(shí)現(xiàn)CTCs的轉(zhuǎn)移、固定和釋放。
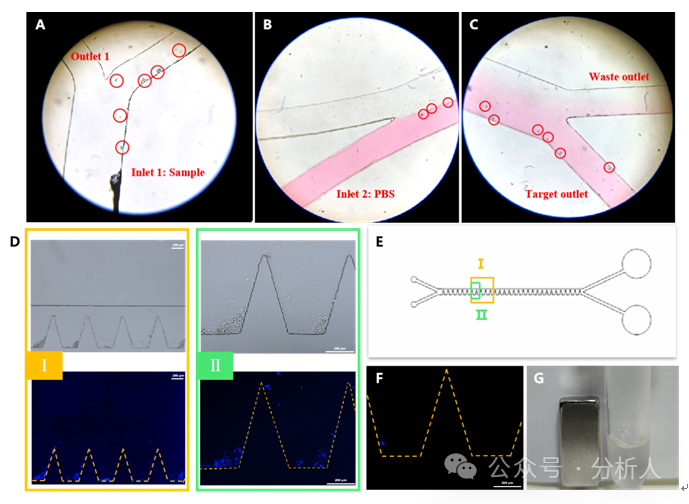
圖2 細(xì)胞分選和釋放的可行性
接著,研究人員對一系列實(shí)驗(yàn)條件進(jìn)行了優(yōu)化。在最優(yōu)的條件下,細(xì)胞捕獲、分選和釋放效率分別為84%、89%和94%(圖3A)。此外,研究人員考察了方法在PBS和血漿基質(zhì)中對CTCs的回收率,從圖3B可以看出,不同密度CTCs下,兩種基質(zhì)中的細(xì)胞回收率都相對穩(wěn)定且保持較高水平(75% ~ 80%),展現(xiàn)了該方法較強(qiáng)的抗基質(zhì)干擾能力。通過AO/EB雙染實(shí)驗(yàn)進(jìn)一步考察了所回收CTCs的細(xì)胞活性,存活率高達(dá)99.3%。隨后,研究人員探究了該方法的特異性,如圖4所示,結(jié)果表明本方法對EpCAM表達(dá)陽性的細(xì)胞具有良好的特異性,同時對EpCAM表達(dá)陰性的細(xì)胞具有較強(qiáng)的抵抗力。
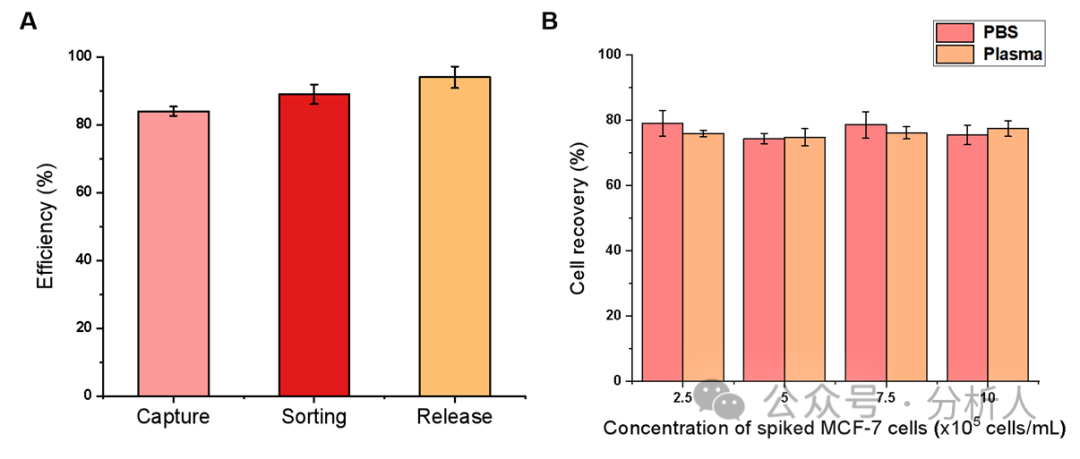
圖3 (A)最佳條件下MCF-7細(xì)胞在PBS中的細(xì)胞捕獲、分選和釋放效率;(B)不同密度MCF-7細(xì)胞在PBS和血漿中的細(xì)胞回收率
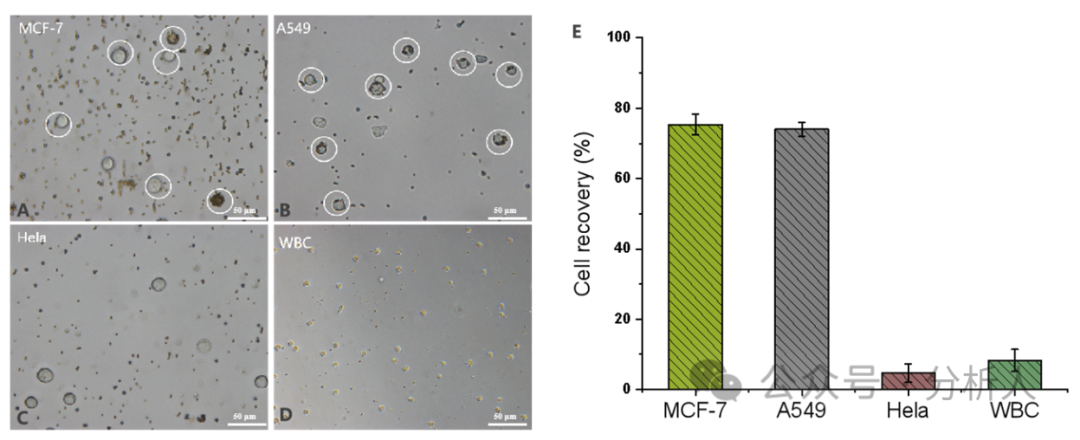
圖4 方法特異性
為了驗(yàn)證該方法在實(shí)際血樣中的分析能力,在實(shí)際血樣中加標(biāo)不同數(shù)量的MCF-7細(xì)胞,采用本方法測定了加標(biāo)血樣中MCF-7細(xì)胞的個數(shù)。從圖5A中可以看到,檢測到的MCF-7細(xì)胞的個數(shù)與加標(biāo)的MCF-7細(xì)胞的個數(shù)呈較好的相關(guān)性,表明該方法具備良好的臨床應(yīng)用潛力。最后,將所構(gòu)建的方法用于16名乳腺癌患者和4名健康人全血樣本檢測。如圖5B ~ 5C所示,在16例患者中,CTCs均有檢出(6 ~ 241個/mL),且明顯高于健康人血液中的平均CTCs個數(shù)(0.5個/mL)。 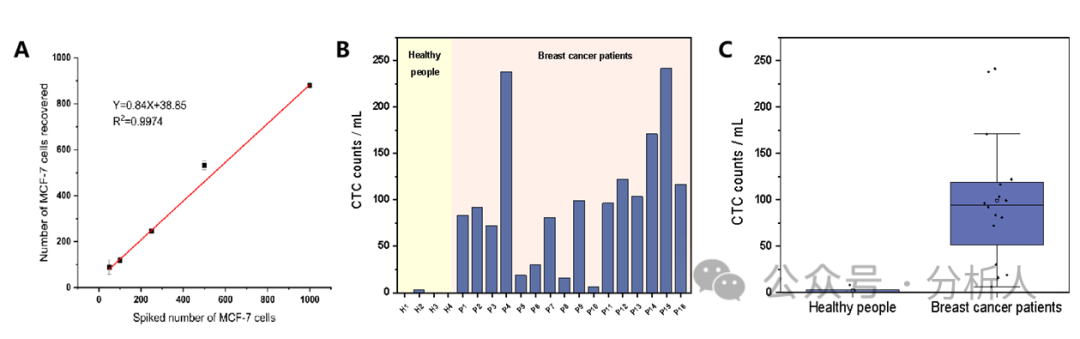
圖5 (A)不同數(shù)量MCF-7細(xì)胞血樣加標(biāo)的ICP-MS檢測結(jié)果;16例乳腺癌患者和4例健康人1 mL全血中CTCs計數(shù)的(B)柱狀圖和(C)箱形圖
綜上所述,本工作設(shè)計了一種基于磁性探針的級聯(lián)相轉(zhuǎn)移微流控芯片,用于CTCs的分選、純化和釋放,通過ICP-MS測定細(xì)胞內(nèi)源性元素鋅(Zn),實(shí)現(xiàn)了CTCs細(xì)胞的高靈敏度檢測。這種微流控芯片設(shè)計簡單,集成化高,既包含適配體修飾磁性探針介導(dǎo)下的主動分選,又包含螺旋通道和鋸齒凹槽引起的被動分選。
此外,在所設(shè)計的微流控芯片中,CTCs發(fā)生級聯(lián)相轉(zhuǎn)移,從樣品相轉(zhuǎn)移至PBS實(shí)現(xiàn)分離和純化,再轉(zhuǎn)移至核酸酶溶液中實(shí)現(xiàn)釋放,其CTCs的分選、純化和釋放效率高。在實(shí)際血樣中,CTCs的加標(biāo)回收率為84%,白細(xì)胞的數(shù)量從10?數(shù)量級減少至100個左右。所建立方法被成功地應(yīng)用于乳腺癌患者血液樣本中CTCs的檢測。此外,采用內(nèi)源性元素標(biāo)簽策略和從細(xì)胞表面溫和去除磁性探針顯著提高了細(xì)胞活力,回收的細(xì)胞活性高達(dá)99.3%。綜上所述,所構(gòu)建的方法在癌癥的早期診斷、腫瘤進(jìn)展監(jiān)測和腫瘤預(yù)后評估等臨床應(yīng)用方面表現(xiàn)出巨大的應(yīng)用潛力。
審核編輯:劉清
-
微流控芯片
+關(guān)注
關(guān)注
13文章
303瀏覽量
19301 -
電感耦合
+關(guān)注
關(guān)注
1文章
67瀏覽量
16186
原文標(biāo)題:基于磁性探針的級聯(lián)相轉(zhuǎn)移微流控芯片,用于循環(huán)腫瘤細(xì)胞的分選和檢測
文章出處:【微信號:Micro-Fluidics,微信公眾號:微流控】歡迎添加關(guān)注!文章轉(zhuǎn)載請注明出處。
發(fā)布評論請先 登錄
功率放大器在液滴微流控細(xì)胞分選中的應(yīng)用

Aigtek功率放大器在微流控醫(yī)學(xué)領(lǐng)域研究中有哪些應(yīng)用
微流控芯片在細(xì)胞培養(yǎng)檢測中的應(yīng)用
玻璃微流控芯片的特點(diǎn)
常用的微流控芯片類型
使用原代腫瘤細(xì)胞進(jìn)行藥物篩選的數(shù)字微流控系統(tǒng)
S型微流控芯片的優(yōu)勢
微流控陣列芯片和普通芯片的區(qū)別
ATG-2000系列功率信號源在介電電泳細(xì)胞分選測試中的應(yīng)用

COC/COP微流控芯片開發(fā)與應(yīng)用
寬帶功率放大器基于微流控技術(shù)的細(xì)胞分選的應(yīng)用
射頻功率放大器在超聲實(shí)現(xiàn)離體腫瘤細(xì)胞研究的應(yīng)用




















評論