本文基于離心芯片采用由表面張力輔助的不混溶性結構實現全血中 cfDNA 的提取。整個操作過程小于 15 min,從血漿中回收的cfDNA為 65%,從全血中回收的為 30%。
液體活檢簡述見揭開液體活檢技術的神秘面紗(附視頻)
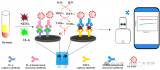
如圖 1 所示,直徑 100 mm 芯片由兩部分組成:一部分用于血漿分離和轉移,另一部分用于核酸分離。 其中,血漿分離是基于離心法實現的;一個漏斗狀的腔室被用于血漿提取,該腔可容納 4 mL 全血。在虹吸通道中設計有空氣閥,避免在采樣過程中血液在毛細管作用下進入樣品腔。
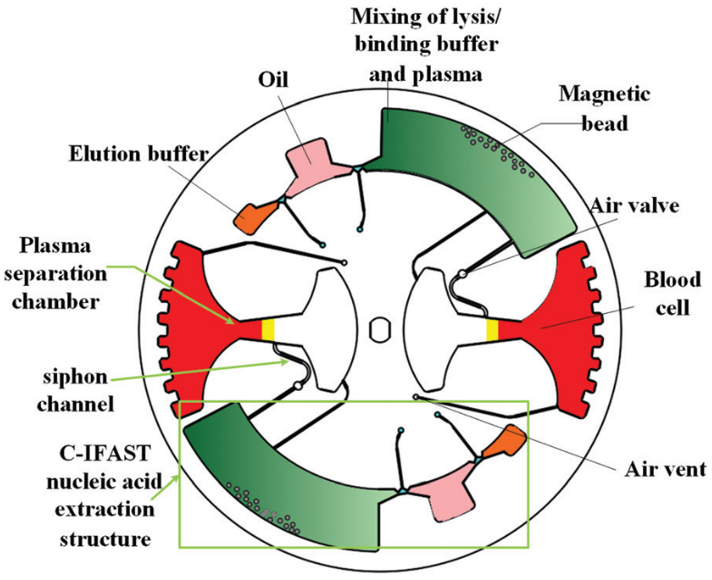
圖 1
cfDNA 的提取和純化如圖 2 所示;腔室間通過拱狀毛細管微通道相互連接,其中微通道高度為 200 μm,寬度從 400 μm 到 3 mm 不等。該結構的關鍵是確保整個過程中所有相的不混溶性,并確保在磁珠轉移過程中形成穩定的界面。
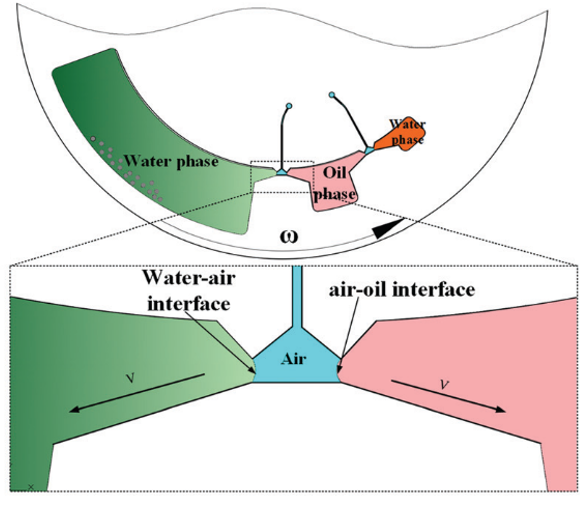
圖 2
鑒于此,本文設計了一個用于不混溶相中磁珠轉移的拱狀通道(圖 2 放大圖)。根據表面張力在微尺度上的主導作用,一個虛擬的 水-空氣“墻”和 空氣-油“墻” 形成,以避免在芯片靜止期間 (樣品加載和磁珠轉移時)水和油的混合。
其它類似結構見迷你樣品進結果出核酸檢測儀(附視頻)
為了提高旋轉過程中不混溶相界面的強度,對空氣微腔表面進行聚四氟乙烯處理 (Teflon treatment),降低表面能,增加空氣介質表面與水/油界面的張力。
在芯片啟動加速過程中,微通道中形成了不混溶相的界面。如果角加速度過大,則當不混溶相界面兩側的壓差超過表面張力,不混溶相界面將被破壞。
芯片實物圖如圖 3 所示。

圖 3
磁珠在外磁場作用下連續通過幾個不混溶界面。在磁珠轉移過程中,磁珠在外部磁力的作用下凝聚成團。如果磁力克服界面張力,磁珠就能穿過界面。
芯片中各個腔室尺寸如圖 4 所示。

圖 4
圖 5 所示為芯片制作流程;首先由 CNC 加工模具,然后將 PDMS 涂在模具上,隨后剝離粘接在玻璃片上。
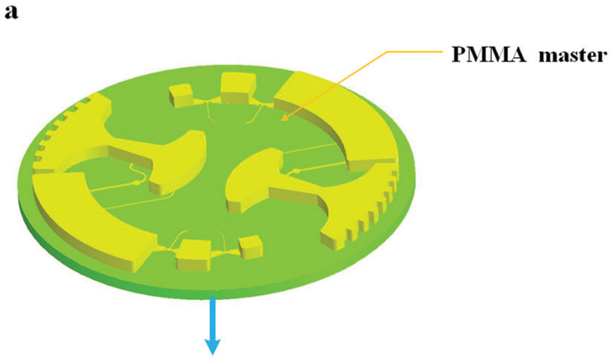
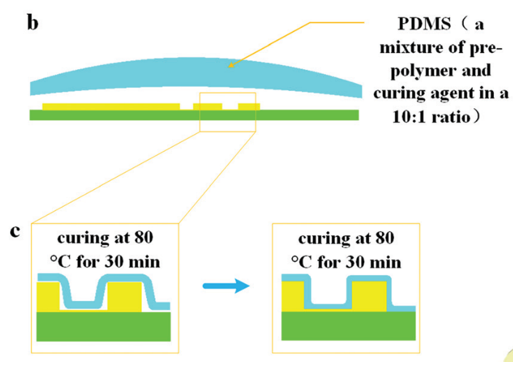
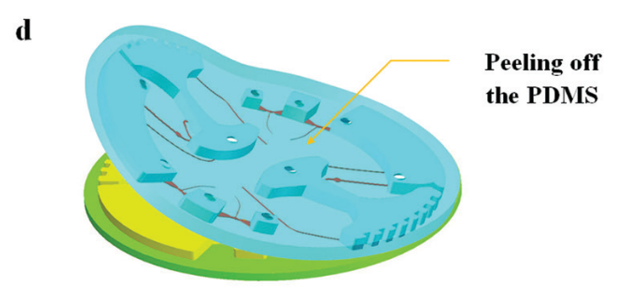
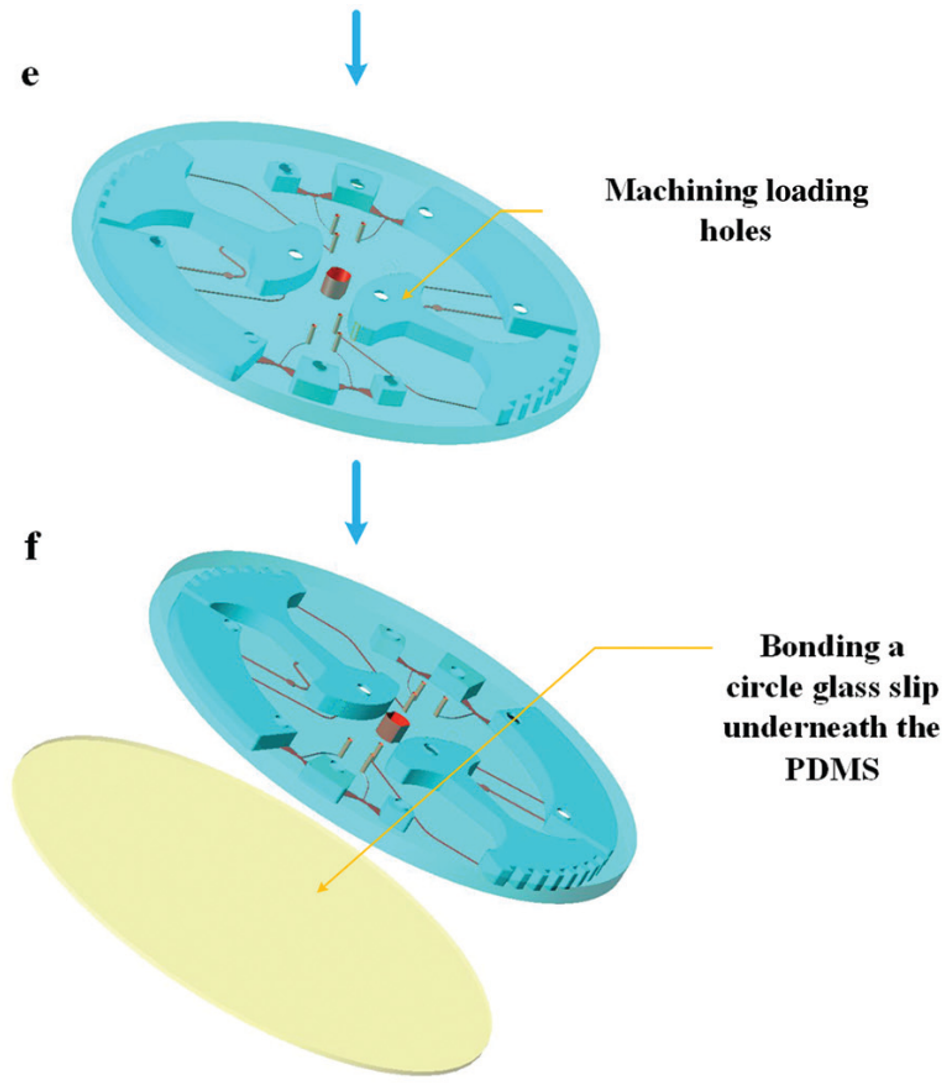
圖5
樣品加載過程如下:首先,將 4 ml 全血 (摻有 HBV 片段短 DNA) 加載到血漿分離腔中;然后將 15 μl二氧化硅包被的磁珠,1.25 ml裂解/結合緩沖液,50 μl 的洗脫液注入對應的腔室。最后將硅油注入400 μl不混溶相腔。
本文采用硅油替代 FC-40 等氟化油是由于氟化油會導致氣腔表面處理的聚四氟乙烯溶解。
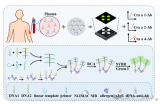
對于血漿分離,芯片首先被緩慢加速到一個特定的速度 (120 rpm),以保持穩定的不混相界面。然后將芯片加速到 3600 rpm,持續 4 min。在細胞沉降后,芯片在減速期間激活虹吸閥。隨后,分離的1.6 ml血漿樣本被離心到血漿收集腔,用于后續 cfDNA 提取。
提取到血漿后,芯片開始進行核酸提取。采用加減速將磁珠、血漿,和裂解/結合緩沖液混合,以高效地將 cfDNA 結合到磁珠表面。
隨后移動外部磁鐵,將磁珠穿過不混溶相進入洗脫緩沖液中。此時,純化的 cfDNA 就被帶入洗脫腔。再次采用加減速混合將核酸從磁珠表面洗脫。最后收集洗脫腔上清液用于下游檢測。如采用 定量 PCR 或數字 PCR。
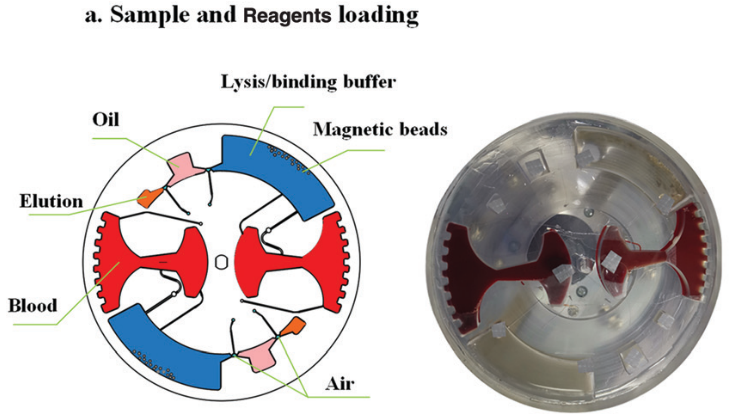
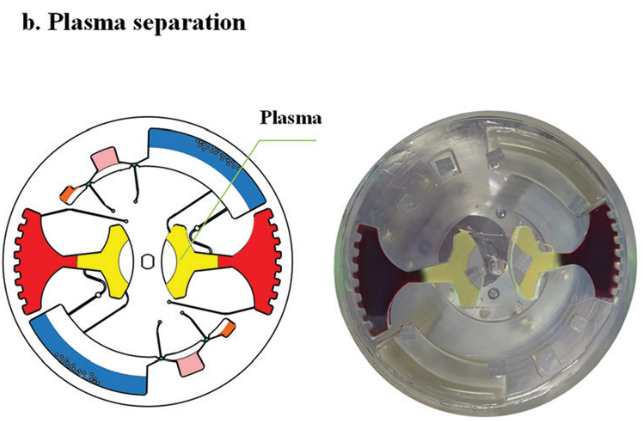
圖 6
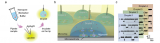
芯片首先以較低的角速度 (10 rpm/s) 啟動,以保護不混溶相界面不發生混溶。當角速度增加到一個特定的值(120 rpm)時,不混溶相液體離開微通道進入腔室。然后,在 500 rpm/s 的加速度下升至 3600 rpm ,持續 4 min 實現血漿分離 (圖 6)。
在血漿分離腔的底部,設計了指狀結構有助于分散芯片旋轉期間產生的離心壓力。
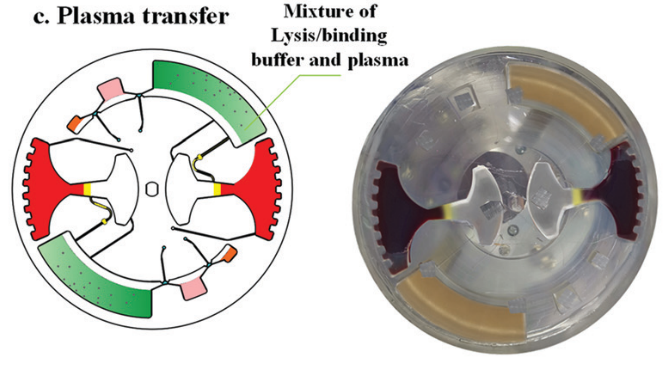
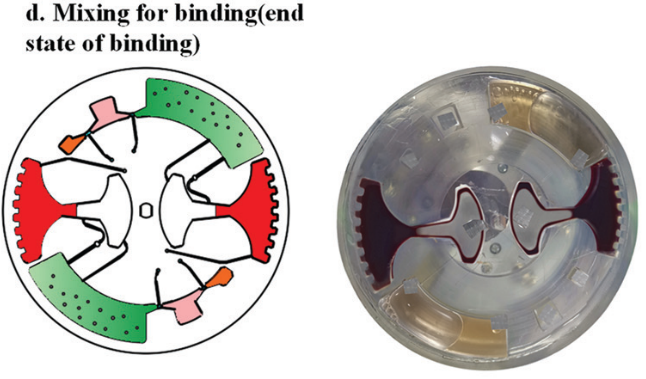
圖 7
血漿分離后,芯片以 50 rpm/s 的減速度減至 350 rpm 激活虹吸閥,然后,以 20 rpm/s 的加速度至600 rpm轉移 1.6 ml血漿到 cfDNA 提取腔(圖 7)。
隨后,進行 cfDNA 提取。芯片首先在120 - 840 rpm 之間進行加減速混合,持續 150 s 實現 磁珠、血漿,和裂解/結合緩沖液混合。之后手持磁鐵以~5mm/s 的速度手動移動,將腔室內磁珠穿過不混溶的屏障進入洗脫腔。
然后,再次在120 - 840 rpm 之間進行加減速混合,以充分洗脫核酸。
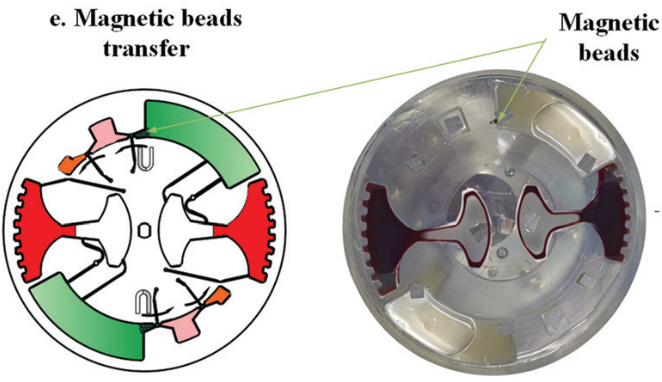
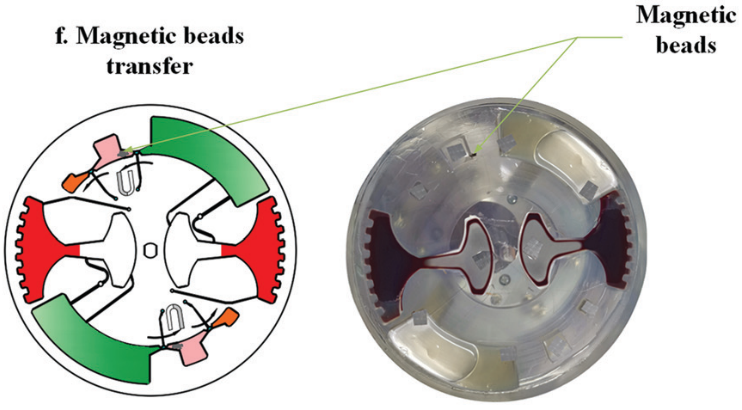
圖 8
在血漿提取時,離心速度不能太快;如果速度太快,血細胞可能會破裂,導致內部物質釋放出來,即所謂的 溶血。
在血漿分離過程中是否發生溶血現象,不僅取決于離心速度,還取決于離心時間。因此,合理的離心速度和時間是極其重要的。
低離心速度和短離心時間可能導致分離不充分,而高離心速度和長離心時間可能引起溶血現象。
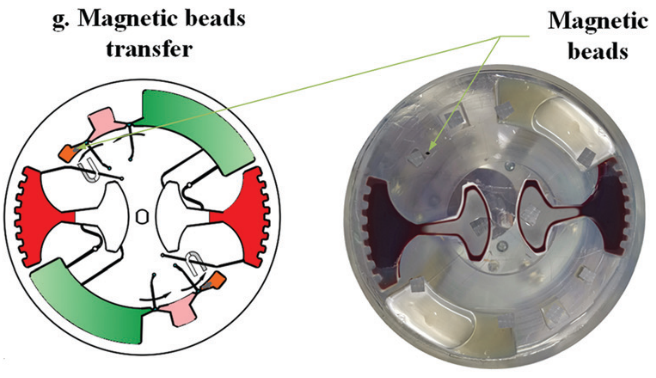
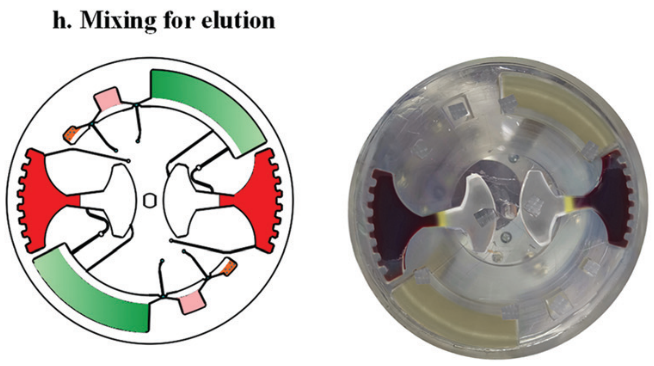
圖9
附錄
什么是溶血?
溶血是指紅血細胞(也稱為紅細胞或血球)在一定條件下破裂和釋放其內部的血紅蛋白和其他細胞成分的過程。這通常發生在紅細胞受到物理、化學或生物學上的壓力或損傷時。溶血可以在體內或體外發生,具體取決于引發溶血的原因。
在體內,溶血可能由各種原因引起,如遺傳性貧血癥、自身免疫性疾病、藥物反應、感染等。在體外,溶血通常涉及實驗室操作或臨床檢測,如血液分離、儲存和輸送過程中的意外損傷。
溶血會導致血紅蛋白釋放到血漿中,這可能對機體產生負面影響,因為血紅蛋白可以引起腎臟損害和其他并發癥。在臨床和實驗室環境中,控制溶血是非常重要的,以確保血液樣本和制備的產物的質量和完整性。
判斷是否發生溶血通常涉及對血液樣本或液體中的特定指標進行分析和觀察。以下是幾種常見的方法來判斷是否發生了溶血現象:
顏色變化:溶血通常會導致液體從紅色變成粉紅色或透明,這是因為釋放出的血紅蛋白會影響液體的顏色。
吸光度測量:在實驗室環境中,可以使用分光光度計來測量液體的吸光度。溶血會導致液體中血紅蛋白的濃度增加,從而使吸光度值升高。
紅細胞計數和形態觀察:可以使用顯微鏡觀察血液樣本中的紅細胞數量和形態。溶血可能導致紅細胞數量減少,同時紅細胞的形態也可能發生改變。
血紅蛋白測量:使用血紅蛋白測量方法,如比色法或電化學法,可以測定液體中的血紅蛋白濃度。溶血會導致血紅蛋白濃度升高。
血漿游離血紅蛋白測定:溶血會釋放血漿中的游離血紅蛋白。通過測量游離血紅蛋白的濃度,可以判斷是否發生了溶血。
細胞膜標記物測定:可以通過測量紅細胞膜上的特定標記物的濃度,如LDH(乳酸脫氫酶)和鉀離子,來判斷紅細胞是否受損和是否發生了溶血。
審核編輯:劉清
-
磁珠
+關注
關注
6文章
267瀏覽量
44196 -
微流控芯片
+關注
關注
13文章
274瀏覽量
18855 -
PCR
+關注
關注
0文章
118瀏覽量
19608
原文標題:一種用于液體活檢生物標志物(ctDNA)檢測的微流控芯片
文章出處:【微信號:MEMS拓荒者,微信公眾號:MEMS拓荒者】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
微流控技術在病原微生物檢測中的研究進展
高通量生物分析技術之微流控芯片
基于一種AI輔助可穿戴微流控比色傳感器系統
諾基亞宣布 23 億美元收購美國光通信設備制造商英飛朗,索尼半導體發布工業用8K寬幅全局快門圖像傳感器




 一種用于液體活檢生物標志物(ctDNA)檢測的微流控芯片
一種用于液體活檢生物標志物(ctDNA)檢測的微流控芯片













評論