微流控系統已經成為實驗室芯片和器官芯片應用中的重要組成部分,其通常使用聚二甲基硅氧烷(PDMS)芯片和玻璃基片制造。但這些材料缺乏生物醫學場景應用所需的生物活性。為克服這個問題,研究人員通常使用氧(O?)等離子體對材料進行處理或使用化學試劑(如氨基硅烷)來固定生物分子。然而,O?等離子體處理不穩定,無法共價固定生物分子,而濕化學方法則具有毒性、耗時和昂貴的缺點。
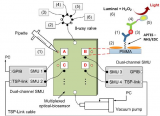
近期,來自澳大利亞悉尼大學(The University of Sydney)的Anna Waterhouse和Marcela Bilek團隊開發了一種新型微流控平臺,該平臺結合了兩種等離子體表面處理方法:等離子體活化涂層(PAC)和大氣壓等離子體射流(APPJ),從而實現了無試劑的共價固定生物分子。這種混合微流控平臺的鍵合強度與標準的O?等離子體裝置相當,但在動脈芯片模型中大大提高了內皮細胞的生長。該平臺還適用于冠狀動脈剪切等高剪切應用。通過在微流控系統中提供無試劑的共價固定生物分子,這項技術有潛力從根本上改善器官芯片、實驗室芯片系統以及即時診斷傳感器的開發。相關工作以“Reagent-Free Covalent Immobilization of Biomolecules in a Microfluidic Organ-On-A-Chip”為題發表在國際頂級期刊Advanced Functional Materials上。
PAC和APPJ在PDMS和玻璃表面誘導官能團并產生自由基
本研究探究了利用三種不同的等離子體處理方法來處理微流控基底,它們分別是O?等離子體、PAC和APPJ(圖1A)。研究人員使用XPS和EPR進行表面表征,以評估不同處理后的表面化學性質。XPS分析顯示,在所有處理中,都存在一個強烈的氧峰,這是因為在處理后暴露在空氣中時,自由基和反應性基團容易與大氣中的氧發生氧化反應,這個過程被稱為自氧化。與未處理樣品(UT)相比,PAC處理引入了氮和碳,這從XPS分析中N1s和C1s峰的增強可以明顯看出,而且不受基底的影響(圖1B、C)。為更詳細地了解基底上的碳物種和所研究的處理方法,對C1s峰進行了解卷積,得到了4個不同的結合能(284.2、286、287.5和289 eV),分別與C-C、C-O(或C-N)、C=O(或C=N)和O-C=O鍵相關聯(圖1D)。從定性角度上看,PDMS和玻璃上的C1s峰相似。與這些基底上的O?等離子體不同,PAC處理PDMS和APPJ處理玻璃在各自的基底上引入了多樣的功能基團,包括酮基(C=O)和羧基(O-C=O)(圖1D)。
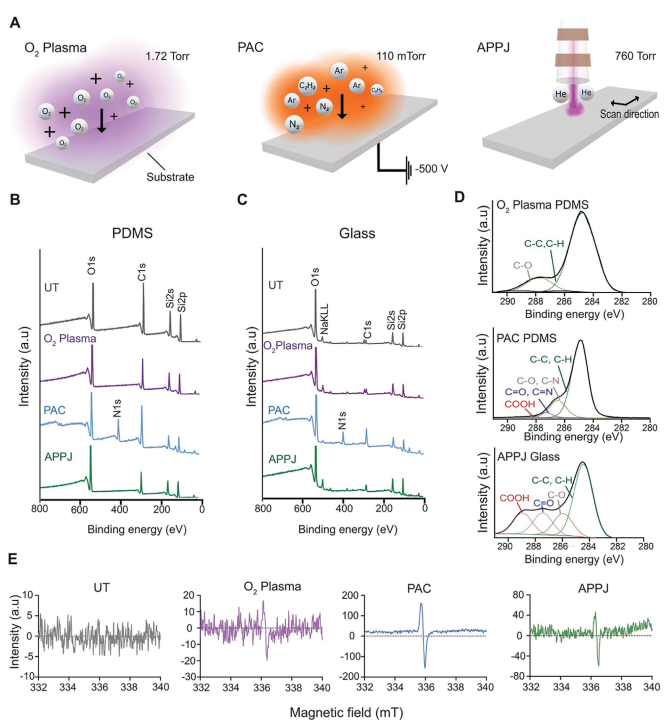
圖1 PAC和APPJ可誘導形成官能團和自由基
為進一步表征這些表面及其老化特性,本研究評估了它們的潤濕性。樣品在室溫下儲存于環境條件中。未處理的PDMS具有109°±2的水接觸角,經過O?等離子體、PAC和APPJ處理后,分別降至5°±2°、28.0°±1.2°和4°±2°(圖2A)。經過O?等離子體或APPJ處理的PDMS在4天內恢復了其原始潤濕性。未處理的玻璃具有62.37°±0.04°的水接觸角,經過O?等離子體、PAC和APPJ處理后,分別降至6°±2°、26°±2°和5°±3°(圖2B)。在14天內,這些處理方法都沒有恢復到玻璃的原始潤濕性。疏水恢復受到空氣暴露和較高溫度的影響。因此,可以優化適當的無氧儲存條件和較低的溫度,以保持表面特性更長時間。
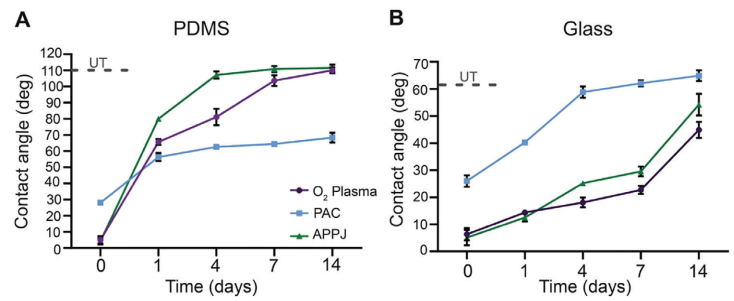
圖2 PDMS上的PAC潤濕性恢復較慢
PAC和APPJ可將纖連蛋白共價固定在PDMS和玻璃上
為實現蛋白質與表面的共價固定化,以及控制定向和高表面覆蓋度,本研究探究了等離子體處理表面共價固定關鍵細胞外基質蛋白纖維連接蛋白的能力(圖3A)。在PDMS和玻璃上的結果相似,在未處理和等離子體處理的基底上存在相當數量的物理吸附的纖維連接蛋白(圖3B、C)。為具體量化共價固定,樣品經過了SDS洗滌,這是一種已經被廣泛接受的去除非共價結合生物分子的方法。在用SDS洗滌樣品后,在未處理樣品上觀察到極少量的纖維連接蛋白,表明幾乎沒有或沒有共價固定。值得注意的是,經過O?等離子體處理的基底也未能在PDMS和玻璃上共價固定纖維連接蛋白,在SDS處理后顯示出較低的蛋白質水平(圖3B、C)。有趣的是,經過APPJ和PAC處理的基底含有顯著更多的共價結合的纖維連接蛋白,在SDS洗滌后仍然保留(P < 0.05),與PDMS和玻璃上的O?等離子體和未處理樣品相比(圖3B、C)。這些數據突出了APPJ和PAC在微流控技術中共價固定生物分子的潛力。
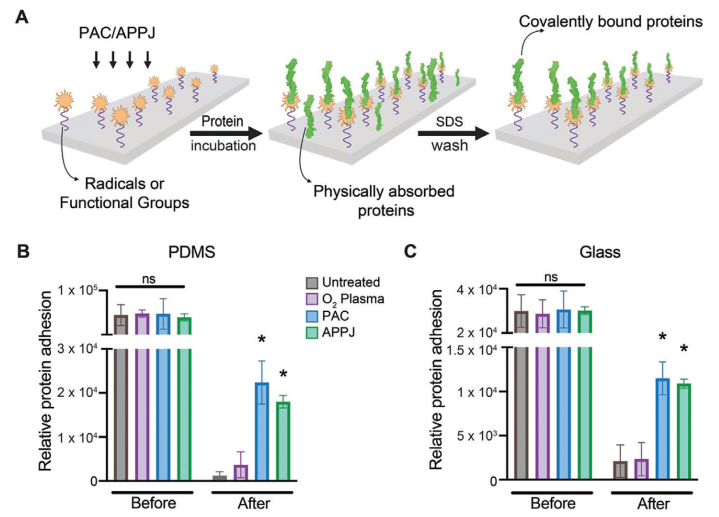
圖3 PAC和APPJ可將纖維連接蛋白共價固定在PDMS和玻璃上
PAC和APPJ處理可促進HCAEC在玻璃基底上的附著
在確定了PAC和APPJ共價固定纖維連接蛋白的能力后,本研究探究了人冠狀動脈內皮細胞(HCAEC)在玻璃和PDMS上的附著和增殖情況,以評估它們在器官芯片應用中的潛力(圖4A)。在未處理的玻璃和PDMS上觀察到極少的細胞附著,而組織培養(TC)塑料強烈促進了細胞附著。有趣的是,所有經過等離子體處理的PDMS樣品的細胞附著情況相似(圖4B)。類似地,與未處理的玻璃相比,O?等離子體處理并未促進細胞附著,但在形態上,O?等離子體處理表面上的HCAEC呈現出較少的圓形,表明更好地附著于底物上(圖4C)。然而,與未處理的玻璃相比,PAC和APPJ處理顯著提高了細胞在玻璃上的附著(P < 0.01),并且相對于O?等離子體處理的玻璃也有顯著改善(P < 0.05)(圖4B)。
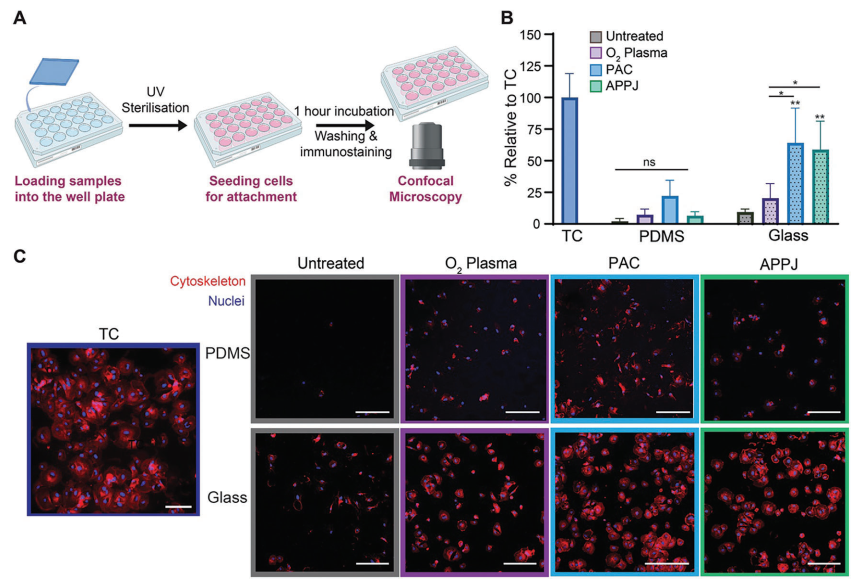
圖4 PAC和APPJ處理可促進HCAEC在玻璃表面的附著
PAC促進HCAEC在PDMS和玻璃基底上增殖,APPJ促進HCAEC在玻璃上增殖
為更好地了解這些表面支持細胞生長的傾向,本研究評估了HCAEC在3天和5天后的增殖情況。未經處理的玻璃和PDMS上發生了極少的細胞附著,因此這些樣品未包括在增殖研究中。正如預期的那樣,TC塑料在3天和5天內強烈支持細胞增殖(圖5A-C)。然而,在PDMS上,無論是經過O?等離子體處理還是APPJ處理,都未能支持細胞生長,即使經過5天,表面上也只有少數細胞存在(圖5A-C)。相比之下,與O?等離子體和APPJ處理相比,經過PAC處理的PDMS上的細胞增殖率提高了四倍(P < 0.05),顯示出與當前金標準材料TC塑料相當的支持細胞生長能力。在玻璃基底上,總體上與附著實驗類似,HCAEC的增殖率比處理相似的PDMS基底要高。雖然O?等離子體處理的玻璃與TC塑料表現相當,但經過PAC處理的玻璃上的細胞增殖率在3天內比O?等離子體處理的玻璃高2.1倍(P < 0.05)(圖5C)。相比TC塑料,PAC和APPJ處理的玻璃基底上的細胞增殖率增加了1.1倍(P < 0.05)。雖然在第5天時,等離子體處理的玻璃基底之間沒有觀察到差異,但這是因為樣品上形成了近似連續單層的細胞。這些結果表明,PAC處理有效地支持PDMS和玻璃基底上的細胞增殖,而APPJ處理在玻璃基底上促進了最高程度的增殖。本研究還在類似條件下培養了人冠狀動脈平滑肌細胞(HCASMCs),并獲得了相同的增殖趨勢。
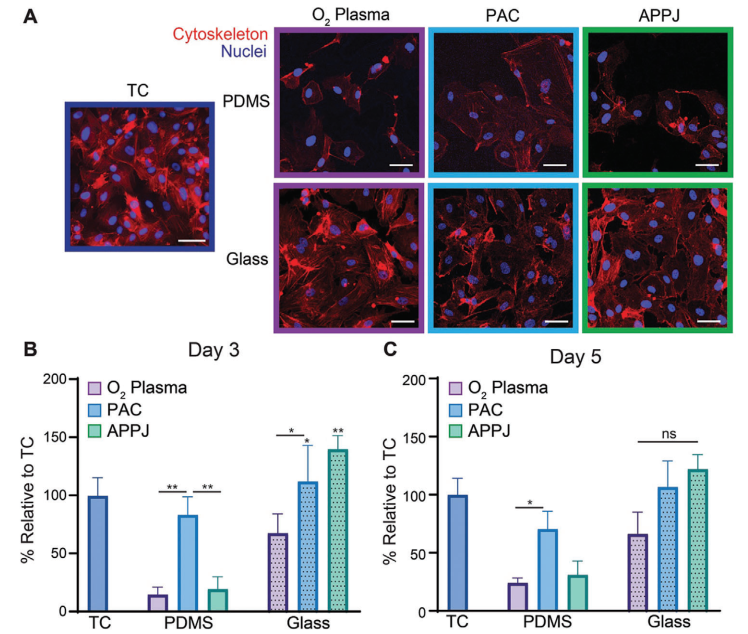
圖5 PAC可促進HCAEC在PDMS和玻璃基底上增殖,APPJ可促進HCAEC在玻璃基底上增殖
PAC和APPJ處理促進了HCAEC在動脈芯片中的生長和功能
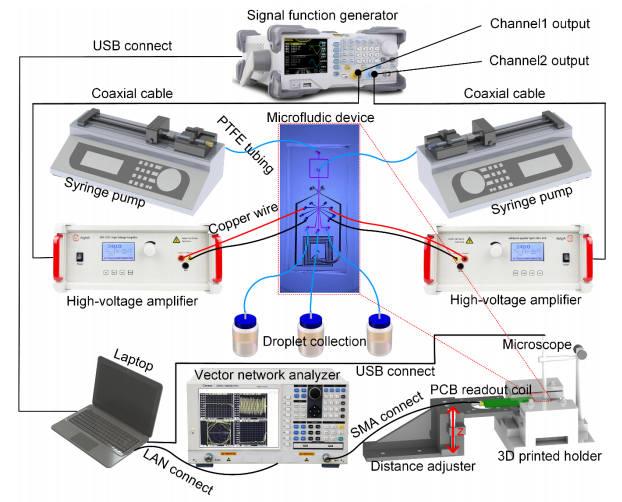
為確定使用PAC和APPJ處理共價固定纖維連接蛋白是否能夠支持微流控通道中的細胞行為的改善,利用這些等離子體處理方法開發了一種動脈芯片系統。為此,對所有生長表面(玻璃和PDMS)進行了相關等離子體處理(包括O?等離子體、PAC或APPJ)。以后,這些裝置被稱為O?等離子體、PAC或APPJ裝置(圖6A)。HCAEC在這些裝置中進行培養,連續灌注并在低剪切力(0.007 dyn/cm2)下培養3天。在沒有斑點蛋白功能化的裝置中,等離子體處理之間的細胞數量差異很小(圖6B)。然而,在涂覆了斑點蛋白之后,在PAC(P < 0.001)和APPJ(P < 0.0001)裝置上存在至少1.6倍的細胞,與本研究的共價固定數據和斑點蛋白促進細胞增殖的能力一致(圖6C)。有趣的是,與O?等離子體處理的裝置相比,經斑點蛋白涂層后,APPJ裝置和PAC裝置上的細胞數量更多(分別為P < 0.01和P < 0.0001),APPJ裝置上的細胞數量也比PAC裝置多1.3倍(P < 0.01)。盡管斑點蛋白在微流控中促進了細胞增殖,但經過斑點蛋白涂層的氧等離子體處理裝置與未涂層的PAC和APPJ裝置的細胞計數相當(P > 0.05),突顯了這些新型等離子體處理方法在器官芯片平臺上的優越性。
本研究還對CD31的表達進行了定量分析。CD31是一種關鍵的內皮細胞標記物,在沒有斑點蛋白涂層的情況下,O?等離子體裝置上的HCAEC表達的CD31比PAC裝置少1.3倍(P < 0.01),但與APPJ裝置相比沒有差異,而且PAC和APPJ裝置之間的CD31水平相當(P > 0.05)(圖6D)。在斑點蛋白功能化之后,所有三種裝置類型上的CD31水平都有所增加,但在處理之間沒有觀察到差異(P > 0.05)。與細胞增殖趨勢類似,未涂覆斑點蛋白的PAC和APPJ裝置中的HCAEC表達的CD31水平與涂覆斑點蛋白的氧等離子體裝置相當(P > 0.05)。
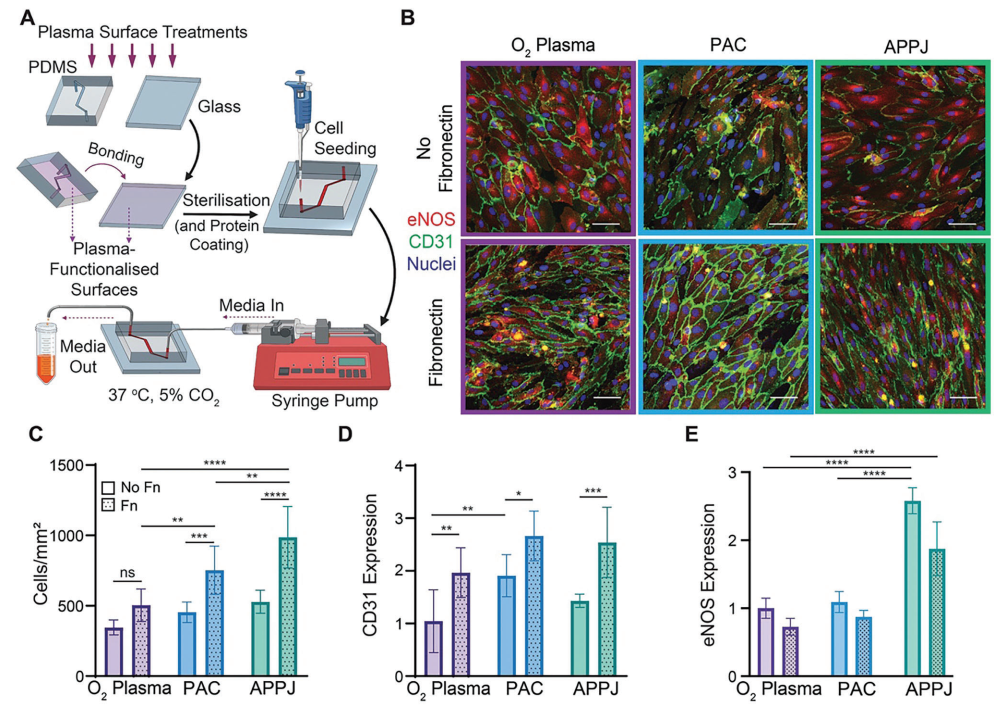
圖6 PAC和APPJ治療可促進HCAEC在芯片中的動脈的生長和功能
PAC-APPJ混合裝置可改善低剪切力和冠狀動脈剪切力條件下的內皮化效果
根據衰老和生物活性結果,本研究得出結論:對于PDMS材料,PAC處理是最佳選擇;而對于玻璃基底,APPJ提供最佳結果。然而,只有APPJ處理的裝置才能提供足夠的穩定性和結合強度,以用于涉及高流體流動或剪切力的實驗,這在許多器官芯片應用中是必需的。通過將APPJ處理的玻璃與PAC處理的PDMS結合,本研究開發了一種混合微流控裝置,克服了PAC處理裝置的結合強度問題,同時實現了蛋白質的共價固定和所有表面上優越的細胞生長。為了創建這種混合微流控裝置,PDMS鍵合表面被屏蔽,只暴露通道表面,然后該區域經過PAC處理(圖7A)。然后,移除屏蔽層,并將底物經過APPJ處理并與經過APPJ處理的玻璃蓋片鍵合。由于鍵合是通過APPJ處理的表面進行的,所以這種混合微流控裝置保持了這些鍵合的高強度,同時確保兩種底物相對于標準方法都提供了優越的細胞增殖(圖7A)。使用XPS和厚度分析評估,發現PAC表面在APPJ處理后沒有顯著變化。
為評估混合微流控裝置在經過斑點蛋白功能化后用于器官芯片應用的潛力,將內皮細胞的生長與經過O?等離子體處理的裝置進行了比較。在混合裝置中,發現在3天內幾乎完全內皮化,而在經過O?等離子體處理的裝置中沒有觀察到這種情況(圖7B-D)。與傳統的O?等離子體裝置相比,混合裝置上的頂部PDMS(P < 0.05)和底部玻璃基底(P < 0.01)上的細胞數量更多,這與靜態增殖研究中觀察到的趨勢非常相似(圖5C),突顯了該平臺的優越生物功能化。為了進一步優化其性能,本研究在冠狀剪切條件(12.7 dyn/cm2)下在混合裝置中培養HCAEC細胞3天,細胞在玻璃基底上形成了一層連續而有序的單層(這是典型的暴露于剪切力的內皮細胞的特征),在頂部PDMS表面上幾乎完全內皮化(圖7E)。相比之下,與頂部的PAC處理的PDMS相比,HCAEC在APPJ處理的玻璃表面上更加有序。與低剪切力裝置上相同的表面相比,兩種表面上的HCAEC都更加有序(P < 0.0001)(圖7F)。綜上所述,這些結果表明,本研究的混合微流控裝置能夠在低剪切力和冠狀剪切條件下實現微流控芯片的優越內皮化。
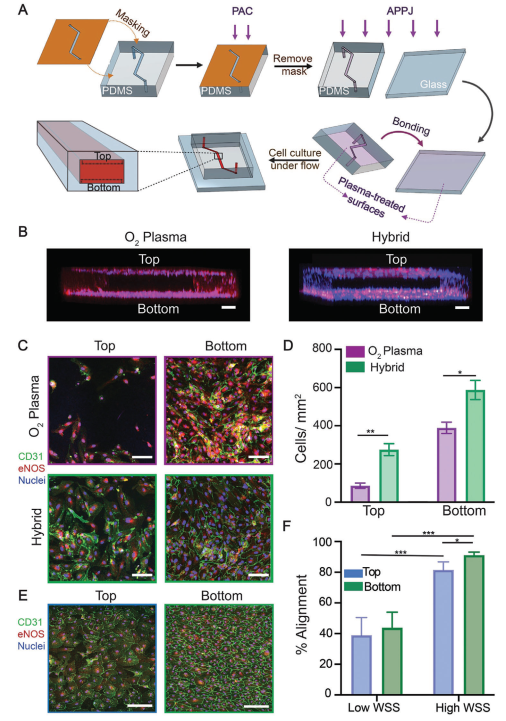
圖7 混合微流控裝置促進芯片動脈健康內皮的形成
綜上所述,本研究開發了一種混合等離子體處理的微流控平臺,利用PAC和APPJ在微流控表面上共價固定生物分子,極大地改善了動脈芯片中細胞的附著和增殖。本研究的系統具有與標準方法相當的鍵合強度,并且在PDMS上具有改善的老化特性。考慮到該平臺能夠在微流控系統中共價固定生物分子,本研究的技術可以應用于更廣泛的領域,包括即時診斷、實驗室芯片,或不同的器官芯片模型系統。此外,本研究的技術的廣泛適用性還可以在生物學和醫學以外的領域使用,例如進行食品或環境中分子的傳感。
論文鏈接: https://doi.org/10.1002/adfm.202313664
-
SDS
+關注
關注
0文章
50瀏覽量
16019 -
XPS
+關注
關注
0文章
97瀏覽量
12291 -
微流控系統
+關注
關注
1文章
88瀏覽量
2051
原文標題:微流控器官芯片中生物分子的無試劑共價固定
文章出處:【微信號:Micro-Fluidics,微信公眾號:微流控】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
微流控技術在病原微生物檢測中的研究進展
玻璃微流控芯片的特點
微流控技術的生物學應用
安泰功率放大器應用領域:微流控技術和分子結合的體外診斷研究



















評論