以下文章來源于Uselong Biotech,作者玉珠隆生物
電導(dǎo)率測量技術(shù)已經(jīng)經(jīng)歷了一個多世紀的發(fā)展,至今它依然是分析領(lǐng)域中廣泛使用的一個重要參數(shù)。由于其高度的可靠性、出色的靈敏度、迅速的響應(yīng)能力以及相對低廉的成本,電導(dǎo)率測定成為了一個既高效又易于操作的質(zhì)量控制工具。電導(dǎo)率反映的是溶液中所有溶解離子(如鹽、酸、堿和某些有機物)的總體導(dǎo)電能力,這是一個非特異性的總體參數(shù)。該技術(shù)無法區(qū)分溶液中的各種不同離子。測量得到的電導(dǎo)率讀數(shù)與樣品內(nèi)所有離子的綜合效應(yīng)成正比。因此,這項技術(shù)非常適合用于監(jiān)測各種類型的水質(zhì)(例如純水、飲用水、天然水、工業(yè)用水等)以及其他溶劑,同時也適用于測量導(dǎo)電性化學(xué)品的濃度。
電導(dǎo)率是衡量物質(zhì)導(dǎo)電能力的指標,它描述了物質(zhì)能夠多好地傳遞電流。電流的流動依賴于物質(zhì)中帶電粒子的存在。根據(jù)這些帶電粒子的特性,導(dǎo)體可以分為兩大類。第一類是由具有外層電子的原子晶格構(gòu)成的導(dǎo)體。在這些材料中,電子構(gòu)成了一個“電子云”,它們可以自由地脫離原子并在晶格或材料中移動,從而傳導(dǎo)電流。金屬、石墨以及某些其他化合物都屬于這一類。第二類導(dǎo)體被稱為離子導(dǎo)體,它們與第一類導(dǎo)體的主要區(qū)別在于,電流是由離子而非自由電子來傳導(dǎo)的。在這類導(dǎo)體中,電荷的轉(zhuǎn)移總是伴隨著物質(zhì)的遷移。這些導(dǎo)體由帶電且可移動的離子組成,通常被稱為電解液。它們通過在極性溶劑(如在水中)溶解或熔化來實現(xiàn)電離。
電導(dǎo)率定義:
根據(jù)歐姆定律V=R×I可知溶液中的電壓V與電流I成正比。該公式中R為電阻(單位歐姆,Ω),V為電壓(單位伏特,V),I為電流(單位安培,A)。電阻R是比例常數(shù),可使用測得的電壓V除以測得的電流I進行計算。
電導(dǎo)(用G表示,單位為西門子,S)的定義為電阻的倒數(shù),即G=1/R
為了測定樣品的電阻或電導(dǎo),需要使用測量電極的設(shè)備。該設(shè)備至少包含兩個帶有相反電荷的電極板,它們共同構(gòu)成了測量電極系統(tǒng)。這些電極板與絕緣支撐體一起,組合形成了一個完整的傳感器單元。
讀數(shù)取決于測量電極板的幾何形狀,以電極常數(shù)(K)表示。它是電極板距離(L)和面積(A)的比值,即K=L÷A。該公式中,K為電極常數(shù)(單位cm-1),L為電極板之間的距離(單位cm),A為電極板之間電解液的有效橫截面積(單位cm2)
電導(dǎo)可轉(zhuǎn)化為標準化的電導(dǎo)率(σ),其獨立于測量電極的設(shè)置。該值通過電導(dǎo)乘以電極常數(shù)獲得:σ=G×K= G×L÷A。電導(dǎo)率σ的單位為S/cm。
溶液的電導(dǎo)率:純?nèi)軇┎痪邔?dǎo)電性,因此電導(dǎo)率接近零。只有帶有離子或極性鍵的溶解固體才可使溶液導(dǎo)電。絕對純水也包含一些離子,因此導(dǎo)電,該效果由水的自電離導(dǎo)致。
溶解離子:固體溶解和離子形成被稱作電解電離。這是在溶劑中導(dǎo)電的前提。電解電離的示例如下所示:
NaCl→ Na++ Cl-
HCl→ H++ Cl-
CH3COOH→ CH3COO-+ H+
電解液可以根據(jù)其電離程度被劃分為強電解液和弱電解液。強電解液,如氯化鈉,在水中能夠完全電離,生成鈉離子(Na?)和氯離子(Cl?)。而弱電解液,如乙酸,則只能部分電離。在這種情況下,電解液中會同時存在離子形態(tài)的醋酸根離子(CH?COO?)、質(zhì)子(H?),以及未電離的乙酸分子(CH?COOH)。
電解液的電離對溫度的依賴性很強,可通過電離速率或電離常數(shù)進行定量。在電解液中,僅電離后的離子部分與電導(dǎo)率相關(guān)。離子對電導(dǎo)率的貢獻率取決于其濃度、電荷和移動性。樣品電導(dǎo)率σ可表示為溶解離子濃度及其電化學(xué)屬性的函數(shù),如下:

當量電導(dǎo)λ是離子的特定屬性,它取決于離子類型、濃度以及溫度。常見離子的當量電導(dǎo)見下表:
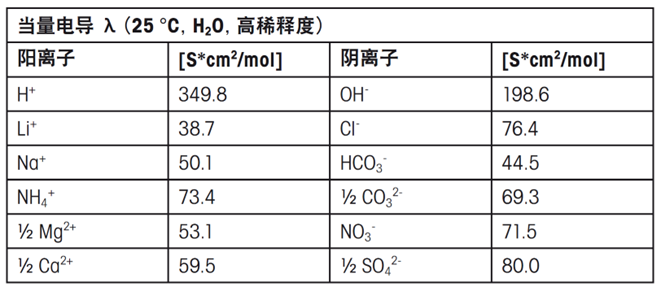
電導(dǎo)率會隨著離子電荷數(shù)的增加而提高,但隨著離子尺寸的增大而降低。實際測量的電導(dǎo)率可能與預(yù)期值有所差異,例如,鋰離子的電導(dǎo)率通常低于銨離子,盡管鋰離子的尺寸更小。這種現(xiàn)象是因為離子的溶劑化程度而非其本身的尺寸是影響電導(dǎo)率的關(guān)鍵因素。高電荷密度的小離子能夠吸引更多的水分子,形成比大尺寸但電荷數(shù)較少的離子更大的溶劑化殼層。
此外,質(zhì)子(H+)和氫氧根離子(OH-)的電導(dǎo)率異常高,這并非因為它們通過離子遷移來傳輸電荷。質(zhì)子的傳輸是通過水合氫離子(H3O+)與周圍水分子(H2O)之間的快速質(zhì)子跳躍來實現(xiàn)的,而氫氧根離子的傳輸則是通過水分子與氫氧根離子(OH-)之間的質(zhì)子跳躍來完成的。在這兩種情況下,電荷的傳輸主要是通過水分子間的快速質(zhì)子交換,而不是通過離子的物理遷移。
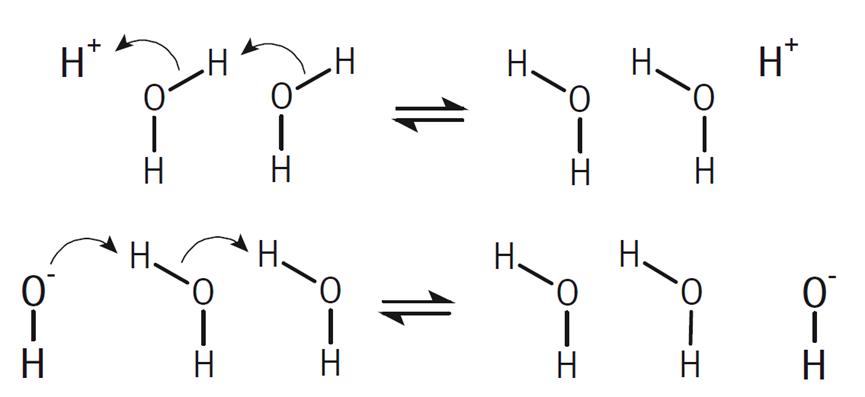
質(zhì)子和氫氧化物電荷傳輸機制
正如之前所述,當量電導(dǎo)并非一個恒定值。它會受到多種因素的影響,其中包括濃度和溫度。首先,隨著溶液濃度的增加,當量電導(dǎo)會降低。這是因為在較高濃度下,相同電荷類型的離子數(shù)量增多,它們在溶液中的移動會受到更多干擾,從而降低了電導(dǎo)效率。對于弱電解質(zhì)來說,當濃度較高時,電離程度會降低,這同樣會導(dǎo)致當量電導(dǎo)的下降。這是因為在高濃度下,電解質(zhì)的電離速率減慢,釋放出的自由離子數(shù)量減少,進而影響了電導(dǎo)率。溫度對當量電導(dǎo)的影響則更為復(fù)雜。一般來說,溫度的升高會增加離子的運動速度,并減少溶劑的粘度。這種變化使得離子更容易在溶液中移動,從而提高了電導(dǎo)率。對于弱電解質(zhì)而言,溫度的升高還能促進其電離,增加溶液中的離子濃度,進一步提升電導(dǎo)率。
電導(dǎo)率是溶液的一個重要物理特性,它受到多個參數(shù)的影響,這些參數(shù)之間存在復(fù)雜的相互作用。影響溶液電導(dǎo)率的關(guān)鍵因素主要有:①溶解電解液的類型:包括離子的電荷量、離子的半徑以及離子的移動性。電荷量較高的離子通常具有較高的電導(dǎo)率,而離子的半徑和移動性也會影響其在溶液中的遷移速度。②溶解電解液的濃度:濃度的增加通常會導(dǎo)致離子間的相互作用增強,從而可能降低電導(dǎo)率,尤其是在高濃度下。③電解質(zhì)的電離度:電離度較高的電解質(zhì)會釋放更多的自由離子,從而增加電導(dǎo)率。④溶劑的性質(zhì):包括溶劑的粘度和電容率。粘度較低的溶劑允許離子更自由地移動,而高電容率的溶劑有助于離子的遷移。⑤溫度:溫度的升高會增加離子的運動速度,減少溶劑的粘度,從而提高電導(dǎo)率。
水的自電離是一個重要的化學(xué)現(xiàn)象,它對溶液的電導(dǎo)率有直接影響。在純凈的水中,即使沒有外部雜質(zhì),溶液仍然可以表現(xiàn)出一定的電導(dǎo)率。這是因為水分子自身可以發(fā)生電離,生成水合氫離子(H3O+)和氫氧根離子(OH-)。純水的電導(dǎo)率大約為0.055 μS/cm,這一數(shù)值雖然相對較低,但在進行精確測量時仍然需要考慮。水的自電離反應(yīng)是一個平衡過程,其中水分子的電離程度非常有限。在十億個水分子中,大約只有兩個分子會發(fā)生電離,生成離子。盡管自電離產(chǎn)生的離子數(shù)量很少,但它們對水的電導(dǎo)率有貢獻。因此,在評估純水或其他溶液的電導(dǎo)率時,需要考慮到這種自電離的影響,以確保測量結(jié)果的準確性。
電導(dǎo)率的測量原理:
電導(dǎo)率的測量是基于一個簡單的原理:通過測量溶液中電流的流動來確定其電導(dǎo)性,測定方法如下圖所示。
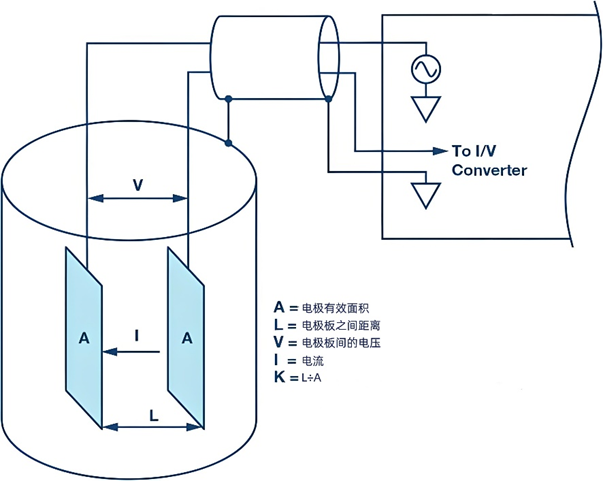
以下是測量電導(dǎo)率的步驟和涉及的關(guān)鍵概念:
測量裝置:使用兩個相互平行的電極(可以是平板或圓柱形),這些電極被放置在待測溶液中,并且它們之間的距離(L)是固定的。
施加電壓:為了避免電解溶液,通常在電極兩端施加一個正弦波電壓,頻率一般在1~3 kHz之間。
測量電導(dǎo):通過電導(dǎo)儀測量兩個電極之間的電導(dǎo)(G),即電流通過溶液的能力。
計算電導(dǎo)率:為了得到電導(dǎo)率σ= G×K,需要兩個關(guān)鍵參數(shù),即溶液的電導(dǎo)G和電極常數(shù)K。電導(dǎo)G可以通過測量電流和電壓得到。電極常數(shù)K可以通過公式K =L÷A計算得出,其中A是電極的有效面積,L是兩電極之間的距離。
電極常數(shù)的說明:當電極間存在均勻電場時,可以通過電極的幾何尺寸直接計算電極常數(shù)。例如,如果兩個面積各為1 cm2的方形電極相隔1 cm,那么電極常數(shù)K為1 cm?1。如果使用這對電極測得電導(dǎo)G為1000 μS,則溶液的電導(dǎo)率K為1000 μS/cm。在實際應(yīng)用中,電極間可能存在非均勻電場,這時電極常數(shù)(K)必須通過使用標準溶液來確定。常用的標準溶液是KCl溶液,因為它的電導(dǎo)率在不同溫度和濃度下都非常穩(wěn)定和準確。例如,0.1 mol/L的KCl溶液在25℃時的電導(dǎo)率為12.88 mS/cm。非均勻電場(也稱為雜散場或漏泄場)的特點是它沒有固定的常數(shù),而是依賴于離子的種類和濃度。因此,一個純雜散場電極是最復(fù)雜的,因為它不能通過單次校準來滿足廣泛的測量范圍需求。
-
電阻
+關(guān)注
關(guān)注
86文章
5507瀏覽量
171920 -
測量技術(shù)
+關(guān)注
關(guān)注
1文章
188瀏覽量
24703 -
電導(dǎo)率
+關(guān)注
關(guān)注
1文章
203瀏覽量
13920 -
電導(dǎo)率儀
+關(guān)注
關(guān)注
0文章
15瀏覽量
8446
原文標題:電導(dǎo)率儀,你真的了解么?(放入收藏夾)
文章出處:【微信號:深圳市賽姆烯金科技有限公司,微信公眾號:深圳市賽姆烯金科技有限公司】歡迎添加關(guān)注!文章轉(zhuǎn)載請注明出處。
發(fā)布評論請先 登錄
相關(guān)推薦
關(guān)于電導(dǎo)率的測量原理和什么叫量程電阻
什么是導(dǎo)電率?電磁流量計測量對液體電導(dǎo)率的
最近在做水質(zhì)儀 測溫度和TDS 電導(dǎo)率的 卡在溫度與電導(dǎo)率關(guān)系,電導(dǎo)率測量上
電導(dǎo)率儀的使用方法和電導(dǎo)率儀工作原理
電導(dǎo)率儀的使用方法和電導(dǎo)率儀工作原理
電導(dǎo)率計測量基本原理及應(yīng)用
電導(dǎo)率的測量原理
電導(dǎo)率儀的測量方法
電導(dǎo)率儀的概念、單位和測量原理的介紹
電導(dǎo)率的影響因素及測量方法
海水電導(dǎo)率儀的測量范圍與校準原理
什么海思電導(dǎo)率,電導(dǎo)率原理解析





 電導(dǎo)率的定義和測量原理
電導(dǎo)率的定義和測量原理










評論