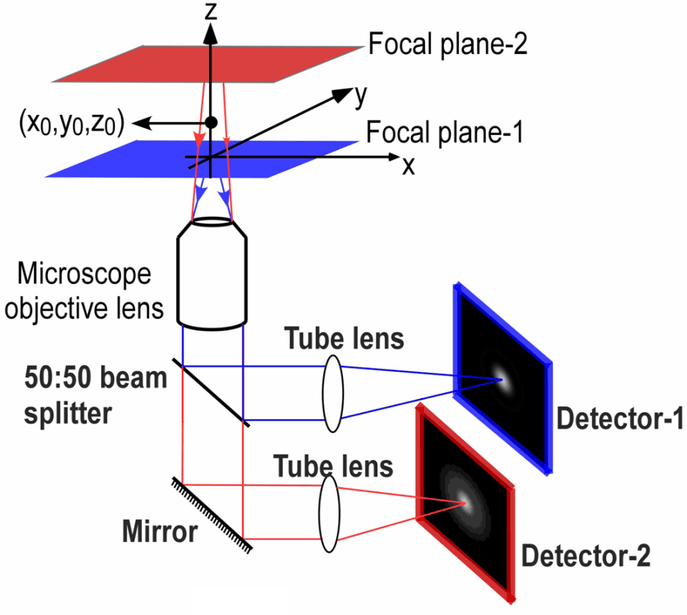
圖 1:使用分光器的多焦點平面顯微鏡。樣本中的兩個不同焦平面(一紅一藍)由50:50分光器分割。反射光(藍色)被發送到相機1,而透射光(紅色)被發送到相機2。通過這種方式,可以同時對兩個不同的焦平面進行成像。或者,可以使用發射圖像分離器通過一個檢測器對兩個焦平面進行成像。
介紹
分光器是一種將光(例如激光束)分成兩束(或多束)的光學裝置。分光器在顯微鏡中非常有用,因為它們可以充當顯微鏡和探測器/相機之間的接口,分離顯微鏡的發射光。
分光器有兩種主要類型:發射圖像分光器將光分到單個相機傳感器上,以便一臺相機可以同時對多個波長進行成像;多相機適配器將光分到多個相機上,從而允許一個樣品同時成像多個相機。這兩種分光器裝置本質上都允許在多個波長、偏振狀態或振幅下同時對樣品進行成像。有關分離器的介紹,請參閱我們的技術說明:“分離器簡介”。
本文將介紹如何使用此類分光器設備來增強顯微鏡技術和高級成像應用。為什么要使用分離器?
需要分離器的技術
分光器允許同時對不同狀態進行成像:無需手動或使用電子開關調整顯微鏡設置,而是可以無延遲地光學獲取兩種狀態。多焦平面顯微鏡 (MPM)是這對于成像應用有用的一個示例,如圖 1所示。 MPM 涉及同時對同一樣本的兩個不同焦平面進行成像,而不是手動調整焦點,然后在不同的所需焦平面處拍攝圖像。
如果對 2D 細胞培養物進行成像,一個焦平面通常就足夠了,因為大多數細胞制劑都不是很厚。但隨著越來越多的研究人員開始對更大的 3D 樣本進行成像,MPM 提供了一種有用的方法,可以在細胞在 3D 支架中相互作用或較大的生物體進行動態運動時對多個所需焦平面進行成像。對實時 3D 樣品進行成像時,高速是必要的,并且由于無需手動調整焦點,MPM 提供了一種高速選項,可同時對穿過樣品的多個 z 平面進行成像。 MPM 的實際應用示例如圖 2所示。
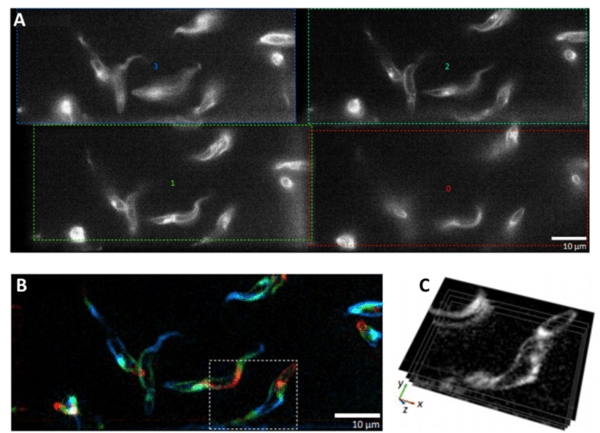
圖 2:高速 MPM 可視化活體游泳的布氏錐蟲寄生蟲。該實驗使用了四路發射圖像分離器 MultiSplit V2。A) 同一樣本的四個獨立圖像通道,每個圖像通道在不同的焦平面處拍攝。 B) 對四個獨立的焦平面進行著色、組合和過濾。每種顏色都來自不同的焦平面。 C) 四個焦平面相互關系的直接可視化。圖片改編自惠勒 (2019)。
如果沒有分光器,等待樣品移動到正確位置時可能會浪費時間,例如選擇性平面照明顯微鏡 (SPIM) 等光片技術中的掃描。掃描還會因相機快門而產生拖尾效應,并限制可用的曝光時間。通過同時捕捉多個興趣點,可以避免這些限制,從而可以捕捉 3D 空間中微小、微弱和快速移動的物體。如果沒有分光器,MPM 就不可能實現,并且展示了操縱樣品發射光的強大功能和靈活性。
另一種需要分光器的技術是同時 多探針熒光成像,涉及不同熒光探針的同時成像。絕大多數熒光顯微鏡使用多個熒光團,特別是在藍色通道通常被 DAPI(一種易于使用的細胞核標記物)占據的細胞上,為標記特定蛋白質的其他熒光團留下紅色和綠色通道。
顯微鏡通常有一個電子開關,以便這些不同的熒光團可以在不同的通道中成像,從而產生多通道圖像。切換時仍然存在時間延遲,并且使用分光器可以選擇同時對多個熒光波長進行成像,從而消除任何延遲。這在對活細胞進行熒光成像時特別有用,可以高速捕獲快速動態事件。除了結合熒光探針外,微分干涉對比 (DIC) 等明場圖像也可以與熒光圖像結合。
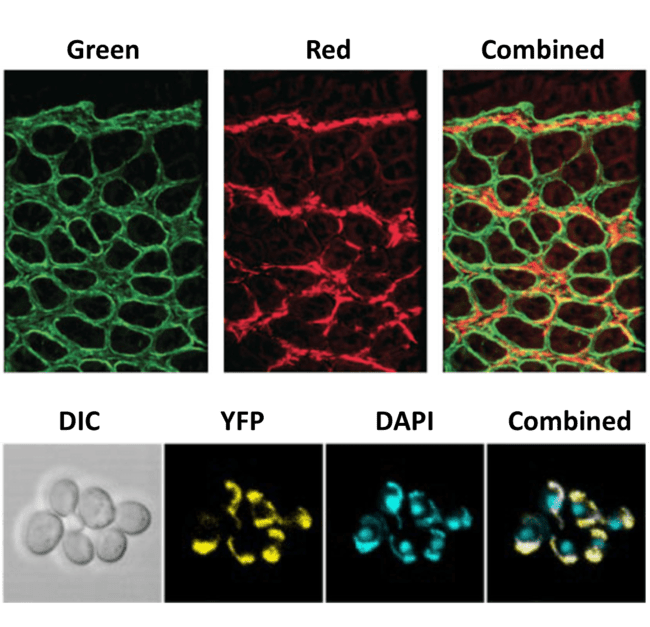
圖 3:多探針熒光成像。頂部圖像顯示兩個獨立的熒光通道(綠色和紅色),以及可以通過使用分光器同時成像來實現的組合圖像。該圖像可以通過后處理生成,但時間和信息可能會丟失。底部圖像分別顯示明場圖像 (DIC) 和兩個熒光標記物(黃色熒光蛋白 YFP 和 DAPI),以及三者的組合。
分離器增強的技術
有些技術本質上并不需要分離器來發揮作用,但它的包含使人受益匪淺。這主要是由于能夠同時對多個不同狀態進行成像,從而節省時間,并且根據技術的不同,其他優點也有所不同。值得注意的是,幾乎所有先進的顯微鏡應用都受益于分光器和更靈活的成像能力,因此這里提到的技術只是冰山一角,本文絕不是詳盡無遺的。
其中一項技術是福斯特共振能量轉移 (FRET),這是一種用于確定兩個熒光團彼此是否在一定距離內的技術。 FRET 利用熒光團分子之間的能量轉移原理:類似于兩個磁鐵只有在足夠靠近時才會吸引,兩個熒光團只有在彼此距離在1-10 nm 以內時才會交換能量。 FRET 中有兩種熒光分子:供體和受體,如果供體被激發并移動到足夠靠近受體,它將轉移能量。隨后供體熒光的減少和受體熒光的增加可以通過顯微鏡輕松檢測到。這本質上使 FRET 成為一種可以測量分子之間距離的“光譜尺”,因為只有當熒光團彼此之間的距離在 10 nm 以內時才會發生反應。
由于有兩個熒光團,用于激發它們的光應該具有不同的波長,否則,兩個熒光團將同時被激活并且不會發生FRET。這意味著需要兩個特定波長來處理兩種熒光團,并且能夠對兩種不同波長進行成像將使該技術更快、更有效,因為當熒光強度中一個波長減少而另一個波長增加時,會立即清楚。 FRET 是一種利用分離器的出色技術,如圖 4所示。
雖然圖 4中的所有三種方法在某些時候都使用分光器,但通過使用多相機適配器(圖 4C),可以同時對兩種熒光團進行成像,使該版本成為最快且很適合活細胞成像的版本。由于沒有移動部件,也沒有偽影,使用分離器設備的同步 FRET 增強了技術并允許更好的實驗,從而改善動態過程的成像。
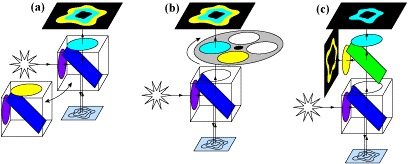
圖 4:不同的 FRET 變化。 A) 可以交換兩個不同的分光器立方體(每個波長一個)以對兩個 FRET 波長進行成像。該技術速度較慢,并且可能會引入偽影。 B) FRET 立方體,其中立方體與濾光輪配對,濾光輪選擇要分離的發射。這比交換立方體更快,并且更適合活細胞 FRET。C)使用多相機適配器的同步 FRET,其中可以通過將供體和受體分成兩個相機來同時測量它們的發射。此方法沒有移動部件并且同時發生,使其成為最快且無偽影的方法。
另一種受益于分光器的技術是全內反射熒光 (TIRF),該技術涉及從表面反射光以僅對樣品的一小部分進行成像。在 TIRF 中,激發激光的角度使其完全從玻璃樣品載玻片上反射。結果是所有激發光都被樣品反射走。然而,在光被反射的區域,一小部分光會擴散到樣品的一小部分中。這種光的延伸被稱為倏逝波,它通常只能穿透樣品約 100 nm,具體取決于顯微鏡光學器件。倏逝波與反射光的波長相同,因此它仍然會激發這個小區域內的任何熒光分子。
由于樣品的一小部分被照亮,與標準寬場熒光相比,離焦光少得多,信噪比也更好。由于 TIRF 僅限于單個焦平面(僅照亮約 100 nm 的樣品),因此它對于研究靠近表面的樣品區域(例如固定在蓋玻片或細胞膜表面上的分子)特別有用。
由于曝光時間短和單焦平面,TIRF 通常用于動態過程成像。為了使該技術更快并能夠對多個熒光團進行成像,分光器的使用取得了巨大成功,使 TIRF 更加強大。使用分離器,可以同時執行多通道 TIRF(如圖 5C所示),從而針對非常快速的事件優化該技術。
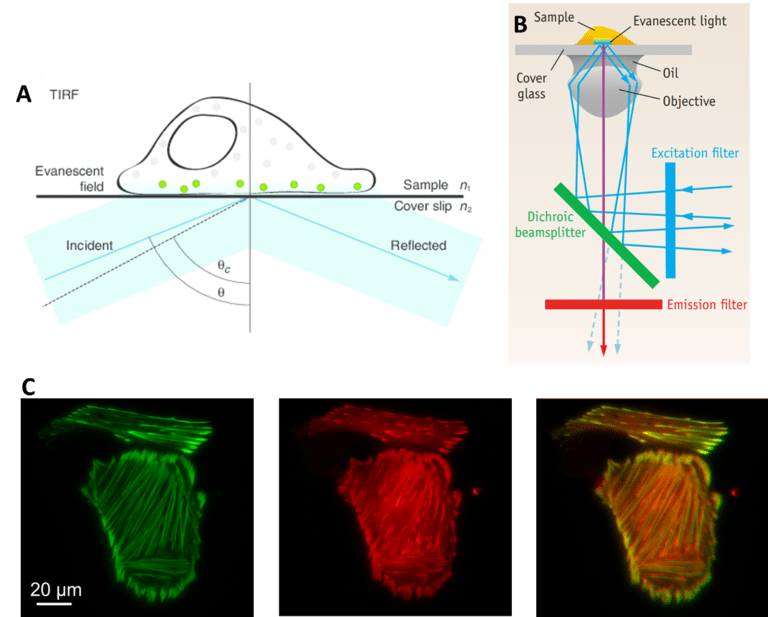
圖 5: TIRF。 A) 單細胞的 TIRF,蓋玻片反射光產生的漸逝場會激發最靠近蓋玻片的精選少數熒光分子(綠色)。 B) TIRF 光路。 C) 同時多通道 TIRF,別顯示綠色和紅色通道以及組合的同步圖像。
概括
分光器的使用既可以催生新技術,又可以增強現有技術,使分光器設備成為顯微鏡和相機之間強大的接口,提高研究人員控制光和設計更靈活和優雅實驗的能力。
審核編輯 黃宇
-
分離器
+關注
關注
1文章
82瀏覽量
14941
發布評論請先 登錄
相關推薦
LMH1980自動檢測標清/高清/PC視頻同步分離器數據表

TMUXHS4212雙通道差分2:1多路復用器或1:2多路信號分離器數據表

HD3SS3212-Q1雙通道差分2:1/1:2 USB3.2多路復用器/多路信號分離器數據表

TS5USBC400雙路2:1 USB 2.0多路復用器/多路信號分離器數據表

TS5USBC402雙路2:1 USB 2.0多路復用器/多路信號分離器或單端交叉開關數據表

TS3USB221高速USB 2.0(480Mbps)1:2多路復用器–多路信號分離器數據表

TS3USB221E高速USB 2.0(480Mbps)1:2多路復用器–多路信號分離器數據表

TMUXHS221 USB 2.0 480Mbps 2:1/1:2多路復用器/多路信號分離器開關數據表

TMUXHS4412 4通道20Gbps 2:1/1:2差分多路復用器/多路信號分離器數據表

HD3SS3202雙通道差動2:1/1:2 USB 3.1多路復用器/多路信號分離器數據表

TMUXHS221LV USB 2.0 480Mbps 2:1或1:2多路復用器或多路信號分離器開關數據表

武漢大學:研究微流控電化學集成傳感器,快速、高效分離和靈敏檢測致病菌




 為什么要使用分離器?
為什么要使用分離器?










評論