直到目前為止,還沒有一款完全理想的、適合于鋰電池的電解質。如今最常用的還是有機電解液,因為其具有高的離子電導率和較寬的溫度使用范圍。
鋰電池技術正在新能源的道路上飛速奔跑,現代社會對于鋰電池的比能量、安全性有了更加廣泛的關注。對于鋰電池而言,正負極材料、電解質的革新是提高其性能的根本源泉。
直到目前為止,還沒有一款完全理想的、適合于鋰電池的電解質。如今最常用的還是有機電解液,因為其具有高的離子電導率和較寬的溫度使用范圍。由于其本身容易著火,引發安全事故,所以新型電解質的開發勢在必行。開發新型電解質需要一套可靠的理論來支持,但是由于電解液涉及了較多的影響因素(例如粘度,鹽濃度,溶解,離子締合和離子-溶劑相互作用)對于離子的遷移機制還不甚清楚。那么,在有機電解液、固態電解質以及離子液體電解質中,鋰離子是如何遷移的呢?
一、有機電解液
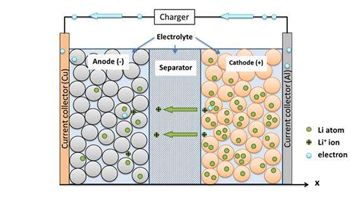
如圖1中所示,電解液在鋰電池內部起到一個載體作用,其在正負極材料之間為離子傳輸提供了傳輸路徑。簡單以充電過程舉例,Li+從正極活性物質中脫出,正極固相顆粒表面Li+濃度降低,使顆粒內部與表面間出現濃度差異,致使Li+產生顆粒由內向外的固相擴散。同時由顆粒表面電化學反應生成的Li+進入電解液中,溶液相中界面區域的局部濃度提高,使溶液相內部產生濃度差異,導致Li+產生從內向外的擴散與遷移。而在負極區域,由于負極顆粒與電解液中的Li+發生電化學反應,消耗了溶液相中的Li+,使溶液相局部Li+濃度降低,產生濃度差異,導致Li+在溶液相中產生由外向內的擴散與遷移。
同時在負極顆粒表面發生電化學反應,嵌入Li+,使顆粒內部出現濃度差異,導致Li+在顆粒內部產生從外向內的固相擴散。在隔膜處,由于正極與負極過程導致的濃度差異,導致該區域的Li+產生從正極到負極的擴散與遷移,放電過程則與上述過程相反。由上述過程可知,鋰電池的正常、高效運轉,主要決定于鋰離子在電池內部的遷移情況。鋰離子的遷移情況受到電解液的性質的制約,電解液的性質主要是由以下要素影響的。
1.鋰鹽溶解
電解液由溶質和溶劑組成,溶質一般選用LiPF6溶劑一般選用多種有機溶劑相組合的液體。當把LiPF6溶入溶劑中后,就形成了鋰離子和PF6?負離子。鋰鹽的溶解與溶劑的介電常數密切相關,介電常數越大對鋰鹽的溶解能力就越強。當鋰離子被溶劑分子完全包圍后,負離子對鋰離子的影響減弱,就發生了所謂的溶解。對于鋰鹽而言,陰離子越大越有利于電解液的離子導電性及其自身的溶解,這是因為陰離子越大,越容易分散其負電荷并能防止陽離子的配對。
2.電解液粘度
電解液的粘度會對離子的移動產生重要影響,粘度越低越有利于離子的移動。
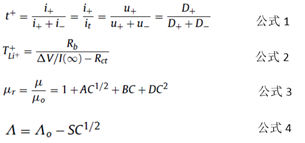
正如以上所述的,鋰離子在電極液的溶解作用和粘度影響下進行運輸和轉移。公式1中t+為運輸數目,i+和i-分別代表陽離子和陰離子所形成的電流,it代表總電流,u±代表陰陽離子的移動性,D±代表陰陽離子的擴散系數。
實際上,離子阻力不僅跟陰陽離子有關,也跟溶劑有一定關系。離子遷移數目可以用以公式2來表示:
其中,TLi++代表鋰離子遷移數目,△V是極化電壓,I(∞)是極化后的穩態電流,Rb和Rct是體電阻和充電轉移電阻。
單相溶劑系統的電解液很難既有高的電導率又有低的粘度,因此常用的電解液溶劑采用多種溶劑復配的方式來配制,比如二元的電解液我們是這樣配制的m(鋰鹽)+(1-w)(溶劑A)+w(溶劑B),鋰鹽m單位一般是質量摩爾濃度,mol/kg,w是溶劑的質量分數。對于單元電解液,并沒有可靠的理論來預測電解液的粘度和離子電導率。Jones–Dole (JD)和Debye–Hückel–Onsager (DHO)曾經提出過兩個經驗公式分別是公式3和公式4:
其中,μr是相對粘度,μ是溶液粘度,μ0是純溶劑粘度,C是鋰鹽濃度,A、B、D是系數,Λ是摩爾電導率,Λ0是在無限稀釋狀態下的摩爾電導率,S是受溶劑物理性質和電解質性質影響的參數,C是溶質濃度。如果鋰鹽和溶劑的種類變化之后,經驗公式也需要進行修改。對于混合體系電解液來說,公式會更加復雜。
所以,當配置新的多元復配電解液時,電解液的性能需要試驗來測定,而無法進行預先估測。雖然離子電導率對于電池性能影響很大,但是其它因素例如SEI的形成和性能也是非常關鍵的因素,電解液在高倍率下的穩定性、毒性等也應該考慮到。總之,一切與實際生產應用有關的因素都要考慮,然后才考慮離子電導率參數。
二、固態電解質
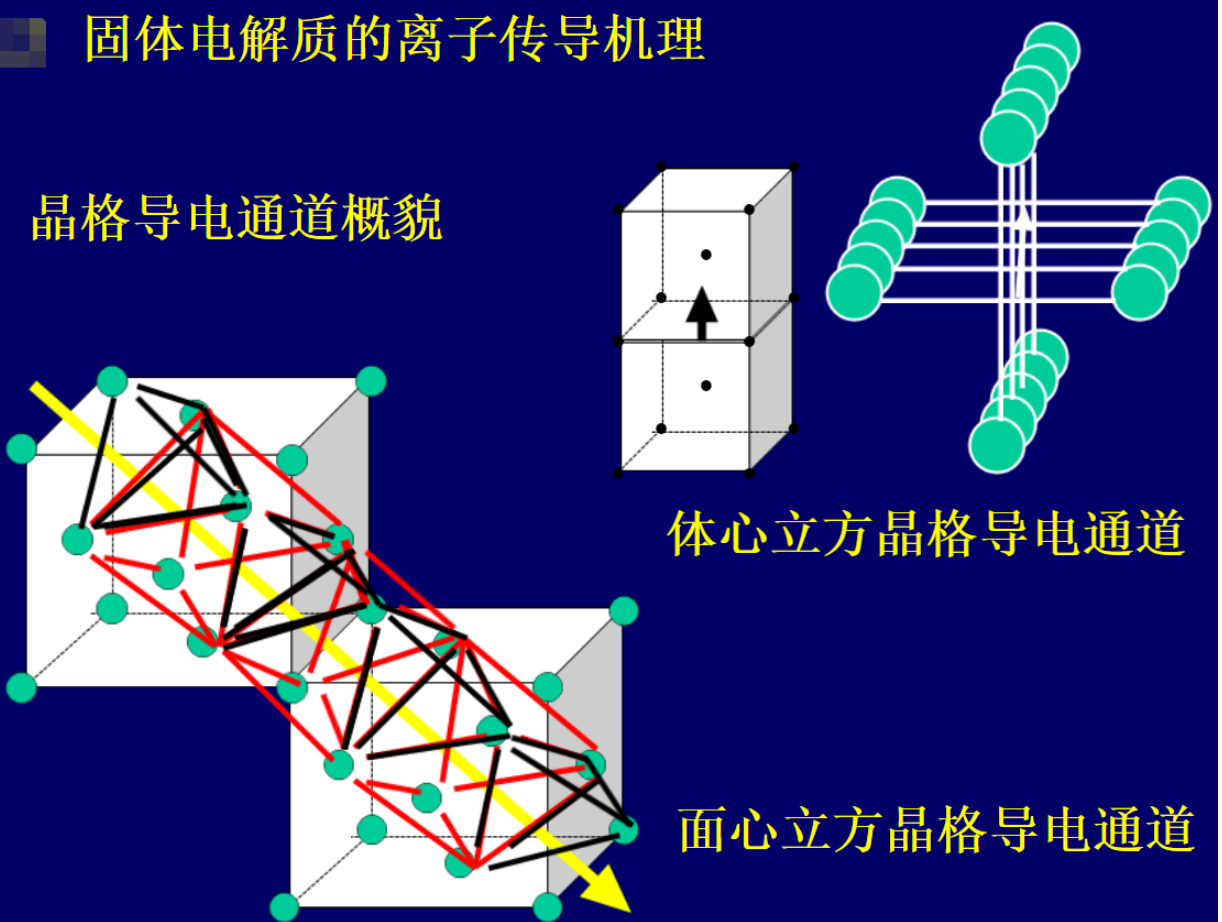
固態電解質與液體有機電解液相比用于鋰電池后具有更大的優勢,例如設計簡單、封裝方便、抗沖擊抗震動性能好、耐溫度和壓力性能好、電化學穩定性和范圍廣、安全性好等。然而,固態電解質的離子導電性相對還較受限制。一般來說,固態電解質可以分為凝膠型聚合物、無溶劑聚合物、無機晶體化合物、無機玻璃態物質等。在無機晶體化合物內部,鋰離子的傳導是因為移動離子在周圍電位的能量有利位點之間跳躍形成的,周圍離子的運動為移動離子提供激活能量以促使其通過晶體結構中的通道。
聚合物電解質的離子傳輸機制與無機晶體化合物和液態電解液的傳輸機制不同。在無溶劑的聚合物電解質中,離子遷移率受聚合物主體材料運動的影響。離子僅在聚合物鏈段經歷與玻璃化轉變溫度(Tg)有關的相當大振幅運動時才移動。聚合物電解質在高于玻璃轉變溫度Tg時才表現出快的離子電導率,此時聚合物電解質主要由非晶相構成。因此,低玻璃轉變溫度Tg的聚合物如PEO( Tg-50至-57℃)已成為無溶劑電解質的重要聚合物主體,并且正在研究該聚合物的非晶化作為增加其離子電導率的方式。由于低分子量溶劑在聚合物中的擴散以及聚合物鏈段的運動,凝膠型聚合物電解質表現出比無溶劑電解質更快的離子傳導。
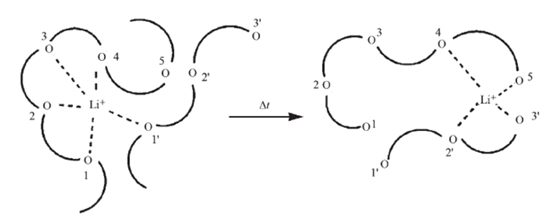
以PEO為例,該類聚合物的電解質傳輸機制如上圖所示,通電以后,聚合物中非晶部分的鏈段運動導致Li+的“解絡合—再絡合”過程的反復進行而促使離子實現快速遷移。
在半導體工業中開發的基于薄膜技術的固體電解質已經作為固態微電池的關鍵組件被深入研究。由于合成時間長和制造過程中的高溫條件需求,為微電池開發的大多數晶態和玻璃態電解質的成本太高。除了這些缺點之外,用于固態電解質的無機材料通常含有昂貴的金屬,如Ge,Ti,Sc,In,Lu,La和Y等。由于放大和應用大多數固態電解質時遇到的困難,僅凝膠型聚合物電解質在商業上取得成功。
三、離子液體電解質
另一類被認為是電解質的材料是離子液體。離子液體的定義目前尚不明確,一般認為它是完全由陽離子和陰離子組成的液體,在室溫或室溫附近呈現為液態的有機鹽類。離子液體具有獨特的性質,包括不可燃性,低蒸氣壓,高熱穩定性,良好的電化學穩定性,低毒性和高離子含量等。
通常,將離子液體分為AlCl3型離子液體、非AlCl3型離子液體和特殊離子液體三類。各種離子液體的理化性質都可以在相關文獻中找到。總體而言,離子液體的粘度比液態電解質高一至兩個數量級,因此離子電導率比液體電解質的離子電導率低三至四個數量級。華登定律通常用于離子液體的電導率和粘度之間的關系,表達如下:
λi是離子種類i的離子電導率,μ是粘度。
因為粘度很大程度上取決于這些影響因素之間的相互作用,例如范德華相互作用,構象自由度,庫侖力和離子形狀等,科研人員在研究離子液體中離子物質之間的相互作用上已經付出了很多努力。除了低離子電導率之外,離子液體電解質的應用也不太可能在碳負極材料上形成SEI層,導致循環中的Li離子耗盡。所以,在許多情況下,離子液體需要輔助添加劑以用來作電解質。
-
鋰離子
+關注
關注
5文章
537瀏覽量
37608 -
電解質
+關注
關注
6文章
810瀏覽量
20049 -
電極材料
+關注
關注
0文章
84瀏覽量
6583
原文標題:【蘇達匯誠·透視】三種電解質體系中鋰離子的遷移機理
文章出處:【微信號:gh_a6b91417f850,微信公眾號:高工鋰電技術與應用】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦




 鋰離子在有機電解液、固態電解質以及離子液體電解質中是如何遷移的?
鋰離子在有機電解液、固態電解質以及離子液體電解質中是如何遷移的?











評論