一場風靡全球的“冰桶挑戰(zhàn)”曾將“漸凍癥”(肌萎縮側索硬化,ALS)帶入眾人的視線。當神經(jīng)細胞逐漸失去對肌肉的控制,患者全身肌肉會逐漸萎縮,吞咽困難,最后呼吸衰竭。
“漸凍人”發(fā)病后平均壽命僅有2到4年,像霍金那樣長期與病魔搏斗的患者可謂奇跡。不幸的是,人類迄今未找到ALS的病因,遑論給出對癥之藥。
美國麻省理工學院(MIT)的一個團隊10月11日在《科學進展》上報告了一種在微流控芯片上制作神經(jīng)和肌肉組織的3D模型的方法。借助這種“芯片器官”,他們觀察到健康神經(jīng)元與“漸凍”神經(jīng)元的驚人差異,并試驗了兩款仍在臨床測試階段的新藥。
僅有少部分“漸凍癥”與遺傳缺陷相關,而90%的散發(fā)性案例發(fā)病原因仍是未解之謎。正因如此,極少數(shù)獲美國食品藥品監(jiān)督管理局(FDA)批準上市的“抗凍”藥品都并非完全對癥。科學家們繼續(xù)突破動物模型的限制,找到分析病理和臨床試驗的更優(yōu)方法。
冰桶挑戰(zhàn)
其中,運動神經(jīng)元和肌肉細胞之間的連接處,即肌肉神經(jīng)接頭,是模擬“漸凍癥”的關鍵。數(shù)十年來,科學家們受限于2D模型結構。
2016年,MIT機械和生物工程教授羅杰·卡姆(Roger Kamm)團隊用微流控芯片技術首次做出了鼠類肌肉神經(jīng)接頭的3D模型。這是一種在微米尺度的芯片中模擬人體環(huán)境,集成基本操作單元,自動完成分析全過程的技術。
他們將神經(jīng)元和肌肉纖維分置于芯片上相鄰的兩個隔室內。神經(jīng)元會逐漸延展出常常的神經(jīng)突,最終與繞在兩個柔性柱子上的肌肉纖維連接。
這些神經(jīng)元用光遺傳技術編輯過,能在光照控制下刺激肌肉收縮。通過觀察兩個柔性柱子的位移情況,研究人員就能測量肌肉收縮的力度。
在此次發(fā)表的成果中,卡姆團隊用人類神經(jīng)元與肌肉細胞進行代替。這些神經(jīng)元一部分由健康人群的誘導性多能干細胞(iPSCs)分化而來,一部分由散發(fā)性ALS患者的誘導性多能干細胞分化而來。
實驗結果顯示,“漸凍癥”組的神經(jīng)元生長神經(jīng)突的速度更慢,也無法與肌肉纖維建立強有力的連接。此外,神經(jīng)元退化和肌肉細胞死亡的數(shù)量也更多。
“我們可以看到,健康的神經(jīng)元直撲肌小管而去,并激活了它們。然而,ALS神經(jīng)元似乎無法很好地建立連接。”卡姆說道。
“芯片器官”:綠色部分為漸凍癥患者誘導性多能干細胞分化而成的運動神經(jīng)元,紫色部分為肌肉組織。
兩周之后,ALS運動神經(jīng)元對肌肉建立起的控制力,僅有健康神經(jīng)元的四分之一。
展示“芯片器官”能有效模擬“漸凍癥”之后,卡姆團隊開始探索這個模型的試藥能力。
他們選擇了兩款仍處于臨床測試階段的新藥雷帕霉素(Rapaycin)和伯舒替尼(Bosutinib)。在“芯片器官”上模擬的結果顯示,兩款藥物都能幫助肌肉在運動神經(jīng)元的刺激下收縮,并提高神經(jīng)元的存活率。更重要的是,兩款藥物各自穿透血-腦屏障(毛細血管壁與神經(jīng)膠質細胞形成的血漿與腦細胞之間的屏障)的能力有限,但同時施用時均能有效地穿透屏障。
目前,卡姆團隊正在與當?shù)氐纳锛夹g企業(yè)合作,計劃收集1000名“漸凍人”的誘導性多能干細胞,在“芯片器官”上進行大規(guī)模藥物試驗。
他們也打算對模型本身進行升級,使其一方面能同時容納更多的測樣,另一方面能支持在神經(jīng)系統(tǒng)中的其他細胞類型,比如雪旺細胞和小膠質細胞。
-
芯片
+關注
關注
456文章
50886瀏覽量
424175 -
3D模型
+關注
關注
1文章
72瀏覽量
15735
原文標題:MIT團隊在微芯片上模擬神經(jīng)元和肌肉
文章出處:【微信號:eetop-1,微信公眾號:EETOP】歡迎添加關注!文章轉載請注明出處。
發(fā)布評論請先 登錄
相關推薦
神經(jīng)元芯片的主要特點和優(yōu)勢
神經(jīng)元是什么?神經(jīng)元在神經(jīng)系統(tǒng)中的作用
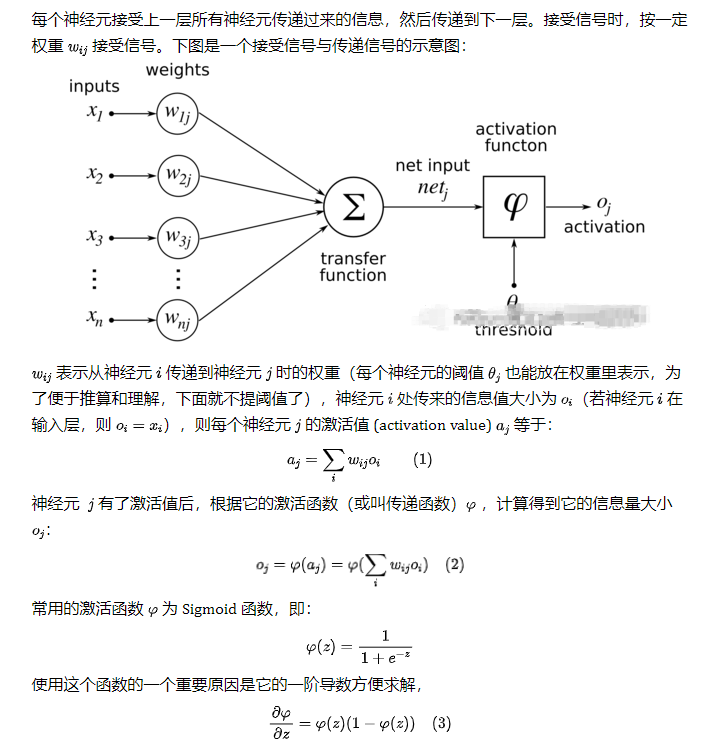




 MIT團隊在微芯片上模擬神經(jīng)元和肌肉 積極尋找漸凍癥治療的方法
MIT團隊在微芯片上模擬神經(jīng)元和肌肉 積極尋找漸凍癥治療的方法










評論