肝臟芯片(liver-on-a-chip)細胞培養裝置是藥物發現、毒理研究和組織工程研究中的有吸引力的仿生模型。為了在實驗室芯片上維持特定的肝細胞功能,必須具備充足的細胞類型和培養條件,包括三維細胞定位和持續的營養物和氧氣供應。與傳統的二維細胞培養技術相比,器官芯片(organ-on-a-chip)裝置提供了多功能性和有效的仿生技術,適用于藥物發現和醫學上的高級應用。
在一項新的發表在Biofabrication期刊上的研究中,Jonas Christoffersson及其同事們證實了模仿胞外基質的水凝膠如何支持灌注肝臟芯片裝置中的肝細胞功能和活力。這些研究人員設計了一種基于透明質酸和聚(乙二醇)(HA-PEG)聚合物的水凝膠系統。他們利用點擊化學開發出這種水凝膠。為了做到這一點,他們讓環辛炔部分和炔烴疊氮化物標記的反應物之間發生雙正交反應(在生命系統內發生的化學反應,沒有天然生物化學反應的干擾),即應變促進的炔烴疊氮化物環加成(strain-promoted alkyne azide cycloaddition, SPAAC)。
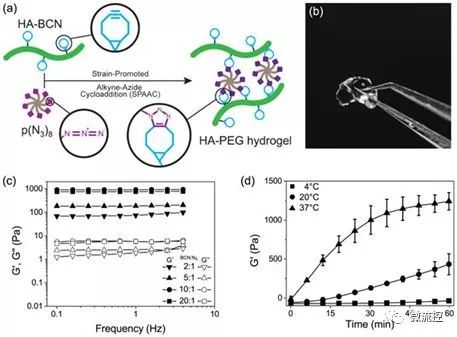
圖片來自Biofabrication, doi:10.1088/1758-5090/aaf657
通過與現有的瓊脂糖和藻酸鹽水凝膠相比較,這些研究人員在細胞相容性(cytocompatibility)方面設計并表征了這種新型凝膠材料。對于生物功能化研究,他們使用了源自人誘導性多能干細胞的肝細胞(hiPSC-HEP)。為了改善這種生物材料的表面細胞相容性,利用疊氮化物修飾的細胞粘附基序改變HA-PEG水凝膠,從而促進有效的細胞-材料附著。在這種表面功能化的生物材料中,這些產生肝細胞的人誘導性多能干細胞(hiPSC)在三維空間中遷移和生長,并且具有增加的活力。與在其他水凝膠上培養的細胞相比,他們觀察到在這種新材料上的白蛋白(一種特征性的肝臟蛋白)產量更高。這種靈活的對hipsC-HEP進行灌注三維細胞培養的SPAAC交聯水凝膠系統是優化肝臟芯片裝置的有前途的材料。
稱為“器官芯片”的小型化生物反應器最近已成為一種替代性的細胞培養模型,可更好地模擬實驗室中的體內生物微環境。鑒于在臨床藥物開發的所有階段觀察到藥物肝毒性,肝臟是醫學研究中的一種特別令人感興趣的模型。之前的研究已詳細介紹了使用器官芯片來預測藥物在臨床試驗中的影響,并評估實驗室中藥物與肝細胞之間的相互作用。
鑒于生物反應器在學術和工業環境中的廣泛應用,它們需要優化的材料和條件以便實現高通量制造。這些條件包括替換常見的原型材料聚二甲基硅氧烷(PDMS),將源自hipsC的細胞整合到柔軟的生物材料上來促進它們的生長,并最大限度地減少由器官芯片裝置中的微流體容器和管道系統引起的較大死區體積。
這項研究中制備的新型生物材料含有兩種通過SPAAC交聯在一起的主要成分:cycloocytne修飾的透明質酸(cycloocytne-modified hyaluronan, HA-BCN)和多臂疊氮化物修飾的PEG [p(N3)8]。HA-BCN中的BCN與末端為疊氮化物(N3)部分的8臂PEG聚合物上的N3發生反應,從而形成穩定的1,2,3-三唑類化合物。Christoffersson等人在生理條件下完成化學反應,這就形成粘彈性可調整的水凝膠。這種交聯策略是制備用于三維細胞培養的水凝膠的理想選擇,這是因為細胞能夠被包埋在這種生物材料中而不會破壞它們的活力并且適合用于微流體裝置中。他們在這種新型生物材料上使用了過量的SPAAC部分來連接不同的配體,包括促進在細胞-材料界面相互作用的RGD肽。
在此之后,這些研究人員通過振蕩流變學技術(oscillatory rheology, 測量軟材料的粘彈性行為的技術)來改變這兩種主要成分的組成,以便了解所產生的粘彈性,比如這種水凝膠的儲能模量(storage modulus, G')和損耗模量(loss modulus, G")。他們在升高的溫度下控制了這種新型水凝膠的凝膠化動力學。這種新型生物材料的凝膠化動力學對細胞均勻分布來說足夠慢,但對防止細胞沉降來說足夠快。控制凝膠化動力學的能力讓他們能夠考慮微流體系統中用于器官芯片上的多種生物制造策略(比如生物打印)和水凝膠組裝。
Christoffersson等人接下來將HA-PEG水凝膠與成熟的三維細胞培養支架---瓊脂糖和藻酸鹽水凝膠---進行比較。為了確定適合于三維細胞培養實驗的最終粘彈性,他們使用振蕩流變學技術來研究不同的聚合物濃度。他們通過使用掃描電子顯微鏡(SEM)圖像分析了最終材料的組成。
肝臟芯片設計和設置必須滿足這項研究中的兩個關鍵標準:(1)允許灌注的細胞培養基通過這種水凝膠的表面,以便與包封的肝細胞進行穩定的營養培養基交換;(2)在正在進行的細胞培養期間,允許對灌注的細胞培養基進行取樣用于實驗分析,同時又不影響肝細胞和這種水凝膠。
為了滿足這些標準,這些研究人員使用了一種商業化的三維細胞培養裝置(μ-Slide III 3D Perfusion IbiTreat),它包含兩個連續的腔室(2 x 30 μL)---每個腔室連接到培養基容器以便灌注液體。為了有效灌注,他們通過在含有這種水凝膠的腔室內反轉灌注液流動方向將這種三維細胞培養裝置安裝在自動搖床上。這種實驗設置允許灌注的培養基通過這種三維細胞培養裝置,這就滿足了第一個標準。為了滿足第二個標準,與這些水凝膠腔室相鄰的局部壁允許他們在不干擾水凝膠或細胞成分的情況下對灌注液進行取樣。
在細胞培養3天、7天和9天后,這些研究人員首先用這種水凝膠包埋的HEPG2細胞(一種肝癌細胞系)來研究肝臟芯片裝置的生物功能化。他們將這種水凝膠包埋的HEPG2細胞形態、活力和功能與瓊脂糖和藻酸鹽水凝膠進行了比較。這項研究包括活/死細胞測定以確認細胞活力,并通過檢測細胞培養物上清液中的白蛋白和尿素分泌來進一步證實HepG2功能。
為了改善細胞的功能性(在材料表面上的附著力和遷移性),這些研究人員將細胞粘附基序---比如線性或環狀RGD肽(線性linRGD或環狀cRGD)---移植到這種水凝膠上。在這種情況下,將hipsC-HEP細胞(肝細胞干細胞)在不同的水凝膠組合物中培養13天,以研究細胞-材料相互作用后的形態和活力(活/死細胞染色)。他們在實驗中使用了六種不同的基于水凝膠的生物材料表面,包括:二維生物材料表面(HEP涂層),瓊脂糖,藻酸鹽,HA-PEG,HA-PEG(linRGD)和HA-PEG(cRGD)。
在這種修飾的水凝膠中包埋和培養的hiPS-HEP細胞在二維構建體和真正的三維構建體內生長。為了測試這些體外培養的hiPS-HEP細胞的功能,這些研究人員定量確定了它們的白蛋白和尿素分泌。結果顯示僅在二維HEP涂層上和在cRGD基序水凝膠存在下培養的hips-HEP上清液分泌白蛋白。
基于這些研究結果,這些研究人員將二維HEP涂層上較高的白蛋白數量歸因于這種水凝膠中的白蛋白擴散速率;在二維HEP涂層上的擴散速度比三維構建體中的快。在結合著cRGD基序的水凝膠中較高濃度的白蛋白與這種在結合著cRGD的生物材料表面上觀察到的細胞生長和活力增加相關聯。因此,他們打算使用cRGD肽來協助hips-HEP在未來用于肝臟芯片裝置的水凝膠上的培養。
通過這種方式,這項研究詳細說明了在肝臟芯片裝置中使用基于透明質酸-PEG的經過RGD肽修飾的水凝膠進行肝細胞三維培養(將近13天)的優點。作為這項研究的基準,Christofferfsson及其同事們使用了常用的藻酸鹽和瓊脂糖水凝膠。在未來,他們將優化這種HA-PEG水凝膠系統的粘彈性和細胞粘附基序的濃度,以便實現仿生細胞相容性。這種優化的水凝膠系統可與這種肝臟芯片裝置相結合,從而有助于開發出生理上重要的肝臟芯片平臺,用于藥物毒理學、藥物發現和再生醫學方面的臨床研究。
-
芯片
+關注
關注
456文章
50967瀏覽量
424874 -
反應器
+關注
關注
2文章
98瀏覽量
11082 -
微流體
+關注
關注
0文章
34瀏覽量
8564
原文標題:在肝臟芯片上進行肝細胞三維培養取得重大進展
文章出處:【微信號:Micro-Fluidics,微信公眾號:微流控】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
三維設計應用案例
基于STM32的三維旋轉顯示平臺設計(立體成像)!!!
安徽三維動畫制作和二維動畫有哪些區別呢?(一)
MHL聯盟發布在移動設備和消費電子連接領域取得重大進展的新規范
華芯通第一代服務器芯片研發取得重大進展 預計下半年正式投入市場
光纖激光器市場前景廣闊,有望在傳感和醫療領域取得重大進展




 在肝臟芯片上進行肝細胞三維培養取得重大進展
在肝臟芯片上進行肝細胞三維培養取得重大進展










評論