甲烷燃料電池是化學電池中的氧化還原電池。燃料電池是燃料和氧化劑(一般是氧氣)在電極附近參與原電池反應的化學電源。
甲烷(CH4)燃料電池就是用沼氣(主要成分為CH4)作為燃料的電池,與氧化劑O2反應生成CO2和H2O.反應中得失電子就可產生電流從而發電。美國科學家設計出以甲烷等碳氫化合物為燃料的新型電池,其成本大大低于以氫為燃料的傳統燃料電池。燃料電池使用氣體燃料和氧氣直接反應產生電能,其效率高、污染低,是一種很有前途的能源利用方式。但傳統燃料電池使用氫為燃料,而氫既不易制取又難以儲存,導致燃料電池成本居高不下。
科研人員曾嘗試用便宜的碳氫化合物為燃料,但化學反應產生的殘渣很容易積聚在鎳制的電池正極上,導致斷路。美國科學家使用銅和陶瓷的混合物制造電池正極,解決了殘渣積聚問題。這種新電池能使用甲烷、乙烷、甲苯、丁烯、丁烷等5種物質作為燃料。

酸性和堿性的各是什么?
一、因為燃料電池正極反應物一律是氧氣,正極都是氧化劑氧氣得到電子的還原反應,所以可先寫出正極反應式,正極反應的本質都是O2得電子生成O2-離子,故正極反應式的基礎都是O2+4e-=2O2-。正極產生O2-離子的存在形式與燃料電池的電解質的狀態和電解質溶液的酸堿性有著密切的關系。 ⑴電解質為酸性電解質溶液(如稀硫酸)在酸性環境中,O2-離子不能單獨存在,可供O2-離子結合的微粒有H+離子和H2O,O2-離子優先結合H+離子生成H2O。這樣,在酸性電解質溶液中,正極反應式為O2+4H++4e-=2H2O。
⑵電解質為中性或堿性電解質溶液(如氯化鈉溶液或氫氧化鈉溶液)
在中性或堿性環境中,O2-離子也不能單獨存在,O2-離子只能結合H2O生成OH-離子,故在中性或堿性電解質溶液中,正極反應式為O2+2H2O +4e-=4OH-。
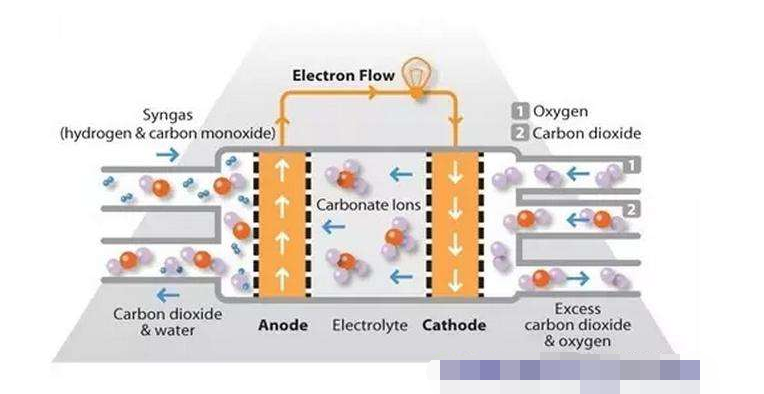
⑶電解質為熔融的碳酸鹽(如LiCO3和Na2CO3熔融鹽混和物)
在熔融的碳酸鹽環境中,O2-離子也不能單獨存在, O2-離子可結合CO2生成CO32-離子,則其正極反應式為O2+2CO2 +4e-=2CO32-。
⑷電解質為固體電解質(如固體氧化鋯—氧化釔)
該固體電解質在高溫下可允許O2-離子在其間通過,故其正極反應式應為O2+4e-=2O2-。
二、兩個電極上的反應是兩個半反應,如果單看一個電極的話,反應的電子是不守恒的。為了更好地表現出每個電極的反應狀況,分開寫更合適。
原電池,是利用兩個電極之間金屬性的不同,產生電勢差,從而使電子的流動,產生電流。又稱非蓄電池,是電化電池的一種,其電化反應不同逆轉,即是只能將化學能轉換為電能,簡單說就即是不能重新儲存電力,與蓄電池相對。
將化學能轉變成電能的裝置。所以,根據定義,普通的干電池、燃料電池都可以稱為原電池。組成原電池的基本條件是:將兩種活潑性不同的金屬(或石墨)(Pt和石墨為惰性電極,即本身不會得失電子)用導線連接后插入電解質溶液中。電流的產生是由于氧化反應和還原反應分別在兩個電極上進行的結果。一般情況下,原電池中,較活潑的金屬做負極,較不活潑的金屬做正極。負極本身易失電子發生氧化反應,電子沿導線流向正極,正極上一般為電解質溶液中的陽離子得電子發生還原反應。在原電池中,外電路為電子導電,電解質溶液中為離子導電。
原電池primary battery 一種將活性物質中化學能通過氧化還原反應直接轉換成電能輸出的裝置。又稱化學電池。由于各種型號的原電池氧化還原反應的可逆性很差,放完電后,不能重復使用,故又稱一次電池。它通常由正電極、負電極、電解質、隔離物和殼體構成,可制成各種形狀和不同尺寸,使用方便。廣泛用于工農業、國防工業和通信、照明、醫療等部門,并成為日常生活中收音機、錄音機、照相機、計算器、電子表、玩具、助聽器等常用電器的電源。原電池一般按負極活性物質(如鋅、鎘、鎂、鋰等)和正極活性物質(如錳、汞、二氧化硫、氟化碳等)分為鋅錳電池、鋅空氣電池、鋅銀電池、鋅汞電池、鎂錳電池、鋰氟化碳電池、鋰二氧化硫電池等。鋅錳電池產量最大,常按電解質分為氯化銨型和氯化鋅型,并按其隔離層分為糊式電池和低極電池。以氫氧化鉀為電解質的鋅錳電池,由于其負極(鋅)的構造與其他鋅錳電池不同而習慣上另作一類,稱為堿性鋅錳電池,簡稱堿錳電池[1],俗稱堿性電池。
原電池是一類使化學能直接轉換成電能的換能裝置。原電池連續放電或間歇放電后不能以反向電流充電的方法使兩電極的活性物質回復到初始狀態,即電極活性物質只能利用一次。故亦稱一次性電池。 [編輯本段]常見的原電池 常用原電池有鋅-錳干電池、鋅-汞電池、鋅-銀扣式電池及鋰電池等。
1 鋅-錳干電池:鋅-錳電池具有原材料來源豐富、工藝簡單,價格便宜、使用方便等優點,成為人們使用最多、最廣泛的電池品種。鋅-錳電池以鋅為負極,以二氧化錳為正極。按照基本結構,鋅-錳電池可制成圓筒形、扣式和扁形,扁形電池不能單個使用,可組合疊層電池(組)。按照所用電解液的差別將鋅-錳電池分為三個類型:
(1)銨型鋅-錳電池:電解質以氯化銨為主,含少量氯化鋅。
電池符號:(-)Zn│NH4Cl·ZnCl2│MnO2(+)
總電池反應: Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnO(OH)
(2) 鋅型鋅-錳電池:又稱高功率鋅-錳電池,電解質為氯化鋅,具有防漏性能好,能大功率放電及能量密度較高等優點,是鋅-錳電池的第二代產品,20世紀70年代初首先由德國推出。與銨型電池相比鋅型電池長時間放電不產生水,因此電池不易漏液。
電池符號:(-)Zn│ZnCl2│MnO2(+)
總電池反應(長時間放電):
Zn+2Zn(OH)Cl+6MnO(OH)=ZnCl2·2ZnO·4H2O+2Mn3O4
(3) 堿性鋅-錳電池:這是鋅-錳電池的第三代產品,具有大功率放電性能好、能量密度高和低溫性能好等優點。
電池符號:(-)Zn│KOH│MnO2(+)
總電池反應: Zn+2H2O+2MnO2=2MnO(OH)+Zn(OH)2
鋅-錳電池額定開路電壓為1.5V,實際開路電壓1.5-1.8V ,其工作電壓與放電負荷有關,負荷越重或放電電阻越小,閉路電壓越低。用于手電筒照明時,典型終止電壓為0.9V,某些收音機允許電壓降至0.75V。
2.鋰原電池:又稱鋰電池,是以金屬鋰為負極的電池總稱。鋰的電極電勢最負相對分子質量最小,導電性良好,可制成一系列貯存壽命長,工作溫度范圍寬的高能電池。根據電解液和正極物質的物理狀態,鋰電池有三種不同的類型,即:固體正極—有機電解質電池、液體正極—液體電解質電池、固體正極—固體電解質電池。Li—(CF)n的開路電壓為3.3V,比能量為480W·h·L-1,工作溫度在-55~70℃間,在20℃下可貯存10年之久!它們都是近年來研制的新產品,目前主要用于軍事、空間技術等特殊領域,在心臟起搏器等微、小功率場合也有應用。 吸氧腐蝕 金屬在酸性很弱或中性溶液里,空氣里的氧氣溶解于金屬表面水膜中而發生的電化腐蝕,叫吸氧腐蝕.
例如鋼鐵在接近中性的潮濕的空氣中腐蝕屬于吸氧腐蝕,其電極反應如下:
負極(Fe):Fe - 2e = Fe2+
正極(C):2H2O + O2 + 4e = 4OH-
鋼鐵等金屬的電化腐蝕主要是吸氧腐蝕.析氫腐蝕 在酸性較強的溶液中發生電化腐蝕時放出氫氣,這種腐蝕叫做析氫腐蝕。在鋼鐵制品中一般都含有碳。在潮濕空氣中,鋼鐵表面會吸附水汽而形成一層薄薄的水膜。水膜中溶有二氧化碳后就變成一種電解質溶液,使水里的H+增多。是就構成無數個以鐵為負極、碳為正極、酸性水膜為電解質溶液的微小原電池。這些原電池里發生的氧化還原反應是:
負極(鐵):鐵被氧化Fe-2e=Fe2+;
正極(碳):溶液中的H+被還原2H++2e=H2↑
這樣就形成無數的微小原電池。最后氫氣在碳的表面放出,鐵被腐蝕,所以叫析氫腐蝕。
析氫腐蝕定義金屬在酸性較強的溶液中發生電化腐蝕時放出氫氣,這種腐蝕叫做析氫腐蝕。原電池的形成條件 原電池的工作原理原電池反應屬于放熱的氧化還原反應,但區別于一般的氧化還原反應的是,電子轉移不是通過氧化劑和還原劑之間的有效碰撞完成的,而是還原劑在負極上失電子發生氧化反應,電子通過外電路輸送到正極上,氧化劑在正極上得電子發生還原反應,從而完成還原劑和氧化劑之間電子的轉移。兩極之間溶液中離子的定向移動和外部導線中電子的定向移動構成了閉合回路,使兩個電極反應不斷進行,發生有序的電子轉移過程,產生電流,實現化學能向電能的轉化。
從能量轉化角度看,原電池是將化學能轉化為電能的裝置;從化學反應角度看,原電池的原理是氧化還原反應中的還原劑失去的電子經導線傳遞給氧化劑,使氧化還原反應分別在兩個電極上進行。 原電池的構成條件有三個:
(1)電極材料由兩種金屬活動性不同的金屬或由金屬與其他導電的材料(非金屬或某些氧化物等)組成。
(2)兩電極必須浸泡在電解質溶液中。
(3)兩電極之間有導線連接,形成閉合回路。 只要具備以上三個條件就可構成原電池。而化學電源因為要求可以提供持續而穩定的電流,所以除了必須具備原電池的三個構成條件之外,還要求有自發進行的氧化還原反應。也就是說,化學電源必須是原電池,但原電池不一定都能做化學電池。
形成前提:總反應為自發的氧化還原反應
電極的構成:
a.活潑性不同的金屬—鋅銅原電池,鋅作負極,銅作正極;b.金屬和非金屬(非金屬必須能導電)—鋅錳干電池,鋅作負極,石墨作正極;c.金屬與化合物—鉛蓄電池,鉛板作負極,二氧化鉛作正極;d.惰性電極—氫氧燃料電池,電極均為鉑。
電解液的選擇:電解液一般要能與負極材料發生自發的氧化還原反應。 原電池正負極判斷:
負極發生氧化反應,失去電子;正極發生還原反應,得到電子。
電子由負極流向正極,電流由正極流向負極。 溶液中,陽離子移向正極,陰離子移向負極 電極反應方程式的書寫 負極:活潑金屬失電子,看陽離子能否在電解液中大量存在。如果金屬陽離子不能與電解液中的離子共存,則進行進一步的反應。
例:甲烷燃料電池中,電解液為KOH,負極甲烷失8個電子生成CO2和H2O,但CO2不能與OH-共存,要進一步反應生成碳酸根。
正極:①當負極材料能與電解液直接反應時,溶液中的陽離子得電子。例:鋅銅原電池中,電解液為HCl,正極H+
得電子生成H2。②當負極材料不能與電解液反應時,溶解在電解液中的O2得電子。如果電解液呈酸性,O2+4e-+4H+==2H2O;如果電解液呈中性或堿性,O2+4e-+2H2O==4OH-。
特殊情況:Mg-Al-NaOH,Al作負極。負極:Al-3e-+4OH-==AlO2-+2H2O;正極:2H2O+2e-==H2↑+2OH-
Cu-Al-HNO3,Cu作負極。
注意:Fe作負極時,氧化產物是Fe2+而不可能是Fe3+;肼(N2H4)和NH3的電池反應產物是H2O和N2
無論是總反應,還是電極反應,都必須滿足電子守恒、電荷守恒、質量守恒。 pH變化規律
電極周圍:消耗OH-(H+),則電極周圍溶液的pH減小(增大);反應生成OH-(H+),則電極周圍溶液的pH增大(減小)。
溶液:若總反應的結果是消耗OH-(H+),則溶液的pH減小(增大);若總反應的結果是生成OH-(H+),則溶液的pH增大(減小);若總反應消耗和生成OH-(H+)的物質的量相等,則溶液的pH由溶液的酸堿性決定,溶液呈堿性則pH增大,溶液呈酸性則pH減小,溶液呈中性則pH不變。
常用原電池方程式
1.Cu─H2SO4─Zn原電池
正極: 2H++ 2e- == H2↑ 負極: Zn - 2e- == Zn2+
總反應式: Zn + 2H+== Zn2++ H2↑
2.Cu─FeCl3─C原電池 正極: 2Fe3++ 2e- == 2Fe2+
負極: Cu - 2e- == Cu2+
總反應式: 2Fe3++ Cu == 2Fe2++ Cu2+
3.鋼鐵在潮濕的空氣中發生吸氧腐蝕
正極:O2 + 2H2O + 4e- == 4OH-
負極:2Fe - 4e- == 2Fe2+
總反應式:2Fe + O2 + 2H2O == 2Fe(OH)2
4.氫氧燃料電池(中性介質)
正極:O2 + 2H2O + 4e- == 4OH-
負極:2H2 - 4e-== 4H+
總反應式:2H2 + O2 == 2H2O
5.氫氧燃料電池(酸性介質)
正極:O2 + 4H++ 4e- == 2H2O
負極:2H2 - 4e-== 4H+
總反應式:2H2 + O2 == 2H2O
6.氫氧燃料電池(堿性介質)
正極:O2 + 2H2O + 4e- == 4OH-
負極:2H2 - 4e- + 4OH- == 4H2O
總反應式:2H2 + O2 == 2H2O
7.鉛蓄電池(放電)
正極 (PbO2) :
PbO2 + 2e- + SO42- + 4H+ == PbSO4 + 2H2O
負極 (Pb) :Pb- 2e-+ SO42-== PbSO4
總反應式:
Pb+PbO2+4H++ 2SO42- == 2PbSO4 + 2H2O
8.Al─NaOH─Mg原電池
正極:6H2O + 6e- == 3H2↑ + 6OH-
負極:2Al - 6e- + 8OH- == 2AlO2- + 4H2O
總反應式:2Al+2OH-+2H2O==2AlO2- + 3H2↑
9.CH4燃料電池(堿性介質)
正極:2O2 + 4H2O + 8e- == 8OH-
負極:CH4 -8e- + 10OH- == CO32- + 7H2O
總反應式:CH4 + 2O2 + 2OH- == CO32- + 3H2O *
10.熔融碳酸鹽燃料電池
(Li2CO3和Na2CO3熔融鹽作電解液,CO作燃料):
正極:O2 + 2CO2 + 4e- == 2CO32- (持續補充CO2氣體)
負極:2CO + 2CO32- - 4e- == 4CO2
總反應式:2CO + O2 == 2CO2
11.銀鋅紐扣電池(堿性介質)
正極 (Ag2O) :Ag2O + H2O + 2e- == 2Ag + 2OH-
負極 (Zn) :Zn + 2OH- -2e- == ZnO + H2O
總反應式:Zn + Ag2O == ZnO + 2Ag
1.物質在陽極是被氧化的啊,物質在陰極是被還原的!
金屬活動順序表 K Ca Na Mg Al Zn Fe Sn Pb h Cu Hg Ag Pt Au
還有要說一下的是,物質在負極是被氧化的,物質在正極被還原。分別正負電極,通常是比較電極的金屬活潑性!較活潑的是負極,另外一個就是正極!要注意的是有特別情況,例如 Al ,Mg 電解質是NaOH溶液。這個時候就是Al為負極,因為Mg不和NaOH反應!
陰陽極的分別方法是,連接電源正極的就是陽極,連接電源負極的就是陰極。
