自鋰離子電池問世以來,圍繞它的研究、開發(fā)工作一直不斷地進行著,上世紀90年代末又開發(fā)出鋰聚合物電池,2002年后則推出磷酸鐵鋰動力電池。
鋰離子電池內(nèi)部主要由正極、負極、電解質(zhì)及隔膜組成。正、負極及電解質(zhì)材料不同及工藝上的差異使電池有不同的性能,并且有不同的名稱。目前市場上的鋰離子電池正極材料主要是氧化鈷鋰(LiCoO2),另外還有少數(shù)采用氧化錳鋰(LiMn2O4)及氧化鎳鋰(LiNiO2)作正極材料的鋰離子電池,一般將后兩種正極材料的鋰離子電池稱為”鋰錳電池”及”鋰鎳電池”。新開發(fā)的磷酸鐵鋰動力電池是用磷酸鐵鋰(LiFePO4)材料作電池正極的鋰離子電池,它是鋰離子電池家族的新成員。
LiFePO4是一種鋰離子電池正極材料。LiFePO4在自然界是以磷鐵鋰礦形式存在的,其結(jié)構(gòu)穩(wěn)定、資源豐富、安全性能好、無毒。與傳統(tǒng)的鋰離子電池正極材料LiMn2O4和LiCoO2相比,LiFePO4 原料來源更廣泛、價格更低廉且無環(huán)境污染。環(huán)境友好、熱穩(wěn)定性好、是下一代鋰離子蓄電池正極最有競爭力的材料之一。LiFePO4材料雖然具有許多優(yōu)良的電化學(xué)性能,但是還存在擴散系數(shù)小等方面的問題。因而國內(nèi)外學(xué)者在提高LiFePO4的導(dǎo)電能力方面競相展開了研究。
一般鋰離子電池的電解質(zhì)是液體的,后來開發(fā)出固態(tài)及凝膠型聚合物電解質(zhì),則稱這種鋰離子電池為鋰聚合物電池,其性能優(yōu)于液體電解質(zhì)的鋰離子電池。磷酸鐵鋰電池的全名應(yīng)是磷酸鐵鋰鋰離子電池,這名字太長,簡稱為磷酸鐵鋰電池。由于它的性能特別適于作動力方面的應(yīng)用,則在名稱中加入”動力”兩字,即磷酸鐵鋰動力電池。也有人把它稱為”鋰鐵(LiFe)動力電池”。
LiFePO4電池中某電極的工作原理如圖:
(1)放電時,該裝置是原電池,F(xiàn)e元素化合價由+3價變?yōu)?2價,得電子發(fā)生還原反應(yīng),所以該電極是正極,電極反應(yīng)式為FePO4+e-+Li+=LiFePO4,
(2)電解含有0.01mol CuSO4和0.01molNaCl的混合溶液100mL,電路中轉(zhuǎn)移了0.02mol e-,
陽極:2Cl--2e -=Cl2↑,
0.01mol 0.01mol 0.005mol
4OH--4e-=2H2O+O2↑,
0.01mol 0.01mol 0.0025mol
陰極:Cu2++2e-=Cu
0.01mol 0.02mol
所以陽極上生成的氣體在標準狀況下的體積=(0.005mol+0.0025mol)×22.4L/mol=0.168L;
(3)鐵做陽極,碳做陰極電解飽和食鹽水,陽極Fe失電子生成亞鐵離子,則陽極的電極方程式為Fe-2e-=Fe2+,陰極氫離子得電子生成氫氣,則陰極的電極方程式為:2H++2e-=H2↑;溶液中生成Fe2+、H2、和OH-,則電解的總方程式為:Fe+2H2O 通電/.Fe(OH)2↓+H2↑;
FePO4電池的內(nèi)部結(jié)構(gòu)如圖下圖所示
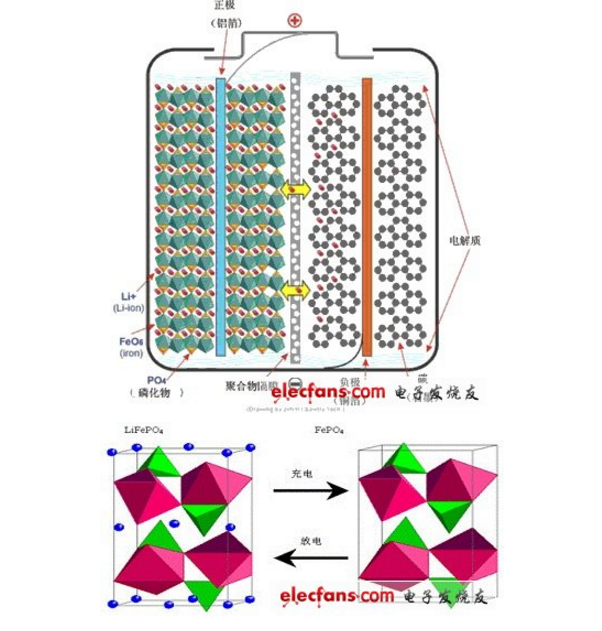
LiFePO4電池的結(jié)構(gòu)與工作原理
LiFePO4電池的內(nèi)部結(jié)構(gòu)如圖1所示。左邊是橄欖石結(jié)構(gòu)的LiFePO4作為電池的正極,由鋁箔與電池正極連接,中間是聚合物的隔膜,它把正極與負極隔開,但鋰離子Li+可以通過而電子e-不能通過,右邊是由碳(石墨)組成的電池負極,由銅箔與電池的負極連接。電池的上下端之間是電池的電解質(zhì),電池由金屬外殼密閉封裝。
磷酸鐵鋰電池工作原理
上邊是橄欖石(olivine)結(jié)構(gòu)的LiFePO4作為電池的正極,由鋁箔(aluminium foil)與電池正極連接,左邊是聚合物(polymer)的隔膜(diaphragm),它把正極與負極隔開,但鋰離子Li 可以通過而電子e-不能通過,右邊是由碳(carbon)(石墨graphite)組成的電池負極,由銅箔(copper foil)與電池的負極連接。電池的上下端之間是電池的電解質(zhì)(electrolyte),電池由金屬外殼密閉封裝。
LiFePO4電池在充電時,正極中的鋰離子Li 通過聚合物隔膜向負極遷移;在放電過程中,負極中的鋰離子Li 通過隔膜向正極遷移。鋰離子電池就是因鋰離子在充放電時來回遷移而命名的。
1、電池充電時,Li 從磷酸鐵鋰晶體的010面遷移到晶體表面,在電場力的作用下,進入電解液,穿過隔膜,再經(jīng)電解液遷移到石墨晶體的表面,然后嵌入石墨晶格中。與此同時,電子經(jīng)導(dǎo)電體流向正極的鋁箔集電極,經(jīng)極耳、電池極柱、外電路、負極極柱、負極耳流向負極的銅箔集流體,再經(jīng)導(dǎo)電體流到石墨負極,使負極的電荷達至平衡。鋰離子從磷酸鐵鋰脫嵌后,磷酸鐵鋰轉(zhuǎn)化成磷酸鐵,其晶格結(jié)構(gòu)變化如上圖-2。
2、電池放電時,Li 從石墨晶體中脫嵌出來,進入電解液,穿過隔膜,再經(jīng)電解液遷移到磷酸鐵鋰晶體的表面,然后重新經(jīng)010面嵌入到磷酸鐵鋰的晶格內(nèi)。與此同時,電池經(jīng)導(dǎo)電體流向負極的銅箔集電極,經(jīng)極耳、電池負極柱、外電路、正極極柱、正極極耳流向電池正極的鋁箔集流體,再經(jīng)導(dǎo)電體流到磷酸鐵鋰正極,使正極的電荷達至平衡。
從磷酸鐵鋰電池的工作原理可知,磷酸鐵鋰電池的充放電過程需要鋰離子和電子的共同參與,而且鋰離子的遷移速度與電子的遷移速度要達至平衡。這就要求鋰離子電池的正負電極必須是離子和電子的混合導(dǎo)體,而且其離子導(dǎo)電能力和電子導(dǎo)電能力必須一致。但是眾所周知,磷酸鐵鋰的導(dǎo)電性能很差。而石墨負極的導(dǎo)電性雖然要好一些,但是要實現(xiàn)大倍率放電時,仍然需要改善負極的導(dǎo)電性,使其的電子導(dǎo)電能力與鋰離子從石墨中脫嵌的能力達至平衡。
